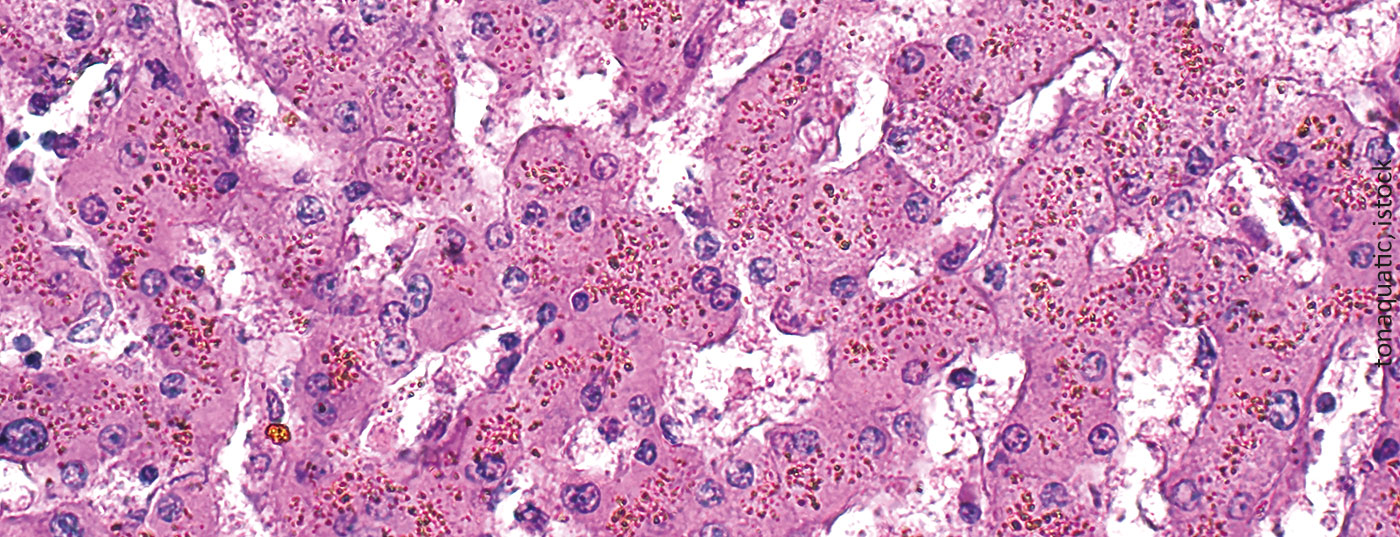
Il sovraccarico di ferro è una conseguenza inevitabile e potenzialmente pericolosa per la vita di trasfusioni multiple di concentrati di globuli rossi. Poiché le manifestazioni cliniche sono aspecifiche e di solito si sviluppano lentamente, questa complicanza viene spesso trascurata.
Il sovraccarico di ferro è una conseguenza inevitabile e potenzialmente pericolosa per la vita di trasfusioni multiple di concentrati di globuli rossi. Poiché le manifestazioni cliniche sono aspecifiche e di solito si sviluppano lentamente, questa complicanza viene spesso trascurata.
In genere, oggi non si fa più una distinzione tra sovraccarico di ferro primario e secondario, perché tale definizione dipende, tra l’altro, dalla sensibilità dei metodi di esame. Il termine “siderosi” viene solitamente utilizzato per descrivere il deposito di ferro senza danno tissutale, come avviene con il deposito locale di ferro dovuto a un’emorragia (ad esempio, la siderosi polmonare).
Insorgenza di un sovraccarico di ferro
Una tipica dieta occidentale contiene circa 6 mg di ferro/1000 kcal, di cui solo 1-2 mg/giorno (circa il 10%) vengono normalmente assorbiti e un massimo di 3-5 mg/giorno quando l’assorbimento intestinale del ferro è regolato. Il ferro di deposito normale è di 500-1000 mg negli uomini e di 300-400 mg nelle donne in pre-menopausa e si trova soprattutto nel fegato. L’organismo non ha meccanismi fisiologici attivi per espellere il ferro in eccesso. Gli adulti sani espellono circa 1 mg di ferro al giorno attraverso la pelle e le cellule gastrointestinali; le donne in pre-menopausa perdono in media altri 0,5-1 mg al giorno attraverso le mestruazioni.
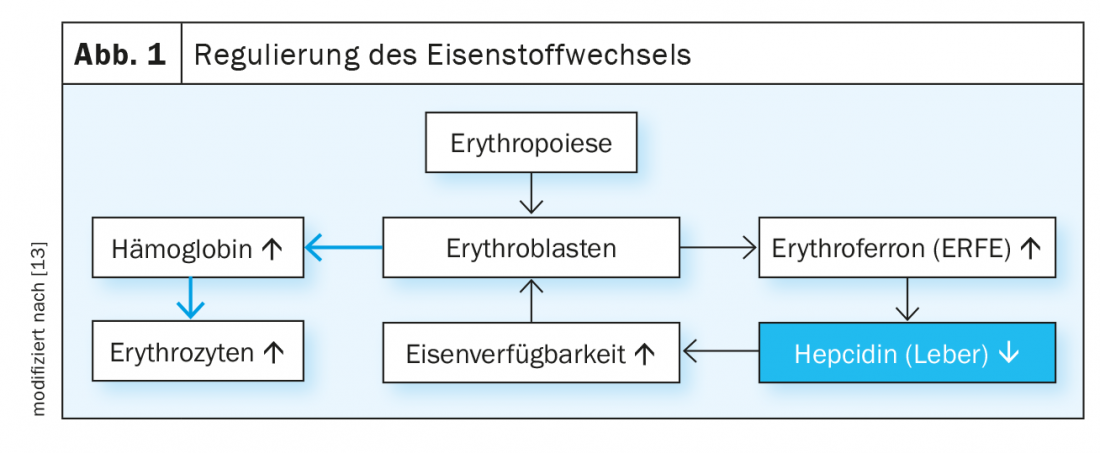
I livelli di ferro plasmatico sono regolati dal sistema epcidina/ferroportina (Fig. 1). L’ormone peptidico hepcidin induce la degradazione della proteina di esportazione del ferro ferroportina. La ferroportina è espressa principalmente nelle cellule della mucosa duodenale, nelle cellule del fegato e nei macrofagi e media la regolazione dell’assorbimento del ferro dal cibo, il rilascio del ferro dal fegato come richiesto e il riciclo del ferro nei macrofagi. Con una disponibilità di ferro sufficiente, la sintesi epatica di epcidina aumenta, bloccando l’ulteriore assorbimento di ferro a livello gastrointestinale. L’anemia cronica e l’eritropoiesi inefficace, d’altra parte, portano all’inibizione della sintesi dell’epcidina nel fegato e quindi a un maggiore assorbimento di ferro nel duodeno. L’ormone eritroferrone, che viene prodotto sotto l’influenza dell’eritropoietina negli eritroblasti, sopprime anche la produzione di epcidina e quindi stimola l’assorbimento del ferro e la mobilitazione dalle riserve in situazioni di stress eritropoietico.
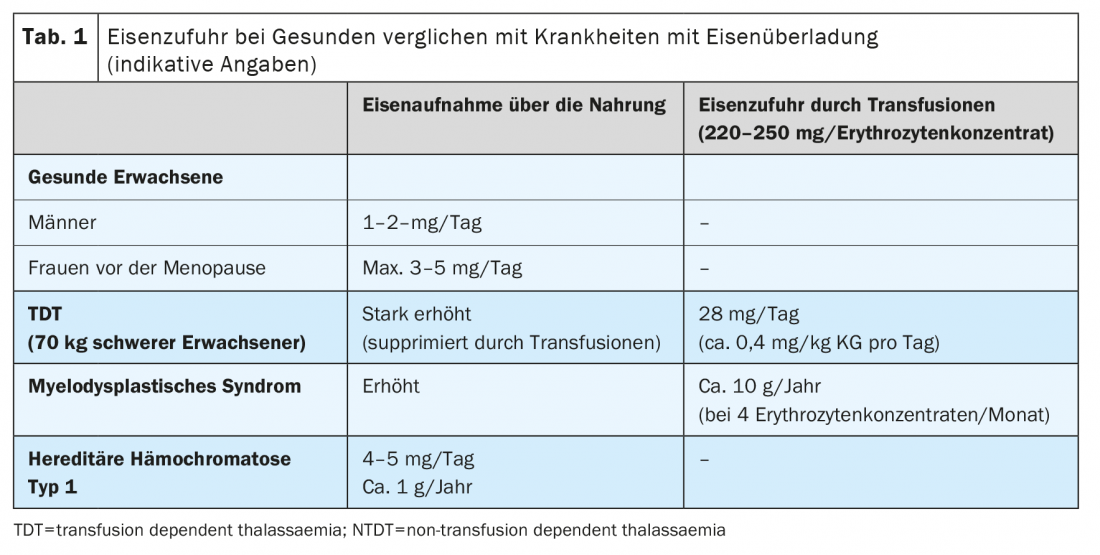
L’accumulo eccessivo di ferro è dovuto a due meccanismi principali: L’apporto iatrogeno di ferro attraverso le trasfusioni di concentrati di globuli rossi e l’aumento dell’assunzione di ferro dagli alimenti. Ogni concentrato di globuli rossi contiene 220-250 mg di ferro. Nei pazienti adulti, il deposito di ferro rilevante si verifica dopo 15-20 trasfusioni, nei bambini piccoli già dopo più di 10 somministrazioni di concentrati di globuli rossi. L’aumento dell’assorbimento gastrointestinale gioca un ruolo centrale in tutte le situazioni di eritropoiesi aumentata o inefficace. In questo caso, gli eritroblasti muoiono per morte cellulare nel midollo osseo prima di poter maturare in eritrociti. Questo porta alla sovrastimolazione e all’iperplasia dell’eritropoiesi, che varia a seconda della malattia di base. Quanto più pronunciata è la compromissione dell’eritropoiesi, tanto più l’assorbimento di ferro dagli alimenti viene regolato (Tab. 1).
Nell’emocromatosi ereditaria, un disturbo genetico del metabolismo del ferro senza anemia, il deposito di ferro deriva dalla disregolazione dell’asse epcidina-ferroportina, più comunemente dalla diminuzione della produzione di epcidina (come nell’emocromatosi ereditaria di tipo 1). Più raramente, c’è una disfunzione di altre molecole che regolano il ferro.
A seconda della malattia, il decorso e l’entità dell’accumulo di ferro e la distribuzione del ferro negli organi sono diversi. Questo è influenzato anche da altri fattori, come le infezioni croniche (ad esempio, l’epatite cronica) e le malattie metaboliche (ad esempio, la steatoepatite).
Effetti dell’eccesso di ferro sulle cellule
La tossicità associata al ferro si osserva soprattutto nei tessuti che lo immagazzinano in alte concentrazioni. Si tratta in particolare del fegato, del sistema endocrino e del miocardio. Il ferro delle trasfusioni si deposita prima nei macrofagi del fegato, della milza e del midollo osseo, poi negli epatociti e solo successivamente negli organi endocrini (soprattutto nel pancreas) e nel muscolo cardiaco.
Il ferro circolante viene legato dalla proteina transferrina e poi consegnato alle cellule tramite il legame della transferrina ai recettori appropriati (TfR1, espresso su tutte le cellule, e TfR2, presente sugli epatociti). La proporzione normale di transferrina legata al ferro è del 16-45% e si misura come saturazione della transferrina. In presenza di ferro in eccesso, la capacità di legame della transferrina viene superata e a livelli superiori al 70-75%, compaiono molecole di ferro non legate in circolo (ferro non legato alla transferrina , NTBI), che vengono rapidamente assorbite nelle cellule attraverso percorsi non regolati (ad esempio, attraverso i canali del calcio nelle cellule del miocardio). L’assunzione continua di NTBI aumenta sia le riserve fisiologiche di ferro intracellulare (ferritina) sia la comparsa di forme di ferro labile. Questi ultimi catalizzano reazioni biochimiche come la reazione di Fenton, producendo radicali reattivi dell’ossigeno (ROS). Le conseguenze sono la perossidazione delle molecole intracellulari, soprattutto dei lipidi, con danni agli organelli, la morte cellulare, la stimolazione della fibrogenesi e infine la disfunzione dell’organo. Inoltre, il DNA viene danneggiato, il che può portare all’instabilità del genoma e alla tendenza alla mutagenesi (Fig. 2) .
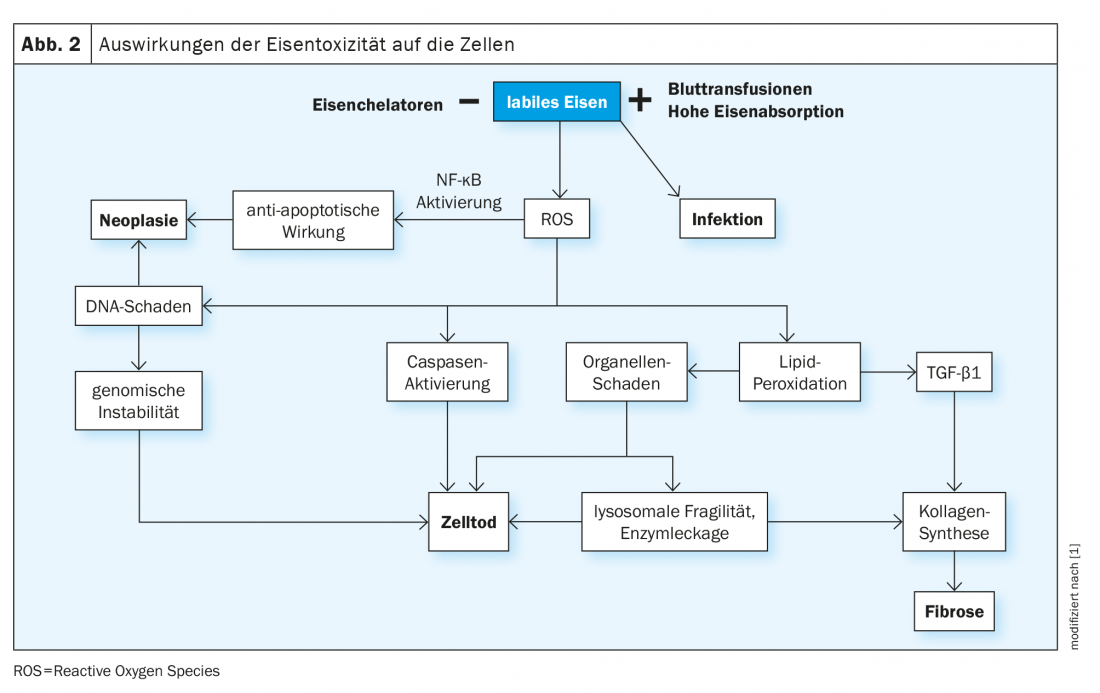
Il deposito di ferro è tollerato in modo diverso dai vari tessuti. Per esempio, il fegato può immagazzinare molto più ferro rispetto al miocardio, senza conseguenze dannose. Un altro fattore decisivo per lo sviluppo del danno agli organi è la durata dell’esposizione delle cellule all’NTBI. Questo può persistere per diversi decenni nelle malattie congenite dipendenti dalla trasfusione, come la talassemia major, ed è associato a un aumento del rischio di tumori maligni.
Un effetto sottovalutato del sovraccarico di ferro è quello di favorire la crescita batterica e il corrispondente rischio di infezioni. La rapida disponibilità di ferro libero per i microrganismi, da un lato, e gli effetti sulla funzione dei macrofagi e dei leucociti, dall’altro, spiegano la maggiore suscettibilità alle infezioni dei pazienti con talassemia trasfusione-dipendente. Le nuove osservazioni mostrano anche che l’eccesso di ferro provoca uno stress ossidativo sull’endotelio di tutti i vasi e una ridotta esportazione di colesterolo da parte dei macrofagi nella parete del vaso, che può portare a una maggiore formazione di placche.
Pazienti a rischio di sovraccarico di ferro
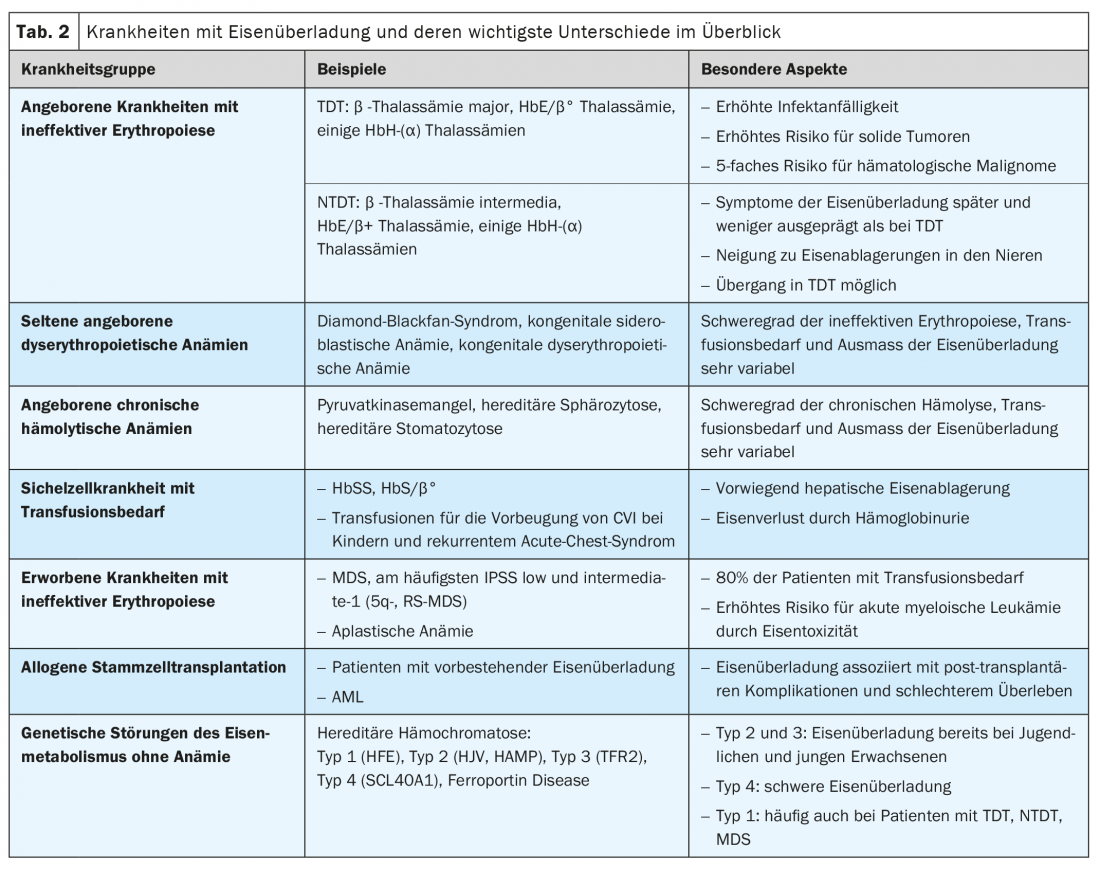
Le situazioni cliniche associate al sovraccarico di ferro comprendono le malattie congenite e acquisite con eritropoiesi inefficace (ad esempio, talassemia e sindrome mielodisplastica), le malattie emolitiche croniche, la malattia a cellule falciformi (SCD) che richiede trasfusioni e i disturbi genetici del metabolismo del ferro senza anemia (emocromatosi ereditaria). (Tab. 2). Inoltre, l’eccesso di ferro è di importanza prognostica nei pazienti dopo il trapianto di cellule staminali allogeniche.
Talassemia trasfusione-dipendente (TDT) e talassemia non trasfusione-dipendente (NTDT)
Le sindromi talassemiche sono tra le malattie genetiche più comuni al mondo e sono causate da difetti genici sul cromosoma 11(β-talassemia) o 16(α-talassemia), che portano a una sintesi ridotta o assente delle catene globiniche corrispondenti. L’enorme numero di varianti genetiche e le loro combinazioni descritte finora, così come il tipo di ereditarietà, spiegano l’elevata variabilità clinica. Da un punto di vista clinico, si distingue tra talassemie dipendenti dalla trasfusione (TDT) e non dipendenti dalla trasfusione (NTDT). Questa suddivisione corrisponde grosso modo a quella in Thalassämia major e intermedia.
La β-talassemia major è considerata il paradigma delle malattie da TDT e da sovraccarico di ferro. La caratteristica principale della TDT è un’eritropoiesi gravemente compromessa o assente, che deriva da una ridotta sintesi di emoglobina e dalla precipitazione delle catene globiniche in eccesso(α o β). C’è una grave anemia con, da un lato, una necessità di trasfusioni per tutta la vita a partire dal primo anno di vita e, dall’altro, un assorbimento di ferro intestinale massimamente stimolato. Quindi, l’enorme apporto giornaliero di ferro dagli alimenti e l’apporto iatrogeno di ferro, che da solo ammonta a circa 0,4 mg/kg di peso corporeo al giorno, si sommano. I sintomi classici del sovraccarico di ferro nella TDT sono l’epatopatia (fibrosi, cirrosi, carcinoma epatocellulare), la cardiopatia (soprattutto la cardiopatia ritmica e dilatativa), le endocrinopatie (diabete mellito, ipotiroidismo, ipogonadismo) e l’osteoporosi (Fig. 3) .
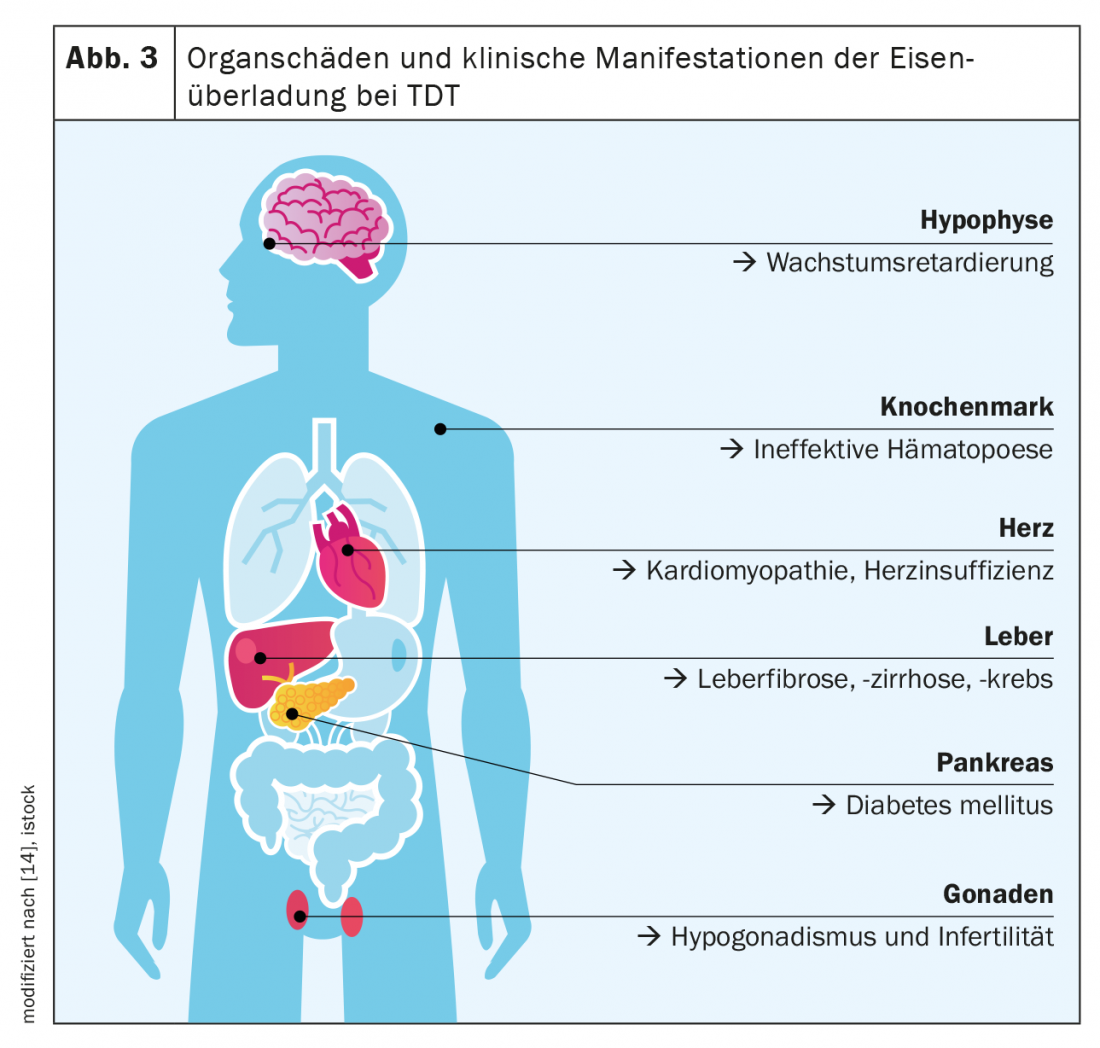
Con l’introduzione della terapia trasfusionale negli anni ’70, l’aspettativa di vita dei pazienti con TDT è stata estesa fino alla pubertà, con l’insufficienza cardiaca ed endocrina come cause di morte più comuni. Grazie alla possibilità di effettuare la chelazione del ferro, i pazienti con TDT hanno oggi un’aspettativa di vita di 40-50 anni o più e presentano forme meno gravi di cardiopatie ed endocrinopatie. Tuttavia, esiste un aumento del rischio di tumori maligni, in particolare di carcinomi gastrointestinali, e un rischio più che quintuplicato di neoplasie ematologiche come conseguenza a lungo termine della tossicità del ferro.
Nella NTDT, l’aumento dell’assorbimento di ferro (circa 0,01 mg/kg di peso corporeo al giorno) è la conseguenza di un forte aumento dell’eritropoiesi e rappresenta il principale meccanismo di deposito di ferro. Poiché l’accumulo di ferro nella NTDT si sviluppa lentamente, le manifestazioni cliniche non si verificano fino alla tarda infanzia o addirittura alla prima età adulta. I sintomi del sovraccarico di ferro sono generalmente meno pronunciati, il coinvolgimento cardiaco meno frequente e il rischio di neoplasia più basso rispetto alla TDT. Tuttavia, i pazienti con NTDT hanno la tendenza ad accumulare ferro nei reni, che può portare a disfunzioni interstiziali e glomerulari. È importante notare che la NTDT può trasformarsi in TDT nel corso della vita.
Anemie congenite rare con eritropoiesi inefficace e anemie emolitiche croniche congenite
Anche nelle anemie congenite, come la sindrome di Diamond-Blackfan, la gravità dell’eritropoiesi inefficace e dell’anemia, così come la necessità di trasfusione, determinano l’entità del sovraccarico di ferro. I dati specifici sono scarsi per queste malattie rare. A seconda della necessità di trasfusione, che può essere rilevante anche nei bambini piccoli, i rischi e le manifestazioni cliniche del sovraccarico di ferro sono simili a quelli della TDT e della NTDT.
Le enzimopatie eritrocitarie congenite, come il deficit di piruvato chinasi, le membranopatie (ad esempio la sferocitosi ereditaria) e i disturbi della sintesi dell’ema (ad esempio le porfirie) portano a un’emolisi cronica più o meno pronunciata e quindi a un’iperplasia dell’eritropoiesi. Il sovraccarico di ferro può verificarsi nei soggetti affetti anche senza trasfusioni (fino al 47% dei pazienti con deficit di piruvato chinasi), con sintomi corrispondenti che si manifestano tipicamente in età adulta e solo raramente nell’infanzia. Nella sferocitosi ereditaria, che è la causa più comune di emolisi cronica con una prevalenza stimata da 1:2000 a 1:2500, solo una parte dei pazienti richiede trasfusioni sporadicamente o regolarmente.
Malattia a cellule falciformi (SCD) con necessità di trasfusione
Le trasfusioni regolari sono indicate nei pazienti con SCD solo in situazioni specifiche, tra cui la prevenzione di insulti cerebrovascolari nei bambini e la sindrome toracica acuta ricorrente o le crisi vaso-occlusive gravi. In questi casi, spesso vengono eseguite trasfusioni di scambio manuali o automatiche, che non sono associate a un aumento dell’apporto di ferro correlato alla trasfusione.
I pazienti con SCD spesso perdono ferro attraverso l’emoglobinuria (in quantità equivalenti a 10 concentrati di globuli rossi all’anno) e hanno bassi livelli plasmatici di NTBI. Pertanto, il sovraccarico di ferro si sviluppa solo in una percentuale relativamente piccola di persone colpite e i sintomi – soprattutto l’epatopatia e la fibrosi epatica – compaiono in genere più tardi nella vita. Sebbene il danno endocrino o cardiaco sia raro nei pazienti con SCD, le manifestazioni cliniche del sovraccarico di ferro e la SCD stessa sono spesso difficili da distinguere e il danno agli organi legato al ferro è talvolta sottostimato. Gli studi dimostrano che fino all’11% dei pazienti con SCD muore a causa del sovraccarico di ferro. A causa dell’aspettativa di vita sempre più lunga, si prevede che le complicanze a lungo termine associate al ferro aumenteranno anche nella SCD, come nella TDT e nella NTDT.
Anemia cronica acquisita dovuta a un’insufficienza del midollo osseo
La sindrome mielodisplastica (MDS) comprende un gruppo di malattie acquisite caratterizzate da un’insufficienza del midollo osseo di vario grado e dalla possibilità di sviluppare una leucemia mieloide acuta. La SMD è una delle neoplasie ematologiche più comuni (incidenza di circa 4/100.000 in Europa) e colpisce soprattutto i pazienti anziani (età mediana alla diagnosi 71 anni).
Nelle SMD a basso rischio (IPSS basso e intermedio-1), le citopenie sono predominanti, con l’anemia dovuta all’eritropoiesi inefficace che si verifica in circa l’80% dei casi. Poiché la maggior parte dei pazienti con MDS diventa dipendente dalle trasfusioni, spesso sviluppano un sovraccarico di ferro. Le differenze più importanti rispetto alla TDT e alla NTDT sono l’età molto più avanzata dei pazienti al momento della diagnosi e l’elevata stabilità genomica dei cloni displastici nel midollo osseo. Come per la TDT, le complicanze cardiache sono comuni nei pazienti MDS trasfusi regolarmente (82,4% rispetto al 67,1% dei pazienti non trasfusi). Un’importanza particolare della tossicità del ferro nella MDS risiede nella promozione della progressione verso la leucemia acuta e nell’influenza negativa sulla sopravvivenza dopo il trapianto di cellule staminali allogeniche.
Trapianto di cellule staminali allogeniche
Il trapianto allogenico di cellule staminali è un trattamento potenzialmente curativo per i pazienti con TDT, SCD e MDS e altre malattie con deposito di ferro. L’influenza del sovraccarico di ferro sul successo del trapianto allogenico di cellule staminali, in particolare sulla mortalità associata alla terapia, è stata descritta per la prima volta nelle talassemie e ora è sempre più riconosciuta in altri quadri clinici.
Anche la tossicità della chemioterapia può essere in parte attribuita agli effetti negativi del sovraccarico di ferro, poiché durante il condizionamento si verifica una massiccia mobilitazione delle riserve di ferro dal midollo osseo con rilascio di NTBI. I requisiti trasfusionali prima e dopo il trapianto influenzano il decorso peri-trapiantologico. I dati mostrano che l’88% dei pazienti con MDS e il 97% dei pazienti con leucemia mieloide acuta presentano livelli elevati di ferritina prima del trapianto e che l’eccesso di ferro è associato a mucosite, ostruzione dei vasi epatici sinusoidali, sepsi e sopravvivenza complessiva inferiore.
Disturbi genetici del metabolismo del ferro senza anemia
L’aumento dell’assorbimento intestinale del ferro è il correlato fisiopatologico delle varie forme di emocromatosi ereditaria. L’assunzione di ferro può essere aumentata fino a 4 mg al giorno, cioè 2-4 volte di più rispetto ai soggetti senza emocromatosi ereditaria (Tabella 1) .
Nell’emocromatosi ereditaria associata all’HFE (tipo 1), una delle malattie genetiche più comuni nella popolazione europea, il ferro si deposita molto lentamente (circa 1 g/anno) e i sintomi compaiono tipicamente in età adulta (tra i 40 e i 50 anni negli uomini, spesso dopo la menopausa nelle donne). Le manifestazioni cliniche più comuni sono epatopatia, artropatie e diabete mellito. La tempistica e la gravità dell’accumulo di ferro variano a seconda della mutazione sottostante. Alcune forme rare, come l’emocromatosi giovanile (tipo 2), sono più aggressive e portano a un accumulo di ferro rilevante già nella pubertà.
A causa della sua frequenza, l’emocromatosi ereditaria, in particolare il tipo 1, viene rilevata non di rado nei pazienti con talassemia, MDS o rischi di accumulo patologico di ferro e rappresenta quindi un fattore aggiuntivo nello sviluppo di un sovraccarico di ferro potenzialmente grave.
Messaggi da portare a casa
- L’aumento dell’assorbimento intestinale di ferro e l’assunzione iatrogena di ferro attraverso le trasfusioni di concentrati di globuli rossi sono i meccanismi principali per lo sviluppo del sovraccarico di ferro.
- L’accumulo patologico di ferro si verifica nelle malattie ematologiche congenite e acquisite con eritropoiesi inefficace, anche in assenza di trasfusioni regolari.
- Il sovraccarico di ferro si sviluppa più rapidamente e in misura maggiore nei pazienti regolarmente trasfusi rispetto alle malattie non trasfusione-dipendenti; nei disturbi genetici del metabolismo del ferro (emocromatosi ereditaria), il ferro si deposita molto più lentamente in confronto.
- Nella SMD, l’eccesso di ferro cellulare può aumentare l’instabilità del genoma nei cloni di cellule pre-leucemiche, promuovendo la trasformazione in leucemia acuta.
- Il sovraccarico di ferro è associato a complicazioni cliniche e ad un aumento della mortalità dopo il trapianto di cellule staminali allogeniche.
- L’emocromatosi ereditaria, data la sua frequenza, può essere presente in pazienti con altri rischi di sovraccarico di ferro clinicamente rilevante e può influenzare il decorso clinico.
Letteratura:
- Porter JB, et al: Nuove intuizioni sulla tossicità del ferro correlata alla trasfusione: implicazioni per l’oncologo. Crit Rev Oncology/Hematology 2016; 99: 261-271
- Camaschella C, Nai A, Silvestri L: Metabolismo del ferro e disturbi del ferro rivisitati nell’era dell’epcidina. Ematologica 2020; 105: 260-72
- Porter JB, Garbowski M: La fisiopatologia del sovraccarico di ferro trasfusionale. Ematologia. Oncol Clin N Am 2014; 28: 683-701.
- Hahalis G, et al.: Disfunzione vasomotoria globale e invecchiamento vascolare accelerato nella beta-talassemia major. Aterosclerosi 2008; 198 (2): 448-457.
- Gardenghi S, et al.: L’eritropoiesi inefficace nella beta-talassemia è caratterizzata da un aumento dell’assorbimento di ferro mediato dalla down-regulation dell’epcidina e dalla up-regulation della ferroportina. Sangue 2007; 109(11): 5027-5035.
- Vento S, Cainelli F, Cesario F: Infezioni e talassemia. Lancet Infect Dis 2006; 6(4): 226-233.
- Porter J, Garbowski M: Conseguenze e gestione del sovraccarico di ferro nella malattia a cellule falciformi. Ematologia Am Soc Hematol Educ Program. 2013; 2013: 447-456.
- Roggero S, et al: Grave sovraccarico di ferro nell’anemia Blackfan-Diamond: uno studio caso-controllo. Am J Hematol. 2009; 84: 729-32.
- Zanella S, Garani MC, Borgna-Pignatti C: Malignità e talassemia: una revisione della letteratura. Ann N Y Acad Sci 2016; 1368(1): 140-148.
- Gattermann N: Sovraccarico di ferro nelle sindromi mielodisplastiche (MDS). Int J Hematol 2018; 107: 55-63.
- Koreth J, Antin JH: Sovraccarico di ferro nelle neoplasie ematologiche ed esito del trapianto di cellule staminali ematopoietiche allogeniche. Haematologica 2010; 95: 364-366.
- Pilling LC, et al: Condizioni comuni associate alle varianti genetiche dell’emocromatosi ereditaria: studio di coorte nella UK Biobank. BMJ 2019; 364: k5222.
- Leuenberger N, et al.: L’epcidina come potenziale biomarcatore del doping ematico. Drug Test Anal 2017; 9(7): 1093-1097.
- Novartis: Vivere con le trasfusioni. www.leben-mit-transfusionen.de/eisenueberladung/krankheitsbild (ultimo accesso 10.02.2022)
InFo ONCOLOGIA ED EMATOLOGIA 2022; 10(1): 12-17