Sebbene il tumore al testicolo rappresenti solo l’1% delle malattie oncologiche negli uomini, è il tipo di cancro più comune nei ragazzi. Il PD Dr. med. Richard Cathomas, vice primario dell’Ospedale Cantonale dei Grigioni, ha fornito interessanti informazioni sulla diagnostica e sulla terapia degli stadi iniziali della malattia in occasione del Congresso Svizzero di Oncologia ed Ematologia SOHC.
Nel mondo occidentale, ogni anno a 3-10 uomini su 100.000 viene diagnosticato un tumore al testicolo; in Svizzera, questo colpisce ancora circa 400 pazienti, per lo più giovani. Mentre i tumori non seminomatosi si trovano più frequentemente negli under 30, la percentuale di seminomi aumenta tra i 30 e i 40 anni. Complessivamente, il 95% dei casi è costituito da tumori a cellule germinali, e il 70% viene rilevato allo stadio I. La diagnosi più comune è “seminoma di stadio I”, ovvero in circa la metà delle persone colpite. Ma cosa significa in termini concreti?
Stadiazione e istologia
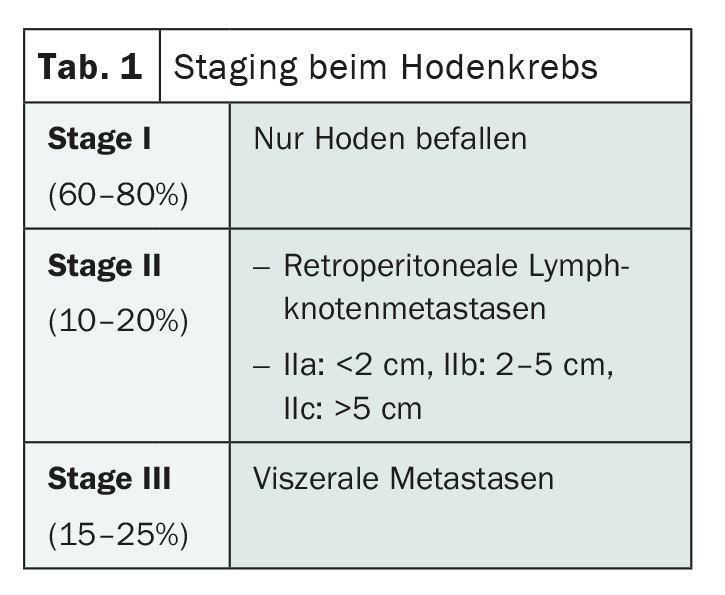
I tumori delle cellule germinali del testicolo si dividono istologicamente nelle due categorie dei seminomi e dei non seminomi, con una certa predominanza dei seminomi. Il Dr. Cathomas sottolinea che qualsiasi tumore che presenti parti non seminomatose deve essere considerato un non-seminoma e trattato di conseguenza. In entrambi i gruppi, la stadiazione si basa sugli stessi criteri. Mentre il tumore è limitato ai testicoli nello stadio I, i linfonodi retroperitoneali sono colpiti nello stadio II e gli organi viscerali, in particolare i polmoni, sono colpiti anche nello stadio III. (Tab.1). Per una suddivisione più precisa e una migliore valutazione della prognosi, esiste un’ulteriore classificazione per gli stadi II e III, basata sui cosiddetti gruppi di rischio IGCCCG (International Germ Cell Cancer Collaborative Group).
La diagnostica nella confusione delle linee guida
Dalla Consensus ESMO alle Linee Guida NCCN e EAU: esistono numerose raccomandazioni per la gestione ottimale del tumore del testicolo [1–3]. In occasione del SOHC, il Dr. Cathomas ha presentato una via di mezzo, che – in modo del tutto svizzero – rappresenta un compromesso tra le diverse linee guida ed è solitamente seguita in questo Paese.
Oltre all’anamnesi e all’esame clinico, la diagnosi deve includere un’ecografia testicolare bilaterale, la determinazione dei marcatori tumorali HCG, AFP e LDH e una TAC torace/addome/pelvi (panoramica 1) . L’esperto sconsiglia esplicitamente di eseguire una PET-CT. Nei soggetti di età inferiore ai 40 anni con testicoli piccoli, microlitiasi o maldescenza, deve essere eseguita una biopsia del lato non interessato, per escludere il coinvolgimento simultaneo del secondo testicolo. Idealmente, l’esame istologico dopo l’orchiectomia si svolge in un centro specializzato.

Nel post-operatorio, i marcatori tumorali devono essere monitorati fino a quando non si sono normalizzati, non hanno raggiunto un nadir o – meno favorevolmente – sono in aumento. Si raccomanda inoltre di ripetere la TAC dopo sei-otto settimane in caso di risultati poco chiari, prima di decidere l’ulteriore procedura terapeutica, anche se i marcatori tumorali sono nella norma. In caso di malattia metastatica e di prognosi intermedia o addirittura infausta, il dottor Cathomas raccomanda inoltre l’uso di una risonanza magnetica cranica.
Secondo l’esperto, una radiografia del torace è sufficiente per il follow-up radiologico, anche se deve essere effettuata solo per i non-seminomi. Anche la risonanza magnetica addominale è superiore alla TAC.
Un’opzione di cui nessun paziente dovrebbe privarsi è la crioconservazione dello sperma. Questa possibilità dovrebbe essere discussa al più tardi prima dell’inizio della radio o della chemioterapia e dovrebbe essere raccomandata a tutte le persone che desiderano avere un figlio.
I marcatori tumorali in sintesi
I tre marcatori tumorali alfa fetoproteina (AFP), gonadotropina corionica umana (hCG) e lattato deidrogenasi (LDH ) svolgono da tempo un ruolo importante nella diagnosi e nel monitoraggio del tumore al testicolo (Tab. 2). La loro interpretazione è spesso sufficiente per distinguere, ad esempio, tra tumori seminomatosi e non seminomatosi. Per esempio, l’AFP non è mai misurabile nei seminomi, mentre l’hCG può aumentare sia nei seminomi che nei non seminomi. Poiché si verifica anche un leggero aumento senza significato clinico, si consiglia cautela nell’interpretazione dei valori di AFP. Anche l’LDH, più aspecifico, deve essere interpretato con cautela, ma secondo il dottor Cathomas, dovrebbe essere misurato prima di iniziare la terapia e al momento del follow-up. La conoscenza dell’emivita può semplificare la progettazione dei marcatori. Mentre per l’AFP il tempo è di cinque-sei giorni, per l’hCG è di 24-36 ore. I valori dei marcatori dopo l’orchiectomia sono decisivi per la classificazione del rischio secondo l’IGCCCG.

Terapia di una malattia prognosticamente favorevole: focus sul tasso di ricaduta
Se la diagnosi conferma la diagnosi più comune di cancro del testicolo, un seminoma al primo stadio, la prognosi è favorevole. I prerequisiti per questo sono l’assenza di metastasi nella stadiazione, la normalizzazione postoperatoria dei marcatori tumorali, in particolare dell’hCG, l’assenza di aumento dell’AFP e l’assenza di parti tumorali non seminomatose. Indipendentemente dalla terapia scelta, la sopravvivenza malattia-specifica a 10 anni in questo caso è superiore al 99%, con tassi di recidiva fino al 30%; le dimensioni del tumore e l’invasione della rete testicolare sono fattori prognostici sfavorevoli. Tuttavia, questi non vengono presi in considerazione nella scelta del trattamento. La terapia adiuvante con una dose singola di carboplatino AUC 7 o la radioterapia retroperitoneale possono ridurre il tasso di recidiva a circa il 5%. La sorveglianza attiva dopo l’orchiectomia rimane lo standard di cura per tutti i pazienti, nonostante questa riduzione del rischio, secondo il dottor Cathomas. Tuttavia, sottolinea che la chemioterapia adiuvante può essere utile, soprattutto se le dimensioni del tumore superano i 4 cm, mentre sconsiglia vivamente l’uso della radioterapia adiuvante.
Se il tumore testicolare di nuova diagnosi è un non-seminoma senza metastasi e con valori di AFP e hCG normali nel post-operatorio, la situazione è un po’ diversa. Sebbene anche in questo caso la prognosi sia altrettanto favorevole come nel seminoma, esiste un sottogruppo con tassi di recidiva di circa il 50%. Si tratta di tumori che mostrano un’invasione linfovascolare e sono chiamati tumori ad alto rischioper questa caratteristica. Per ridurre il tasso di recidiva, si raccomanda un ciclo di BEP (bleomicina, etoposide, cisplatino) come adiuvante per questi tumori germinali non seminomatosi ad alto rischio. In questo modo, il rischio di recidiva può essere ridotto a meno del 4%, secondo il dottor Cathomas. Per tutti gli altri non-seminomi in stadio I, invece, è sufficiente la sorveglianza attiva. Esistono linee guida chiare sia per i tumori germinali seminomatosi che per quelli non seminomatosi, che prevedono il monitoraggio regolare dei marcatori tumorali e la diagnostica per immagini mediante TAC o RMN addominale, nonché radiografie del torace per i non seminomi, soprattutto nei primi cinque anni.
Fonte: Congresso Svizzero di Oncologia ed Ematologia 18-21.11.2020, Sessione On Demand “Tumore del testicolo: strumenti diagnostici e gestione fase I”, PD Dr. med. Richard Cathomas, Vice Primario di Oncologia ed Ematologia dell’Ospedale Cantonale dei Grigioni.
Letteratura:
- Gilligan T, et al: Cancro del testicolo, versione 2.2020, Linee guida di pratica clinica in oncologia NCCN. J Natl Compr Canc Netw. 2019; 17(12): 1529-1554.
- Laguna M, et al: Testicular Cancer 2020. https://uroweb.org/guideline/testicular-cancer/ (ultimo accesso 18.11.2020).
- Honecker F, et al: Conferenza di consenso ESMO sul tumore a cellule germinali del testicolo: diagnosi, trattamento e follow-up. Ann Oncol. 2018; 29(8): 1658-1686.
InFo ONCOLOGIA & EMATOLOGIA 2020; 8(6): 38-39 (pubblicato il 9.12.20, prima della stampa).