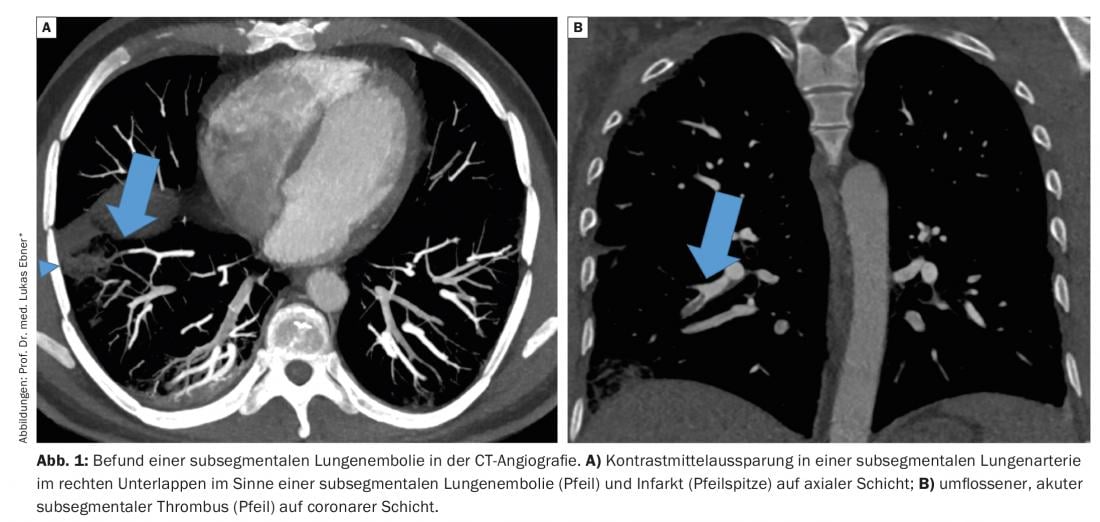
Le embolie polmonari (LE) sono raggruppate insieme alle trombosi venose profonde come tromboembolie venose. Mentre 50 anni fa, a causa delle limitate possibilità diagnostiche, la diagnosi veniva solitamente fatta solo post-mortem o con chiari riscontri clinici come dispnea, dolore toracico o shock ostruttivo, lo spettro patologico della LE è cambiato negli ultimi decenni.
Le embolie polmonari (LE) sono raggruppate insieme alle trombosi venose profonde come tromboembolie venose. Mentre 50 anni fa, a causa delle limitate possibilità diagnostiche, la diagnosi veniva solitamente fatta solo post-mortem o con chiari riscontri clinici come dispnea, dolore toracico o shock ostruttivo, lo spettro patologico della LE è cambiato negli ultimi decenni. Grazie alla rapida disponibilità di test diagnostici sensibili, è possibile diagnosticare anche la LE oligosintomatica con disturbi aspecifici o reperti incidentali asintomatici, e si possono visualizzare non solo gli emboli nelle parti centrali della vascolarizzazione polmonare, ma anche le cavità con mezzo di contrasto nelle piccole arterie polmonari subsegmentali – la cosiddetta LE subsegmentale. (Fig. 1). L’importanza clinica della LE subsegmentale è stata messa sempre più in discussione negli ultimi anni e, di conseguenza, il paradigma comune secondo cui tutte le LE richiedono una terapia anticoagulante è stato messo in discussione. Di seguito, discutiamo la rilevanza clinica della LE subsegmentale e riassumiamo le prove attuali sulla terapia.
Sovradiagnosi di embolie polmonari clinicamente irrilevanti?
L’introduzione dell’angiografia TC multidetettore (CTA) alla fine degli anni ’90 ha rivoluzionato la diagnosi di LE e ha gradualmente soppiantato altre procedure diagnostiche. La maggiore risoluzione della CTA multidetettore rispetto alla scintigrafia di ventilazione/perfusione o alla CTA a singolo rivelatore consente una migliore visualizzazione dei piccoli vasi polmonari, come le arterie polmonari subsegmentali, che aumenta la sensibilità per la diagnosi di LE. Con la crescente disponibilità di apparecchiature TC e la proliferazione di esami CTA multidetettore, si è verificato un aumento rilevante delle diagnosi di LE: negli Stati Uniti, l’incidenza di LE è aumentata dell’80% negli 8 anni successivi all’introduzione della CTA multidetettore. Al contrario, la mortalità è diminuita leggermente del 3% nello stesso periodo, senza alcun cambiamento nella prevalenza dei fattori di rischio o alcun miglioramento rilevante nel trattamento della LE. Allo stesso tempo, però, si è registrato anche un aumento del 70% delle complicanze associate all’anticoagulazione, come emorragie gastrointestinali e intracraniche o trombocitopenie secondarie. La mortalità ampiamente stabile con un aumento rilevante delle diagnosi di LE è indicativa di una sovradiagnosi di LE clinicamente irrilevante. Una spiegazione di ciò è l’aumento della diagnosi di piccoli emboli, come la LE subsegmentale, grazie ai metodi diagnostici più sensibili. Una revisione sistematica ha mostrato che la percentuale di LE subsegmentale con la CTA multidetettore è raddoppiata rispetto alla più vecchia CTA a singolo detettore (9,4% rispetto al 4,7%). Mentre con i CTA multidetettore a 4 linee i subsegmentali rappresentavano il 7,1% di tutti i LE, con i CTA multidetettore a 64 linee erano già il 15%. Questi risultati supportano l’ipotesi che i progressi tecnologici nelle tecniche di imaging siano responsabili dell’aumento del numero di LE subsegmentali diagnosticate e abbiano contribuito all’aumento osservato dell’incidenza della LE. È probabile che la LE subsegmentale diventi ancora più frequente con il miglioramento della risoluzione dei nuovi scanner TC.
Sfide nella diagnosi di embolia polmonare subsegmentale
La diagnosi corretta di LE subsegmentale è difficile e la distinzione tra vera LE subsegmentale e artefatto non è sempre chiara. Questo è stato illustrato da uno studio che ha analizzato l’accordo tra i radiologi nella diagnosi di LE a seconda della sua localizzazione. In contrasto con l’elevata concordanza tra i radiologi nella diagnosi di LE prossimale (kappa=0,83), era scarsa per la LE subsegmentale (kappa=0,23). In un altro studio, le LE subsegmentali diagnosticate con la CTA sono state confrontate con uno standard di riferimento di più modalità di esame: il valore predittivo positivo della CTA per la diagnosi di embolia nelle arterie polmonari subsegmentali era solo del 25%. Circa il 10-15% delle LE subsegmentali diagnosticate sono interpretate come falsi positivi alla seconda valutazione. Mentre uno studio pubblicato di recente ha mostrato un tasso di falsi positivi superiore al 50%, l’8% dei risultati CTA presumibilmente negativi erano LE subsegmentali mancate (risultati falsi negativi). Questi risultati sottolineano l’importanza di una buona qualità dell’immagine per una corretta interpretazione dei risultati della CTA, perché il contrasto non ottimale, gli artefatti respiratori, l’obesità o i tappi di muco possono influenzare negativamente la qualità dell’immagine e quindi portare a risultati errati e a una sovradiagnosi di LE subsegmentale. Una diagnosi di LE falso-positiva non solo comporta una terapia anticoagulante non necessaria, spesso a vita, con i noti effetti collaterali, ma può avere anche altri effetti negativi, come lo stress emotivo o esami di follow-up non necessari.
Ci sono prove che la sensibilità dei D-dimeri è più bassa nella LE subsegmentale rispetto a quella più prossimale. In uno studio diagnostico, tra i pazienti con bassa probabilità clinica di pretest e D-dimeri <1000 µg/l che sono stati confermati come affetti da LE, 10 su 11 avevano una localizzazione subsegmentale. Utilizzando l’algoritmo YEARS per la diagnosi di LE, dove un D-dimero più alto di 1000 µg/l è la soglia per l’esecuzione della CTA con una bassa probabilità clinica pre-test basata su 3 variabili, vengono diagnosticate meno LE subsegmentali rispetto a un algoritmo basato sul consueto cut-off del D-dimero di 500 µg/l. L’uso di soglie di D-dimero aggiustate per l’età porta anche a una riduzione della diagnosi di LE subsegmentale.
La circolazione polmonare come filtro fisiologico?
Alcuni esperti hanno ipotizzato che la circolazione polmonare, come filtro fisiologico, abbia il compito di evitare che i piccoli coaguli entrino nella circolazione arteriosa. Secondo questa ipotesi, piccole LE come quelle delle arterie polmonari subsegmentali potrebbero verificarsi anche negli individui sani come risultato di questa funzione di filtraggio fisiologico. In uno studio su volontari sani, il 16% presentava difetti di perfusione alla scintigrafia polmonare. Osservazioni angiografiche più datate sul decorso naturale della LE mostrano che anche gli emboli più grandi possono essere riassorbiti spontaneamente dai processi fibrinolitici endogeni entro poche settimane.
Terapia anticoagulante: benefici e rischi
In base alle prove di sovradiagnosi della LE, al rischio di falsi positivi e all’incerta rilevanza clinica della LE subsegmentale, non è chiaro se tutte le LE – comprese quelle subsegmentali – richiedano una terapia. Il trattamento standard abituale per il tromboembolismo venoso è l’anticoagulazione per almeno 3 mesi. Sebbene questa terapia sia molto efficace nel ridurre il rischio di recidiva tromboembolica dell’80-90%, aumenta anche il rischio di sanguinamento. Il rischio annuale di emorragia maggiore è compreso tra l’1 e il 5%, a seconda delle caratteristiche del paziente. L’emorragia grave è associata a una mortalità di circa l’11%, e in particolare l’emorragia intracranica, che rappresenta circa il 10% delle emorragie gravi, comporta una morbilità rilevante con disabilità potenzialmente per tutta la vita. Le emorragie minori si verificano in quasi la metà dei pazienti in terapia anticoagulante e non sono solo causa di stress e riduzione della qualità di vita, ma anche un onere per il sistema sanitario a causa dell’aumento delle visite, degli interventi medici e dei costi aggiuntivi.
A causa degli effetti delle complicazioni emorragiche, i benefici e i rischi della terapia anticoagulante devono sempre essere attentamente soppesati, il che è particolarmente vero per i tromboembolismi di scarsa rilevanza clinica. Utilizzando l’esempio della trombosi venosa profonda distale isolata, si può dimostrare che non tutti i pazienti con tromboembolismo venoso di piccole dimensioni richiedono una terapia anticoagulante. Nel >90% delle trombosi isolate della vena distale della gamba, senza trattamento, non si verifica né l’estensione nei segmenti venosi più prossimali, nel senso di trombosi della vena prossimale della gamba, né altre complicazioni. In uno studio randomizzato controllato con placebo su pazienti a basso rischio con trombosi venosa distale isolata sintomatica della gamba, la terapia anticoagulante non è stata superiore al placebo per prevenire il tromboembolismo venoso, ma ha aumentato significativamente il rischio di sanguinamento.
Negli ultimi anni, il rapporto rischio-beneficio della terapia anticoagulante è stato messo sempre più in discussione nei pazienti con LE subsegmentale, in quanto piccoli studi osservazionali hanno descritto decorsi non complicati nei pazienti con LE subsegmentale anche senza anticoagulazione.
Decorso clinico nella LE subsegmentale con e senza anticoagulazione
Se la prognosi sia diversa per la LE subsegmentale o più prossimale è controverso in letteratura. I dati degli studi prospettici hanno mostrato un rischio simile di recidiva tromboembolica, mortalità ed emorragia nei pazienti anticoagulati non selezionati, indipendentemente dalla posizione anatomica della LE. Sebbene questi studi non suggeriscano differenze nell’esito clinico dei pazienti trattati con LE subsegmentale o più prossimale, non rispondono alla domanda se la prognosi sia diversa nella LE subsegmentale con o senza terapia anticoagulante. Inoltre, questi studi non hanno cercato sistematicamente la trombosi venosa profonda; poiché la trombosi venosa profonda non diagnosticata può aumentare il rischio di recidiva tromboembolica, non forniscono dati prognostici solidi per la LE subsegmentale isolata (senza trombosi concomitante della vena della gamba).
In molti casi, le LE subsegmentali vengono ignorate da alcune procedure diagnostiche senza alcun effetto negativo (non trattate!). In uno studio randomizzato, i pazienti con sospetta LE sono stati valutati con CTA multidetettore, CTA monodetettore o scintigrafia di ventilazione/perfusione. Sebbene sia stato diagnosticato e quindi trattato un maggior numero di LE con la CTA multidetettore rispetto alle altre due modalità, non c’è stata alcuna differenza nel rischio di recidiva di tromboembolismo dopo 3 mesi nei pazienti non trattati dei 3 gruppi. Le LE aggiuntive diagnosticate dalla CTA multidetettore erano quindi clinicamente insignificanti. Questa osservazione fornisce una prova indiretta che non tutte le piccole LE subsegmentali sono clinicamente rilevanti e richiedono una terapia anticoagulante. La Società Americana di Ematologia, ad esempio, nelle sue linee guida pubblicate nel 2018, preferisce eseguire la scintigrafia planare di ventilazione/perfusione rispetto alla CTA per la diagnosi di LE in determinate situazioni, poiché quest’ultima non solo è associata a una maggiore esposizione alle radiazioni, ma porta anche a un maggior numero di diagnosi di LE subsegmentale con un significato clinico poco chiaro.
Diversi piccoli studi osservazionali, per lo più retrospettivi, hanno confrontato il decorso clinico con e senza anticoagulazione nei pazienti con LE subsegmentale. Recentemente, 14 di questi studi sono stati riassunti in una revisione sistematica e meta-analisi. In 715 pazienti con LE subsegmentale, non c’è stata alcuna differenza significativa nella recidiva tromboembolica o nella mortalità con o senza anticoagulazione (Tabella 1) . Questi risultati suggeriscono che i pazienti con LE subsegmentale hanno una prognosi simile a quelli con terapia, anche senza terapia anticoagulante. Tuttavia, gli studi inclusi presentano limitazioni metodologiche rilevanti (dimensioni ridotte del campione, disegno dello studio per lo più retrospettivo), le popolazioni degli studi inclusi erano molto eterogenee e i criteri per la decisione del trattamento erano per lo più sconosciuti, motivo per cui i gruppi di pazienti con e senza anticoagulazione sono difficilmente comparabili. Attualmente non ci sono dati provenienti da studi randomizzati sulla sicurezza di una strategia terapeutica senza anticoagulazione.
Il rischio di sanguinamento associato all’anticoagulazione merita un’attenzione particolare, data la dubbia rilevanza della LE subsegmentale. Il rischio di emorragia rilevante è molto variabile nei pazienti anticoagulati con LE subsegmentale ed è riportato tra l’1,7% e il 34% a seconda delle caratteristiche del paziente e della definizione di emorragia.

Gestione dei pazienti con embolia polmonare subsegmentale: cosa dicono le linee guida?
Sulla base delle prove limitate attualmente disponibili, negli ultimi anni diverse società professionali e gruppi di esperti hanno pubblicato raccomandazioni per il trattamento dei pazienti con LE subsegmentale. Le linee guida dell’American College of Chest Physicians (ACCP) suggeriscono un follow-up clinico senza terapia anticoagulante in pazienti selezionati a basso rischio con LE subsegmentale, se si esclude una trombosi venosa profonda coesistente (raccomandazione debole con evidenza profonda). Se l’ecografia compressiva viene utilizzata per valutare solo le vene prossimali della gamba per la presenza di una trombosi venosa profonda, sono necessarie una o più ecografie di decorso per escludere la trombosi diffusa prossimalmente. Nei pazienti ad alto rischio (definiti come quelli senza fattori di rischio reversibili, pazienti immobili o ospedalizzati, o quelli con cancro attivo o riserve cardiopolmonari insufficienti), la terapia anticoagulante deve essere preferita. Si consiglia di includere il rischio di emorragia nella decisione di trattamento. Allo stesso modo, l’American College of Emergency Physicians raccomanda una strategia di trattamento personalizzata basata sul profilo di rischio del paziente. La Società Europea di Cardiologia (ESC) raccomanda che la diagnosi di LE subsegmentale sia confermata da un radiologo esperto del torace. Nei pazienti ambulatoriali senza cancro e senza trombosi venosa concomitante della gamba, si raccomanda una strategia di monitoraggio clinico senza anticoagulazione se è presente una sola LE subsegmentale, mentre in tutti gli altri (compresi i pazienti con più LE subsegmentali) si suggerisce l’anticoagulazione. Non ci sono prove per queste diverse raccomandazioni di trattamento a seconda del numero di LE subsegmentali, e questa distinzione non viene fatta in altre linee guida e raccomandazioni di esperti.
Nonostante queste raccomandazioni delle linee guida, la maggior parte dei pazienti con LE subsegmentale isolata viene oggi anticoagulata e la durata della terapia non differisce dai pazienti con LE localizzata prossimale. Una possibile ragione di ciò è l’evidenza limitata per una strategia di trattamento senza anticoagulazione – ad oggi, mancano i dati di studi prospettici o randomizzati sufficientemente ampi e di alta qualità.
Prospettiva
Uno studio prospettico internazionale in corso sta studiando una strategia di trattamento senza anticoagulazione nei pazienti a basso rischio con LE subsegmentale che hanno avuto una trombosi venosa profonda prossimale esclusa dall’ecografia compressiva seriale (ClinicalTrials.gov NCT01455818). In Svizzera, è stato recentemente avviato lo studio SAFE-SSPE, uno studio randomizzato di non inferiorità in cui i pazienti a basso rischio con LE subsegmentale isolata (cioè senza trombosi venosa profonda) sono randomizzati alla terapia anticoagulante o al placebo – (ClinicalTrials.gov NCT04263038). I due gruppi di trattamento saranno monitorati clinicamente per 90 giorni e confrontati in termini di rischio di recidiva tromboembolica, emorragia, mortalità, qualità della vita ed endpoint economici. Lo studio fornirà informazioni sulla possibilità di evitare un trattamento inutile con anticoagulanti in pazienti selezionati con LE, riducendo così il rischio di emorragia. Se una strategia di trattamento senza anticoagulazione si dimostrerà sicura, lo studio potrebbe dare il via a un allontanamento dall’attuale paradigma della terapia anticoagulante per tutte le LE.
Finché non saranno disponibili risultati di studi solidi sulla terapia ottimale per i pazienti con LE subsegmentale, è importante evitare la sovradiagnosi e il sovratrattamento. Le indagini CTA non necessarie possono essere evitate utilizzando algoritmi diagnostici validati con determinazione della probabilità clinica pre-test e test D-dimero. Per i test D-dimero ad alta sensibilità, i cut-off aggiustati per età, che hanno dimostrato di essere sicuri negli studi randomizzati, possono contribuire ulteriormente alla riduzione delle TAC, che a sua volta porta a una riduzione della prevalenza di LE subsegmentale. Lo stesso vale per l’algoritmo YEARS citato in precedenza, che è più facile da usare e può quindi anche migliorare l’aderenza alla procedura diagnostica corretta quando si sospetta la LE. Un altro modo per ridurre la sovradiagnosi è quello di utilizzare l’algoritmo PERC, basato su 8 criteri clinici, nei pazienti con un basso sospetto clinico di LE. Se nessuno degli 8 criteri è positivo, si possono omettere ulteriori diagnosi in questa popolazione a basso rischio senza perdere LE rilevanti, come ha dimostrato uno studio randomizzato pubblicato di recente. A causa delle difficoltà nella diagnosi della LE subsegmentale spiegate sopra, la diagnosi dovrebbe essere confermata da un secondo radiologo esperto prima di prendere una decisione di trattamento – non tutti i sospetti di LE subsegmentale sono autentici! La difficoltà diagnostica della LE subsegmentale è stata recentemente affrontata con la pubblicazione di criteri radiologici che dovrebbero essere presi in considerazione quando si effettua una diagnosi con la CTA. Secondo l’American Society of Hemtology, la scintigrafia planare di ventilazione/perfusione dovrebbe essere preferita alla CTA come modalità diagnostica di scelta nei pazienti con bassa o moderata probabilità di pretest e alta probabilità di un risultato conclusivo, tra le altre ragioni, per ridurre il rischio di diagnosi di LE subsegmentale. Se la LE subsegmentale è confermata, si può valutare una strategia terapeutica senza anticoagulazione in pazienti selezionati con un rischio di recidiva e di complicanze profonde dopo l’esclusione della trombosi venosa profonda, soprattutto tenendo conto delle preferenze del paziente e del rischio di sanguinamento. (Fig. 2). Ciò richiede l’ecografia compressiva delle vene della gamba su entrambi i lati, anche se non si conosce la strategia ottimale (ecografia compressiva singola di tutte le vene prossimali e distali della gamba rispetto all’ecografia compressiva seriale delle sole vene prossimali della gamba).
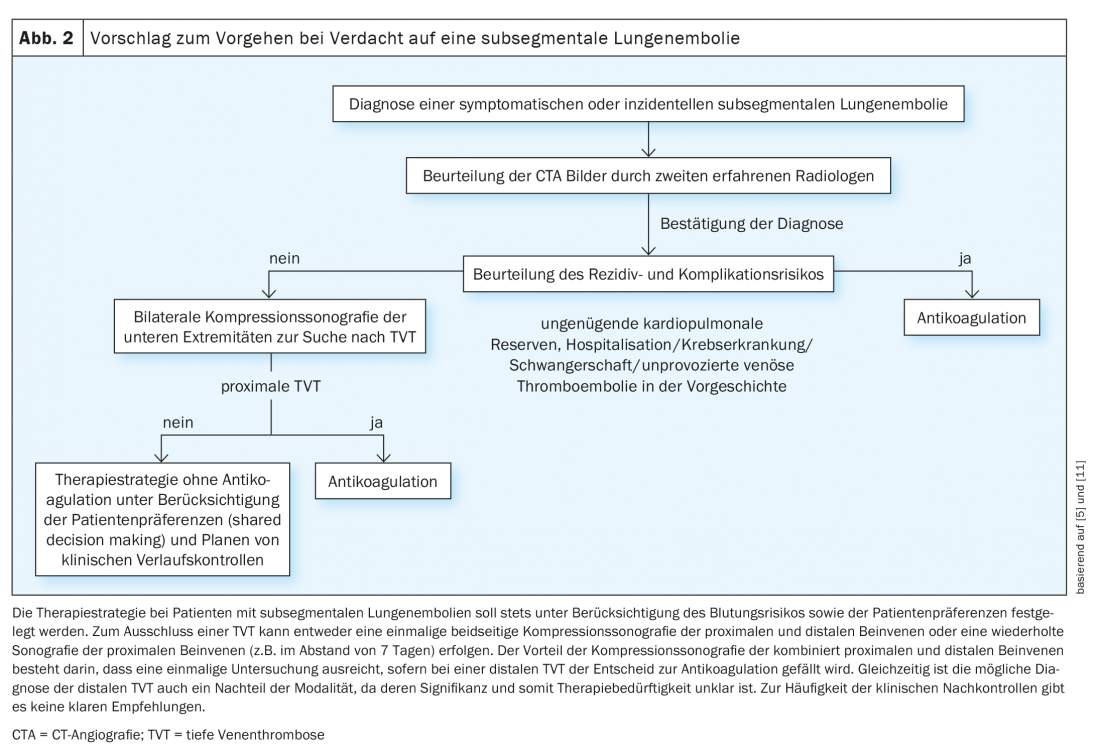
In sintesi, l’importanza clinica della LE subsegmentale è poco chiara e controversa, a causa della scarsa base di prove sulla terapia ottimale. Dato l’incerto beneficio della terapia anticoagulante nei pazienti con LE subsegmentale e basso rischio di recidiva e complicazioni, i risultati di studi prospettici e randomizzati di alta qualità saranno particolarmente importanti per evitare complicazioni emorragiche potenzialmente inutili associate all’anticoagulazione e per contribuire a migliorare la qualità dell’assistenza.
Messaggi da portare a casa
- Con l’aumento degli esami TC e i progressi tecnici, l’incidenza delle embolie polmonari subsegmentali (LE) è aumentata nel corso degli anni; attualmente rappresentano circa il 15% di tutte le LE.
- L’importanza clinica della LE subsegmentale isolata non è chiara.
- La strategia di trattamento ottimale per la LE subsegmentale isolata (senza trombosi venosa profonda concomitante) è controversa a causa delle prove insufficienti.
- Le attuali linee guida suggeriscono una strategia di trattamento senza anticoagulazione nei pazienti con LE subsegmentale, a condizione che sia esclusa una trombosi venosa profonda concomitante e che vi sia un rischio profondo di recidiva e di complicanze.
Letteratura:
- Wiener RS, Schwartz LM, Woloshin S: Quando un test è troppo buono: come gli angiogrammi polmonari TC trovano emboli polmonari che non devono essere trovati. BMJ 2013; 347: f3368.
- Wiener RS, Schwartz LM, Woloshin S: Tendenze temporali dell’embolia polmonare negli Stati Uniti: prove di sovradiagnosi. Archivi di Medicina Interna 2011; 171(9): 831-837.
- Carrier M, Righini M, Wells PS, et al: Embolia polmonare subsegmentale diagnosticata mediante tomografia computerizzata: incidenza e implicazioni cliniche. Una revisione sistematica e una meta-analisi degli studi sui risultati della gestione. Journal of Thrombosis and Haemostasis: JTH 2010; 8(8): 1716-1722.
- van der Pol LM, Bistervels IM, van Mens TE, et al: Minore prevalenza di embolia polmonare subsegmentale dopo l’applicazione dell’algoritmo diagnostico YEARS. British Journal of Haematology 2018; 183(4): 629-635.
- Kearon C, Akl EA, Ornelas J, et al: Terapia antitrombotica per la malattia da TEV: Linea guida CHEST e rapporto del gruppo di esperti. Chest 2016; 149(2): 315-352.
- Carrier M, Righini M, Le Gal G: Embolia polmonare subsegmentale sintomatica: qual è il passo successivo? Journal of Thrombosis and Haemostasis: JTH 2012; 10(8): 1486-1490.
- Stoller N, Limacher A, Mean M, et al: Presentazione clinica ed esiti nei pazienti anziani con embolia polmonare isolata sintomatica subsegmentale. Ricerca sulla trombosi 2019; 184: 24-30.
- Lim W, Le Gal G, Bates SM, et al: Linee guida 2018 della Società Americana di Ematologia per la gestione del tromboembolismo venoso: diagnosi di tromboembolismo venoso. Blood Advances 2018; 2(22): 3226-3256.
- Bariteau A, Stewart LK, Emmett TW, Kline JA: Revisione sistematica e meta-analisi degli esiti dei pazienti con embolia polmonare subsegmentale con e senza trattamento anticoagulante. Acad Emerg Med 2018.
- Baumgartner C, Klok FA, Carrier M, et al: Sorveglianza clinica vs. Anticoagulazione per i pazienti a basso rischio con embolia polmonare isolata sub-segmentale: protocollo per uno studio multicentrico randomizzato controllato con placebo di non inferiorità (SAFE-SSPE). BMJ Open 2020; 10(11): e040151.
- Swan D, Hitchen S, Klok FA, Thachil J: Il problema della sottodiagnosi e della sovradiagnosi dell’embolia polmonare. Ricerca sulla trombosi 2019; 177: 122-129.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2021; 3(1): 4-8