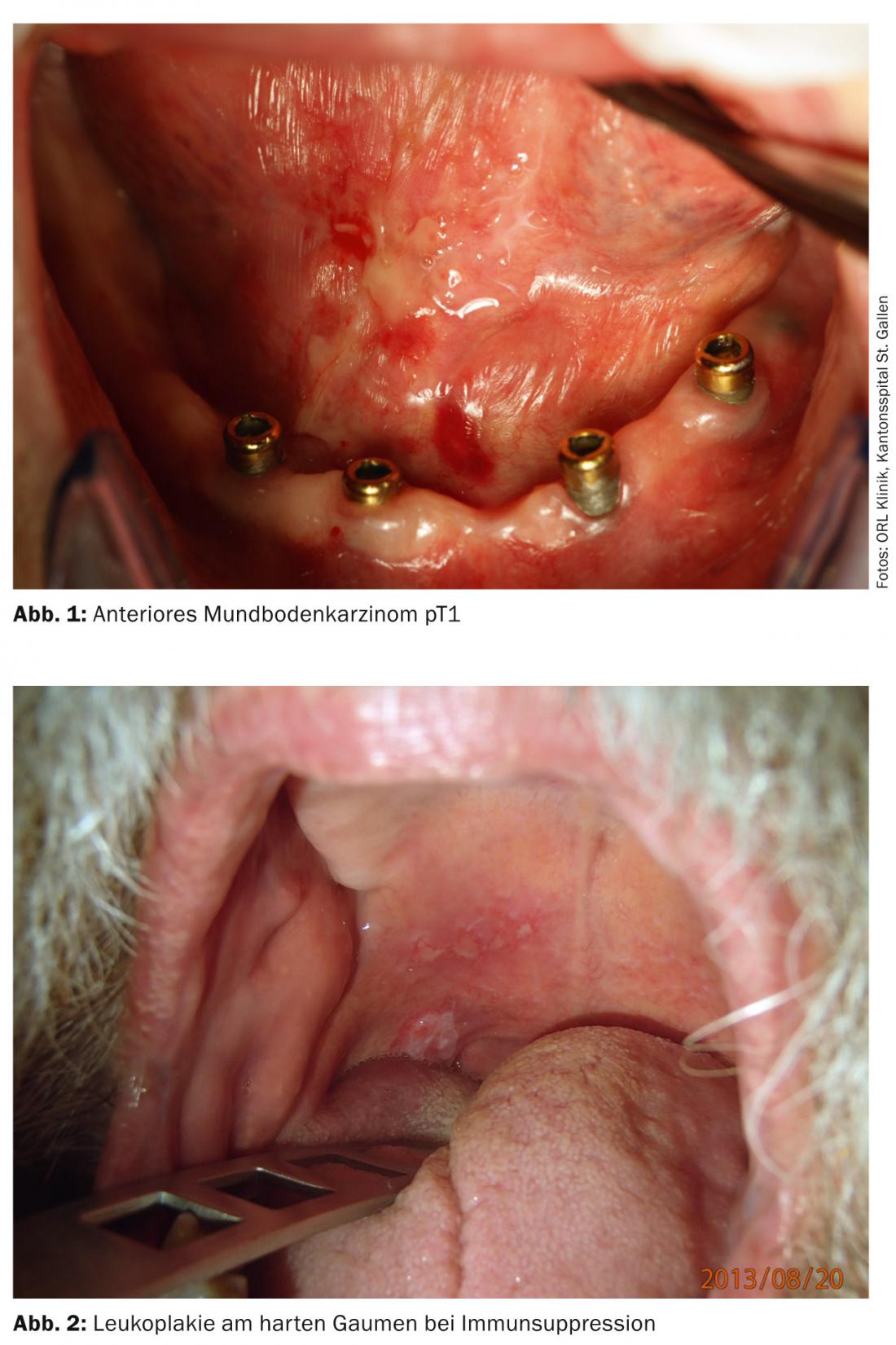
Importanti fattori di rischio per i carcinomi del cavo orale alle nostre latitudini sono il consumo di tabacco e alcol, l’infezione cronica da HPV ad alto rischio, l’immunosoppressione e precedenti tumori nella regione della testa e del collo. Spesso i carcinomi vengono rilevati solo in fase avanzata, motivo per cui il tasso di sopravvivenza complessiva dei pazienti con carcinoma del cavo orale è solo del 50%. Il trattamento consiste principalmente nella resezione chirurgica del tumore con o senza radio(chemio)terapia adiuvante. In tutti i pazienti con stadi T1/T2cN0, si raccomanda la biopsia del linfonodo sentinella per determinare la necessità di una dissezione del collo.
Circa il 5% di tutti i tumori maligni a livello mondiale sono carcinomi del cavo orale, il 95% dei quali sono carcinomi a cellule squamose [1]. L’età massima è di 60 anni. C’è una leggera predisposizione al sesso maschile.
Fattori di rischio: fumo, alcol e infezione da HPV ad alto rischio.
I principali fattori di rischio per lo sviluppo del carcinoma del cavo orale sono il consumo di tabacco (più di 1 pacchetto/d) e l’abuso di alcol (più di 100 g/d). In altri Paesi come l’India, dove si consumano le noci di betel e il tabacco da masticare, il carcinoma della cavità orale è addirittura uno dei tumori maligni più comuni. Un’altra causa è l’immunosoppressione, che ha acquisito importanza con l’aumento del numero di pazienti immunosoppressi, ad esempio dopo un trapianto di organi. Il tasso di incidenza negli individui dopo il trapianto è del 5% dopo 20 anni e dipende principalmente dal grado di reazione graft-versus-host [2].
Negli ultimi anni, c’è stato un aumento delle indicazioni nei pazienti più giovani, di età inferiore ai 45 anni, che può essere spiegato, analogamente al carcinoma orofaringeo, da una crescente prevalenza di carcinomi causati da tipi ad alto rischio del papilloma virus umano (HPV). Tuttavia, la percentuale di carcinomi associati all’HPV nella cavità orale, inferiore al 20%, è significativamente inferiore a quella dell’orofaringe, superiore al 50%.
Un altro importante fattore di rischio per lo sviluppo di un tumore maligno nel condotto aereo superiore è un precedente tumore maligno nella regione della testa e del collo. In una valutazione retrospettiva di quasi 100.000 pazienti, il rischio cumulativo di sviluppare un secondo tumore primario nel tratto aerodigestivo superiore dopo 20 anni era del 36% [3]. Il motivo potrebbe essere il “nuovo” approccio sviluppato da Slaughter et al. descritto per la prima volta nel 1953, che descrive che gli effetti cancerogeni del tabacco e dell’alcol agiscono simultaneamente su diverse aree del tratto aerodigestivo superiore e innescano lo sviluppo di diversi tumori primari indipendenti [4].
Lesioni precancerose
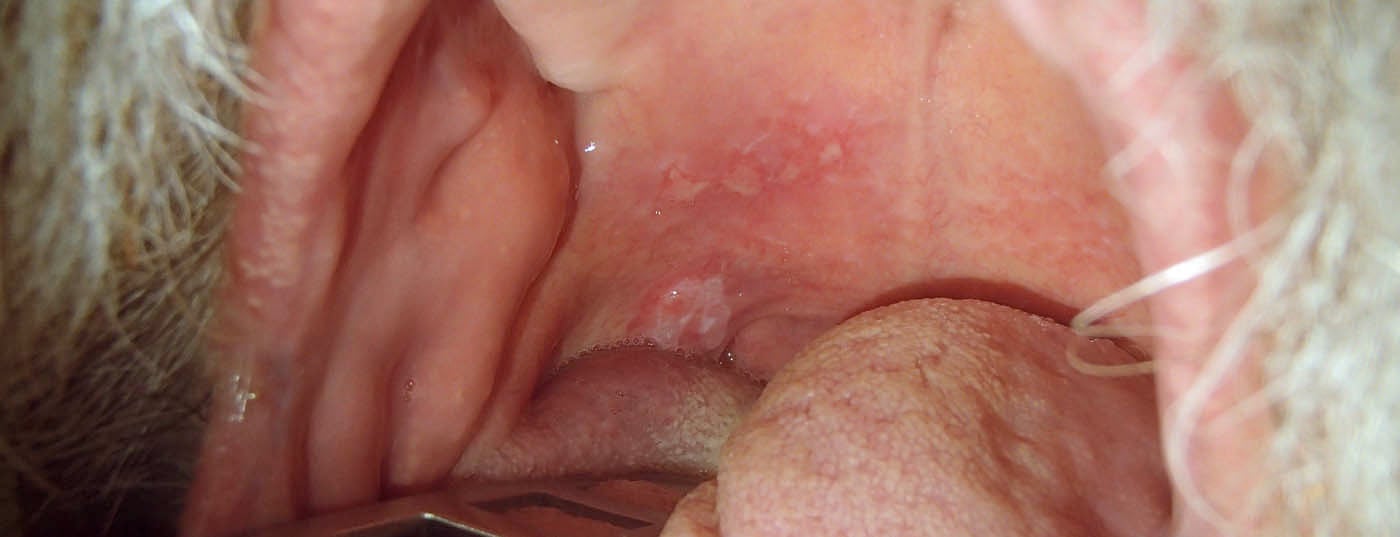
Alcuni carcinomi del cavo orale insorgono a causa di una lesione precursore o di condizioni pre-maligne. La leucoplachia, che si verifica con una prevalenza dello 0,2-5%, è considerata una condizione precancerosa facoltativa; le condizioni precancerose obbligatorie sono l’eritroplachia e la leucoplachia verrucosa. La leucoplachia può corrispondere istopatologicamente a una semplice iperplasia epiteliale o a un carcinoma invasivo [5]. Le lesioni sul pavimento della bocca e sul bordo della lingua mostrano più frequentemente aree displastiche rispetto alla mucosa buccale [6].
Poiché la distinzione tra un cambiamento benigno, premaligno o maligno è difficilmente possibile dal punto di vista clinico, si raccomanda la rimozione mediante biopsia. Le displasie lievi e moderate devono essere monitorate nel corso del loro decorso, poiché il 3-8% delle leucoplachie degenera in un periodo di cinque anni. Se istopatologicamente si tratta di una displasia di alto grado, la lesione viene rimossa con un margine di sicurezza di 0,5 cm. A causa del rischio di una falsa negatività, soprattutto con le alterazioni di grandi dimensioni, la mucosectomia è raccomandata come alternativa [5]. In caso di eritroplachia come lesione precancerosa obbligatoria, si raccomanda in ogni caso la resezione chirurgica.
Metodi per la diagnosi precoce
I tumori delle vie aeree e alimentari superiori spesso rimangono asintomatici per lungo tempo e vengono quindi scoperti tardivamente (Fig. 1 e 2). Pertanto, solo un terzo dei pazienti con carcinoma del cavo orale viene diagnosticato in fase iniziale senza metastasi regionali. Circa il 10% dei pazienti presenta già metastasi a distanza al momento della diagnosi [7].
Poiché il momento della diagnosi influisce direttamente sulla prognosi del paziente, la diagnosi precoce di una lesione premaligna o invasiva è di grande importanza. Per migliorare la diagnosi precoce, è stata diffusa la colorazione del tessuto con coloranti come il blu di toluidina; inoltre, sono stati sviluppati vari metodi tecnici come la diagnostica con autofluorescenza, la spettroscopia ottica, la tomografia a coerenza ottica o l’imaging a banda stretta (NBI). In una meta-analisi che ha esaminato l’uso del blu di toluidina nella regione della testa e del collo, la sensibilità per il rilevamento di un tumore invasivo è stata del 78-100% e la specificità del 30-100%. Per la displasia, il metodo era positivo solo in circa la metà dei casi [8]. La tecnica non si è affermata come metodo di screening a causa della sua bassa specificità [9,10], come è stato dimostrato anche da una recente meta-analisi. Questo confronta la colorazione con blu di toluidina, la citodiagnostica e la spettroscopia di riflettanza diffusa (DRS) con l’autofluorescenza indotta dal laser (LIAF) [11]. La massima accuratezza diagnostica è stata raggiunta dal DRS (97%) e dal LIAF (96%). Entrambe le tecniche sono risultate chiaramente superiori agli altri metodi, con la colorazione con blu di toluidina che ha dato i risultati peggiori (67%).
Volgger et al. ha studiato l’importanza della tomografia a coerenza ottica per la diagnosi del tumore nel tratto aerodigestivo superiore [5]. Gli autori concludono che la tomografia a coerenza ottica è uno strumento adatto per la diagnosi precoce dei tumori, grazie alla sua alta risoluzione e alla facilità d’uso, ma non può sostituire la biopsia. Studi precedenti sono giunti a una conclusione simile [12,13].
L’imaging a banda stretta (NBI) si concentra sull’aumento del contrasto dell’immagine delle strutture vascolari superficiali, rivelando le caratteristiche neoplasie vascolari nelle lesioni pre-maligne o invasive che possono essere utilizzate per la diagnosi precoce. Una recente revisione ha rilevato che l’accuratezza diagnostica dell’NBI è pari al 92-97% rispetto al 66-89% dell’endoscopia a luce bianca; pertanto, l’NBI ha potenzialmente una grande utilità nel rilevamento e nella valutazione delle lesioni premaligne e invasive [14]. In linea di principio, tuttavia, la chiarificazione istologica precoce dei cambiamenti nelle mucose orali rimane il metodo diagnostico di scelta.
Stabilizzazione
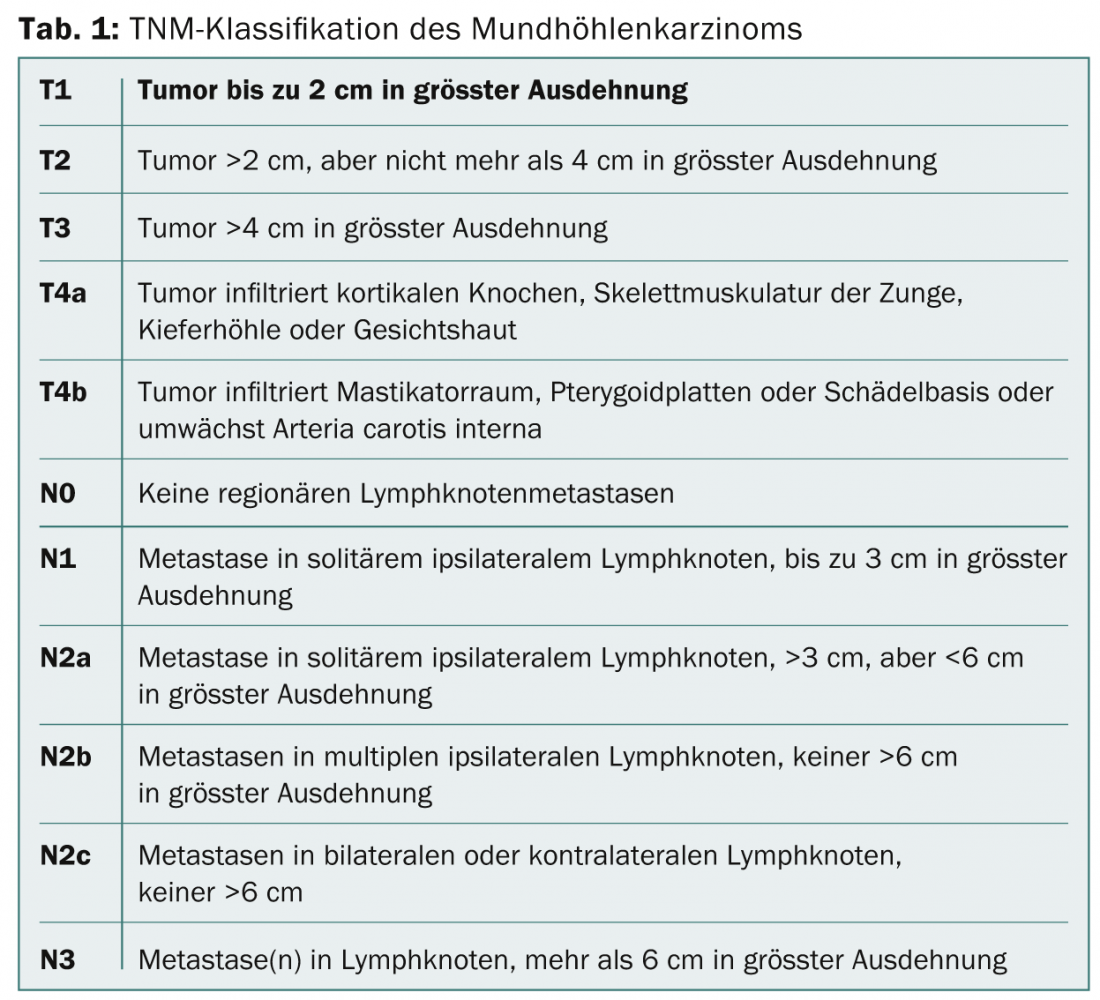
Nel caso del carcinoma della cavità orale, la decisione sul trattamento deve essere presa dopo la discussione in un comitato interdisciplinare, tenendo conto della posizione esatta del tumore, dello stadio del tumore secondo la classificazione TNM (Tab. 1), delle malattie secondarie e dei desideri del paziente. Se la biopsia ha confermato la diagnosi di carcinoma del cavo orale, è necessario eseguire un’ecografia dei tessuti molli del collo con aspirazione ad ago sottile dei linfonodi per la stadiazione. La chiarificazione radiologica del tumore primario viene effettuata preferibilmente mediante risonanza magnetica (RM), soprattutto perché la RM è in grado di mostrare meglio l’estensione dei tessuti molli e ha la stessa sensibilità, per quanto riguarda l’infiltrazione ossea nella mandibola o nella mascella, della tomografia computerizzata (TC) ad alta risoluzione [15]. Una panendoscopia superiore viene solitamente eseguita in anestesia, per una valutazione clinica dettagliata del tumore e per escludere secondi tumori sincroni, che possono essere rilevati in circa il 5% dei pazienti [16]. Negli stadi avanzati del tumore (cT3-4 o cN2-3), è stata stabilita la tomografia a emissione di positroni (PET) con fluorodeossiglusoe (FDG) per la stadiazione e l’esclusione di metastasi a distanza [17].
Opzioni terapeutiche
Per il trattamento degli stadi precoci del tumore (cT1-2 e cN0-1), di solito è sufficiente una “terapia monomodale”, solitamente sotto forma di sola chirurgia [15]. In alternativa, si può prendere in considerazione la radioterapia (radiazione percutanea o brachiterapia). I carcinomi avanzati del cavo orale (cT3-4, >cN1) vengono solitamente trattati in modo multimodale con resezione chirurgica e radioterapia adiuvante con o senza chemioterapia concomitante [15]. Sulla base del lavoro di Bernier e Cooper, l’indicazione per la chemioterapia adiuvante con cisplatino alla radioterapia adiuvante è data per la crescita tumorale extracapsulare (ECS), la linfangiosi carcinomatosa, la diffusione tumorale perineurale e i margini di resezione positivi [18–20]. Uno studio recente conferma che, soprattutto nei pazienti con ECS, la sopravvivenza a 2 e 5 anni può essere significativamente migliorata dalla chemioterapia [21].
La chirurgia primaria seguita dalla radioterapia adiuvante con o senza chemioterapia è il trattamento di scelta per il carcinoma avanzato nella maggior parte dei centri. Cohen et al. ma mostrano risultati funzionali e tassi di sopravvivenza comparabili nei pazienti irradiati primariamente con carcinomi T4 [22]. Al contrario, lo studio di Gore et al. un chiaro vantaggio di sopravvivenza dei pazienti trattati con la chirurgia primaria [23].
La radioterapia comporta il rischio di osteonecrosi come conseguenza a lungo termine, soprattutto della mandibola [24]. L’incidenza è del 2-22% [25]. Tuttavia, l’osteonecrosi si verifica raramente dopo l’irradiazione con una dose inferiore a 60 Gy. L’irradiazione iperfrazionata o moderatamente accelerata e l’uso della radioterapia a intensità modulata sembrano minimizzare il rischio [26,27]. La brachiterapia e la chemioterapia concomitante, invece, sono fattori di rischio per l’osteonecrosi [24,28,29].
Le sfide della ricostruzione
La sfida della chirurgia consiste nel resecare il tumore con un margine di sicurezza sufficiente e preservare la funzione. I deficit post-terapeutici nella deglutizione e nella funzione vocale sono comuni e influiscono significativamente sulla qualità della vita [30]. Secondo le indagini attuali, il 50-75% dei sopravvissuti a lungo termine è affetto da un certo grado di disturbi della deglutizione e/o dell’articolazione [31–33].
Poiché la localizzazione e l’estensione della resezione sono correlate alla disfunzione post-operatoria, la tecnica di ricostruzione scelta deve tenere conto sia dell’aspetto anatomico che della funzione [34]. A questo scopo sono state sviluppate diverse tecniche. Si va dalla chiusura primaria, alla guarigione per secundam, agli innesti cutanei divisi, ai lembi di spostamento e ai lembi pedicellati, fino ai lembi anastomizzati microvascolari liberi. La gestione dei difetti di resezione varia molto e dipende non da ultimo dall’esperienza del chirurgo. Secondo Shah et al. I difetti superficiali della mucosa e dei tessuti molli sottostanti possono essere chiusi adeguatamente con innesti di pelle divisa [35]. I nostri dati dimostrano che la ricostruzione del difetto è spesso inutile nelle fasi iniziali e che la guarigione per secundam produce buoni risultati funzionali [36].
Gestione dell’area di drenaggio linfatico
Il 20-30% dei pazienti con tumori in stadio precoce (T1/T2cN0) presenta metastasi occulte, motivo per cui la dissezione elettiva del collo è preferibile alla strategia “watch-and-wait” [37]. La portata della chirurgia del collo è cambiata nell’ultimo decennio, passando da procedure radicali a tecniche minimamente invasive. Come alternativa alla dissezione elettiva del collo, la biopsia del linfonodo sentinella (SNB) si è affermata in molti centri negli ultimi 15 anni per tutti i pazienti con T1/T2cN0. In un massimo del 38% dei pazienti, vengono rilevati linfonodi positivi e viene eseguita una dissezione completa del collo. Se c’è una crescita tumorale extracapsulare o sono colpiti più di due linfonodi, è indicata la radiochemioterapia adiuvante [38]. La SNB è associata a un rischio chirurgico ridotto e a una morbilità significativamente inferiore rispetto alla dissezione elettiva del collo [39,40]. Nei pazienti con metastasi linfonodali accertate citologicamente o probabili radiologicamente, esiste un’indicazione per la resezione simultanea del tumore primario e la dissezione terapeutica del collo.
Fattori prognostici
Il tasso di sopravvivenza globale dei pazienti con carcinoma del cavo orale è del 50%; questo tasso non è aumentato in modo significativo negli ultimi decenni, nonostante i progressi tecnici nella terapia e nella diagnostica per immagini [15]. Oltre allo stadio del tumore, diversi parametri istopatologici sono emersi come importanti fattori prognostici. Secondo uno dei nostri studi, tuttavia, non sono lo spessore del tumore e la profondità dell’infiltrazione, ma il grado di differenziazione del tumore e un modello di crescita dissoluta sul fronte del tumore che sembrano aumentare significativamente il rischio di metastasi linfogeniche e quindi influenzare la sopravvivenza [41].
La resezione con un margine di sicurezza sufficiente è di importanza prognostica cruciale, tuttavia la definizione di margini di resezione adeguati dà sempre adito a discussioni. Nel 1978, Looser et al. hanno riportato margini di resezione positivi. definita come una distanza dal tumore inferiore a 5 mm o cellule displastiche nel margine di resezione [42]. Questo concetto è ancora utilizzato. Richiede la resezione con un margine di resezione chirurgica di almeno 1 cm, a causa della contrazione del tumore in formalina, che non è sempre possibile a seconda delle dimensioni e della posizione del tumore.
I concetti futuri daranno probabilmente maggior peso all’importanza dei cambiamenti molecolari nei margini resecati [43]: I cambiamenti epigenetici nelle cellule tumorali, che sono decisivi per la tumorigenesi e vengono identificati sempre di più, devono essere determinati intraoperatoriamente con reazioni a catena della polimerasi quantitative (PCR) in una procedura rapida [44]. Questo permette di definire i margini di resezione necessari e questi fattori possono essere presi in considerazione anche per determinare l’indicazione alla terapia adiuvante. Supic et al. ha studiato l’ipermetilazione aberrante di diversi geni (p16, DAPK, E-cad e altri) e ha scoperto che nei margini di resezione istologicamente negativi, l’ipermetilazione del gene DAPK in particolare era associata a una peggiore sopravvivenza [45]. A nostro avviso, più questo principio verrà applicato, più si farà strada nella routine clinica.
Messaggi utili per il professionista
- Il 95% dei carcinomi della cavità orale sono carcinomi a cellule squamose.
- Spesso vengono riconosciuti solo in fase avanzata.
- I carcinomi della cavità orale vengono trattati principalmente per via chirurgica con o senza radio(chemio)terapia adiuvante.
- Per gli stadi T1/T2cN0, si raccomanda una biopsia del linfonodo sentinella.
- In futuro, la determinazione dei cambiamenti molecolari nei margini resecati diventerà più importante per una resezione chirurgica adeguata.
Martina A. Broglie Däppen, MD
Séverine M. Niederer-Wüst, MD
Prof. Dr. med. Sandro J. Stöckli
Letteratura:
- Thomas L, et al: Am J Otolaryngol 2012; 33(6): 650-656.
- Curtis RE, et al: Blood 2005; 105(10): 3802-3811.
- Chuang SC, et al: Int J Cancer 2008; 123(10): 2390-2396.
- Slaughter DP, et al: Cancer 1953; 6(5): 963-968.
- Volgger V, et al: Head Neck 2013; 35(11): 1558-1566.
- Neville BW, Day TA: CA Cancer J Clin 2002; 52(4): 195-215.
- Howlader N, et al: J Natl Cancer Inst 2009; 101(7): 533-36.
- Gray M, et al: Br Dent J 2000; 189(3): 125.
- Lingen MW, et al: Oral Onc 2008; 44(1): 10-22.
- Patton LL, et al: J Am Dent Assoc 2008; 139(7): 896-905.
- Fuller C, et al: Head Neck 2014 Mar 5. [Epub ahead of print]
- Wilder-Smith P, et al: Lasers Surg Med 2009; 41(5): 353-357.
- Hamdoon Z, et al: Photodiagnosis Photodyn Ther 2011; 8(1): 49-52.
- Vu AN, Farah CS: Oral Oncol 2014; 50(5): 413-420.
- Belcher R, et al: J Surg Oncol 2014; 110(5): 551-574.
- Haerle SK, et al: Head Neck 2010; 32(3): 319-325.
- Arias F, et al: Clin Transl Onc 2014 Jul 31. [Epub ahead of print]
- Bernier J, et al: N Engl J Med 2004; 350(19): 1945-1952.
- Bernier J, Cooper JS: Oncologist 2005; 10(3): 215-224.
- Cooper JS, et al: NEJM 2004; 350(19): 1937-1944.
- Zhang H, et al: J Otolaryngol Head Neck Surg 2013; 42: 30.
- Cohen EE, et al: Head Neck 2009; 31(8): 1013-1021.
- Gore SM, et al: Head Neck. 2014 Feb 15. [Epub ahead of print]
- Schwartz HC, et al: Am J Clin Onc 2002; 25(2): 168-171.
- Store G, et al: Clin Otolaryngol Allied Sci 2000; 25(5): 378-384.
- Lyons A, Ghazali N: Br J Oral Maxillofac Surg 2008; 46(8): 653-660.
- Studer G, et al: Strahlenther Onk 2006; 182(5): 283-288.
- Kuhnt T, et al: Med Oncol 2006; 23(3): 325-333.
- Hehr T, et al: Radiother Oncol 2006; 80(1): 33-38.
- Dwivedi RC, et al: Eur Arch Otorhinolaryngol 2012; 269(4): 1233-1239.
- Suarez-Cunqueiro MM, et al: Arch Otolaryngol Head Neck Surg 2008; 134(12): 1299-1304.
- Pauloski BR, et al: Head Neck 2006; 28(12): 1069-1076.
- Gillespie MB, et al: Arch Otolaryngol Head Neck Surg 2005; 131(7): 615-619.
- de Bree R, et al: Eur Arch Otorhinolaryngol 2008; 265(1): 1-9.
- Shah JP, Gil Z: Oral Oncol 2009; 45(4-5): 394-401.
- Romer, dati non ancora pubblicati.
- Stoeckli SJ, Broglie MA: Curr Opin Otolaryngol Head Neck Surg 2012; 20(2): 103-08.
- Broglie MA, et al: Head Neck 2013; 35(5): 660-666.
- Schiefke F, et al: Head Neck 2009; 31(4): 503-512.
- Murer K, et al: Head Neck 2011; 33(9): 1260-1264.
- Goerkem M, et al: Ann Surg Onc 2010; 17(2): 527-535.
- Looser KG, et al: Head Neck Surg 1978; 1(2): 107-111.
- Weinstock YE, et al: Oral Maxillofac Surg Clin North Am 2014; 26(2): 151-162.
- Goldenberg D, et al: Arch Otolaryngol Head Neck Surg 2004; 130(1): 39-44.
- Supic G, et al: Oral Oncol 2011; 47(8): 702-708.
InFo ONCOLOGIA & EMATOLOGIA 2014; 2(10): 6-10