La schizofrenia è una delle malattie mentali più gravi ed è anche relativamente comune. L’obiettivo terapeutico generale nel trattamento della schizofrenia dovrebbe essere quello di mantenere o ripristinare la funzionalità quotidiana e la qualità della vita. Il prerequisito per questo è un controllo sufficiente dei sintomi e una buona prevenzione delle ricadute.
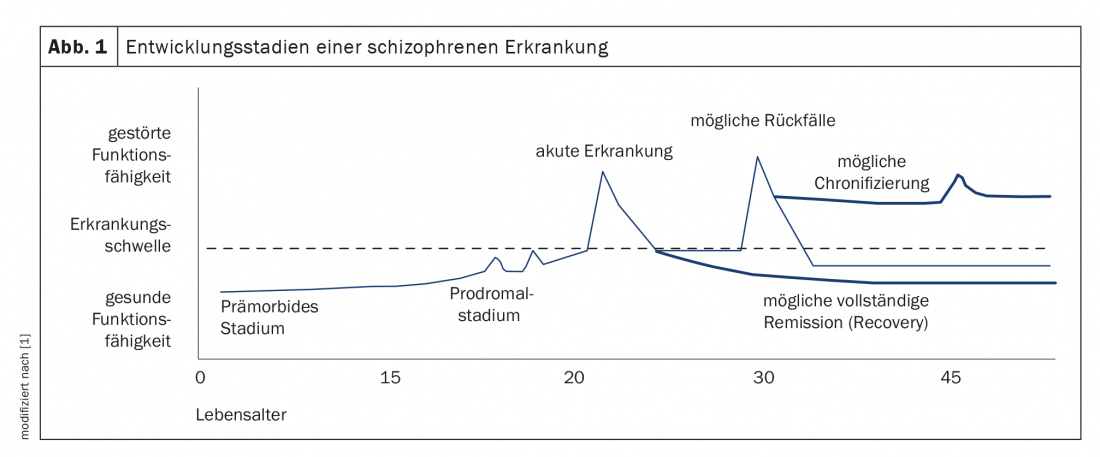
La schizofrenia è una delle malattie mentali più gravi ed è relativamente comune, con una prevalenza di circa l’1% della popolazione globale [1]. Si stima che circa 80.000 persone in Svizzera soffrano di schizofrenia [2]. Oltre ai disturbi legati ai sintomi, comporta una significativa compromissione della funzione professionale e psicosociale e quindi della qualità della vita. Secondo l’OMS, è uno dei 10 motivi principali di “anni di vita affetti da disabilità” [1]. In poco meno di un quarto dei pazienti, dopo un trattamento di successo, rimane un solo episodio psicotico nella loro vita e la loro salute mentale può essere completamente ripristinata. Di conseguenza, però, questo non è il caso per oltre il 75% delle persone colpite [1]. Dopo fasi di (quasi) completa remissione, si possono verificare ripetute ricadute – a volte con sintomi residui considerevoli con compromissioni cognitive e sociali (Fig. 1). Ciò rende l’attività lavorativa limitata o del tutto impossibile per circa il 70% dei pazienti [1]. Allo stesso tempo, le psicosi schizofreniche causano costi considerevoli per l’economia nazionale. In Germania, si stima che circa il 2-4% dei costi totali dei servizi sanitari sia speso per i pazienti schizofrenici. In Svizzera, è probabile che le cifre siano simili.
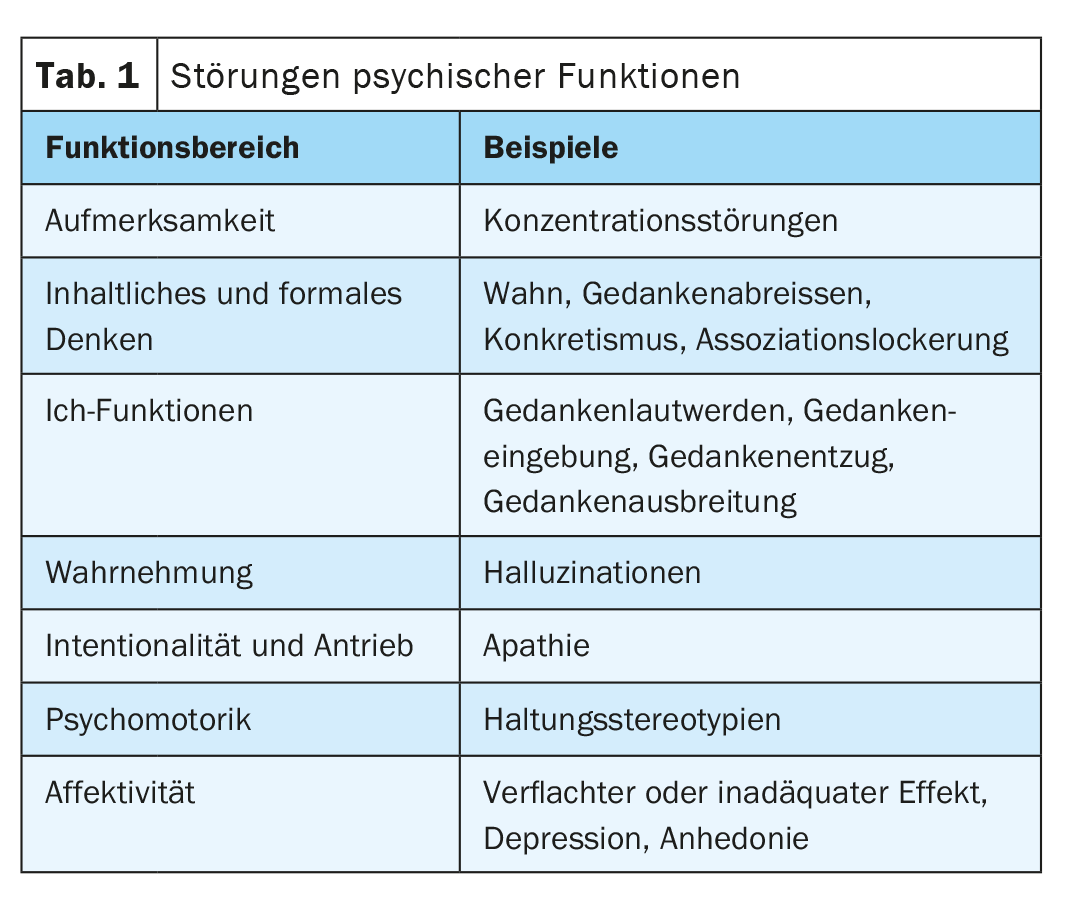
Lo sviluppo di antipsicotici con un profilo favorevole di efficacia/effetti collaterali è stato il primo prerequisito per una gestione efficace del trattamento. Questo dovrebbe essere adattato alla rispettiva fase della malattia, nonché alle rispettive esigenze e desideri delle persone colpite [3]. L’obiettivo principale della terapia è ora quello di mantenere la funzionalità quotidiana e la qualità della vita. Già nel 2011, una revisione riassumeva che i nuovi antipsicotici dovrebbero preferibilmente avere un profilo farmacodinamico “equilibrato” che risponda alla necessità di efficacia senza compromettere il benessere psichiatrico o fisico. Inoltre, devono avere un profilo farmacocinetico sicuro, rapido e favorevole, avere una finestra terapeutica definibile ed essere disponibili in diverse formulazioni [4]. Rispetto agli agenti precedentemente disponibili, dovrebbero idealmente mostrare almeno un’efficacia simile per i sintomi positivi, l’agitazione e l’aggressività, e un’efficacia migliore per i sintomi negativi o cognitivi, la prevenzione delle ricadute, le condizioni resistenti al trattamento e i problemi correlati come la depressione, l’ansia e l’abuso di sostanze. (Tab. 1). Una migliore tollerabilità e l’accettazione soggettiva da parte dei pazienti sono importanti anche per promuovere l’aderenza e la prosecuzione del trattamento.
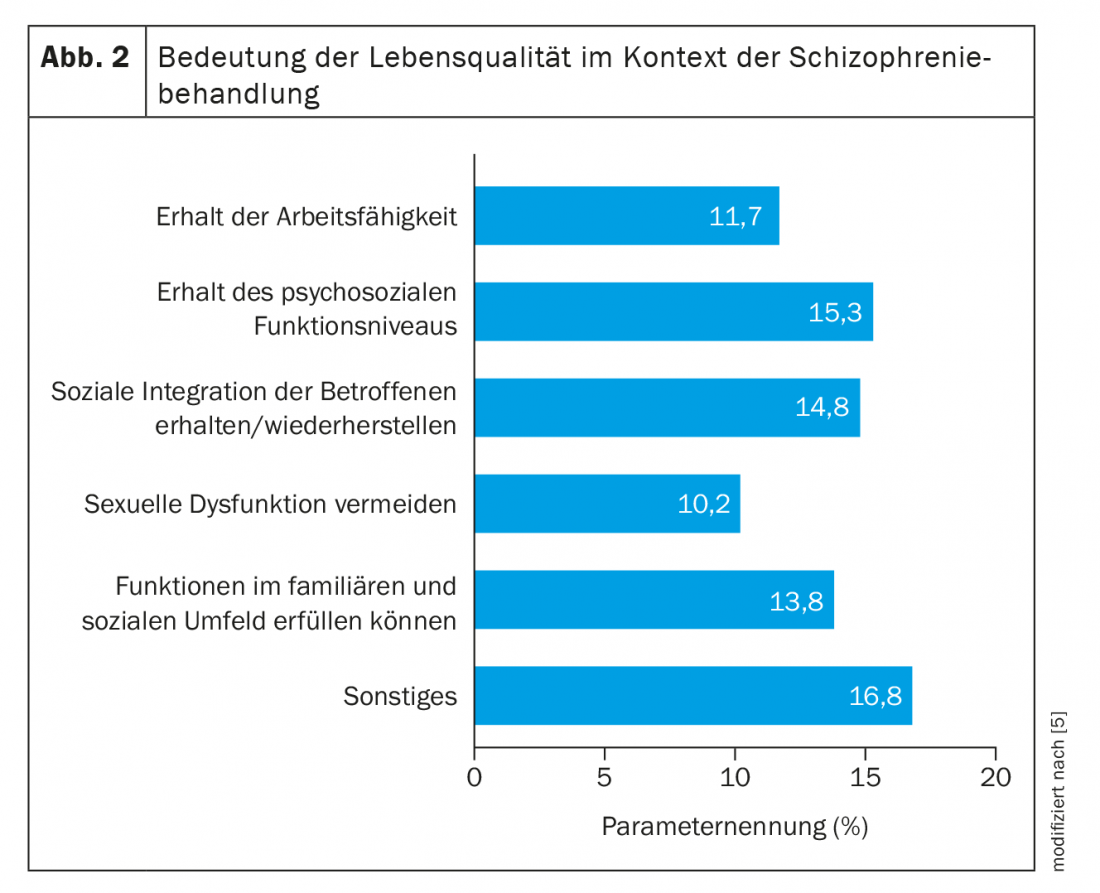
Parametri di esito riferiti dal paziente
Da allora, l’aspetto degli esiti correlati al paziente (PROs) si è spostato sempre più al centro delle considerazioni della pianificazione terapeutica centrata sul paziente e ottimizzata. Il mero controllo dei sintomi non è più sufficiente oggi. Perché questo non è sinonimo di salute, benessere e qualità della vita. Piuttosto, la qualità della vita deve essere presa maggiormente in considerazione per valutare il successo della terapia [5]. Tuttavia, questo richiede fondamentalmente un’aderenza adeguata per poter ottenere gli effetti corrispondenti. Il rapporto medico-paziente è importante in questo caso, con una buona comunicazione e un processo decisionale condiviso. I criteri obiettivo di un trattamento incentrato sul paziente includono i risultati funzionali, il recupero funzionale, il recupero soggettivo e la qualità della vita (Fig. 2) . L’esito funzionale è generalmente considerato come un livello di funzionamento (psico-)sociale. I deficit includono problemi nella gestione del ruolo sociale, nella partecipazione alla comunità, nell’affrontare la vita quotidiana, nell’occupazione e nella gestione della casa, nell’assunzione regolare di farmaci e nell’autocura di base [6]. Nel decorso a lungo termine, ai disturbi neurocognitivi in particolare viene attribuita una grande importanza. La guarigione, definita come remissione sintomatica e funzionale, nonché la migliore qualità di vita possibile, è oggi l’obiettivo terapeutico delle linee guida. Ciò richiede un miglioramento multidimensionale e la stabilizzazione della malattia. Finora, solo un paziente su sette riesce a guarire per almeno due anni [7,8].
Dal controllo dei sintomi alla profilassi delle ricadute
Cosa significa questo per la gestione dei trattamenti nello studio? Esiste un consenso internazionale sul fatto che il rischio di recidiva può essere ridotto in modo sostenibile solo con una combinazione di misure medicinali, psicoterapeutiche e psicosociali [5]. Per una profilassi efficace delle ricadute, è necessario trovare il livello ideale di protezione antipsicotica con il minor numero possibile di eventi avversi per ogni paziente. Ma trovare l’intervento farmacologico appropriato non è sempre facile. Questo perché non ci sono quasi differenze tra i singoli antipsicotici per quanto riguarda la loro efficacia sui sintomi positivi e negativi. Sempre a condizione che vengano assunti regolarmente. Una revisione sistematica ha esaminato 32 antipsicotici orali per il trattamento acuto degli adulti schizofrenici [9]. Sono stati identificati un totale di 54 417 studi e alla fine sono stati inclusi nell’analisi 402 studi con dati provenienti da 53 463 partecipanti. Le stime delle dimensioni dell’effetto individuale hanno indicato che tutti gli antipsicotici hanno ridotto i sintomi complessivi più del placebo (non significativo per sei farmaci), con dimensioni medie dell’effetto che vanno da -0,89 a -0,03 (mediana -0,42). Si può anche concludere che le differenze tra la maggior parte dei farmaci non sono significative. In termini di efficacia e sicurezza, molti antipsicotici più vecchi, che consentono pochi confronti diretti, hanno ottenuto buoni risultati rispetto alle preparazioni più recenti. Nel complesso, i ricercatori concludono che ci sono alcune differenze di efficacia tra gli antipsicotici, ma sono di natura più graduale. Le differenze negli effetti collaterali, invece, sono più evidenti.
Tuttavia, non viene nascosto il fatto che gli studi più vecchi potrebbero essere rimasti non pubblicati a causa di risultati negativi. Questo rende molto più difficile un confronto oggettivo. Limitazioni simili sono affrontate da un’altra meta-analisi per quanto riguarda la risposta al placebo [10]. Questo perché si è rivelato il singolo predittore più forte della dimensione dell’effetto nelle analisi precedenti. Ora è stato dimostrato che è attenuato da una serie di fattori legati al design e al paziente. Nelle analisi univariate, l’anno di pubblicazione più recente, le dimensioni maggiori dello studio, il maggior numero di siti di studio, l’uso della scala PANSS invece della scala BPRS per misurare la risposta, i periodi di wash-out più brevi, la durata dello studio più breve, l’età media più bassa e la durata della malattia più breve erano associati a una maggiore risposta al placebo. In un’analisi multivariabile, solo il numero di partecipanti allo studio e l’età media dei partecipanti hanno influenzato la risposta al placebo. In definitiva, dimostra che la valutazione dell’efficacia differenziale degli antipsicotici è molto difficile in assenza di studi testa a testa.
Criterio decisionale effetti collaterali
Tuttavia, lo spettro degli effetti collaterali è particolarmente importante per una buona aderenza. Questo perché nei pazienti schizofrenici, gli eventi avversi sono strettamente associati alla non aderenza ai farmaci. La prevenzione, l’individuazione e la gestione efficace degli effetti collaterali correlati ai farmaci sono quindi importanti per massimizzare l’aderenza al trattamento e ridurre l’uso delle risorse sanitarie nella schizofrenia. Gli effetti sedativi e l’aumento di peso sono stati ritenuti rilevanti per il paziente e rappresentano un motivo frequente di interruzione della terapia [11]. Anche se una certa sedazione in fase acuta può essere considerata utile dal team di trattamento. Tuttavia, questo dovrebbe essere ottenuto con l’aggiunta temporanea di sostanze sedative come le benzodiazepine. A lungo termine, l’uso di antipsicotici con effetto sedativo ostacola gli obiettivi terapeutici prioritari di funzionalità e qualità di vita.
Al fine di attuare una gestione ottimale del trattamento per il singolo paziente, è quindi estremamente importante conoscere le caratteristiche e, soprattutto, il profilo degli effetti collaterali delle opzioni farmacologiche disponibili [12–15]. Questi possono quindi essere adattati alle preferenze della persona interessata e si possono evitare eventi indesiderati. In questo modo, si rafforza non solo l’aderenza, ma anche l’alleanza terapeutica.
Dalla scoperta della clorpromazina nel 1952, gli antipsicotici di prima generazione (FGA) hanno rivoluzionato l’assistenza psichiatrica, facilitando le dimissioni dall’ospedale e consentendo a un gran numero di pazienti con gravi malattie mentali di essere trattati nella comunità. Gli antipsicotici di seconda generazione (SGA) hanno dato il via a un graduale spostamento dal trattamento paternalistico dei sintomi della SMI verso un approccio incentrato sul paziente, che si concentra sugli obiettivi importanti per i pazienti: funzionamento psicosociale, qualità di vita e recupero. Ci sono prove che gli SGA hanno un profilo di sicurezza e tollerabilità migliore rispetto agli FGA. L’incidenza degli effetti collaterali extrapiramidali correlati al trattamento è più bassa e la compromissione della funzione cognitiva e i sintomi negativi correlati al trattamento sono meno frequenti. Tuttavia, il trattamento con gli SGA è associato a una serie di effetti avversi, di cui l’aumento di peso e le anomalie metaboliche legate al trattamento sono particolarmente preoccupanti [12]. In questo caso, il passaggio ad antipsicotici con un basso rischio di aumento di peso può essere promettente. Anche l’integrazione con farmaci per la perdita di peso, come la metformina o il GLP1-RA, può rivelarsi una strategia efficace [15]. In termini di effetti collaterali metabolici, ci sono anche chiare differenze, con olanzapina e clozapina che presentano i profili peggiori e aripiprazolo, brexpiprazolo, cariprazina, lurasidone e ziprasidone che presentano i profili più favorevoli. L’aumento del peso al basale, il sesso maschile e l’etnia non bianca sono predittori di suscettibilità ai cambiamenti metabolici indotti dagli antipsicotici [14].
Conclusione
Le possibilità di mantenere o ripristinare la funzionalità quotidiana e la qualità di vita dei pazienti schizofrenici sono aumentate in modo significativo. Gli antipsicotici di seconda generazione indicano la strada e offrono la possibilità di una pianificazione terapeutica ottimizzata e centrata sul paziente.
Messaggi da portare a casa
- L’obiettivo terapeutico generale nel trattamento della schizofrenia dovrebbe essere quello di mantenere o ripristinare la funzionalità quotidiana e la qualità della vita.
- Il prerequisito per questo è un controllo sufficiente dei sintomi e una buona prevenzione delle ricadute.
- I singoli antipsicotici differiscono meno in termini di efficacia sui sintomi positivi e negativi, ma differiscono nei loro profili di effetti collaterali.
- Una gestione efficace del trattamento richiede una buona aderenza. Questo si basa su un processo decisionale condiviso e sulla prevenzione di eventi avversi rilevanti per il paziente.
- I principali effetti collaterali per l’interruzione della terapia sono l’effetto sedativo e l’aumento di peso.
- La conoscenza delle rispettive caratteristiche delle opzioni disponibili aiuta a rafforzare l’aderenza e quindi anche l’alleanza terapeutica.
Letteratura:
- www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsT/Schizophrenie.pdf?__blob=publicationFile (ultimo accesso 08.08.2021)
- www.gesundheit.bs.ch/gesundheitsfoerderung/psychische-gesundheit/krankheitsbilder/psychose/schizophrenie.html (ultimo accesso 08.08.2021)
- Linea guida S3 Schizofrenia; disponibile all’indirizzo: www.dgppn.de/_Resources/Persistent/88074695aeb16cfa00f4ac2d7174cd068d0658be/038-009l_S3_Schizophrenie_2019-03.pdf (ultimo accesso 08.08.2021).
- Correll CU: Cosa stiamo cercando nei nuovi antipsicotici? J Clin Psychiatry 2011; 72: 9-13.
- Wietfeld R, Pechler S, Janetzky W, Leopold K: Successo della terapia nella schizofrenia: è necessario un cambiamento di prospettiva? Un documento di discussione. Psicofarmacoterapia 2019; 26: 185-191.
- Harvey PD, Velligan DI, Bellack AS: Misure delle abilità funzionali basate sulle prestazioni: utilità negli studi clinici di trattamento. Schizophr Bull 2007; 33: 1138-1148.
- Jaaskelainen E, Juola P, Hirvonen N, et al: Una revisione sistematica e una meta-analisi del recupero nella schizofrenia. Schizophr Bull 2013; 39: 1296-1306.
- Kohl S, Kuhn J, Wiedemann K: Razionale e obiettivi della terapia farmacologica per la schizofrenia. Psicofarmacoterapia 2014; 21: 85-95.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al: Efficacia comparativa e tollerabilità di 32 antipsicotici orali per il trattamento acuto di adulti con schizofrenia multiepisodica: una revisione sistematica e una meta-analisi di rete. Lancet 2019; 394: 939-951.
- Leucht S, Chaimani A, Leucht C, et al: 60 anni di studi antipsicotici controllati con placebo nella schizofrenia acuta: meta-regressione dei predittori della risposta al placebo. Schizophrenia Research 2018; 201: 315-323.
- DiBonaventura M, Gabriel S, Dupclay L, et al: Una prospettiva del paziente sull’impatto degli effetti collaterali dei farmaci sull’aderenza: risultati di un’indagine trasversale a livello nazionale su pazienti con schizofrenia. BMC Psychiatry 2012; 12: 20.
- Solmi M, Murru A, Pacchiarotti I, et al: Sicurezza, tollerabilità e rischi associati agli antipsicotici di prima e seconda generazione: una revisione clinica all’avanguardia. Terapeutica e gestione del rischio clinico 2017; 13: 757-777.
- Citrome L: Effetti avversi attivanti e sedativi degli antipsicotici di seconda generazione nel trattamento della schizofrenia e del disturbo depressivo maggiore. J Clin Psychopharmacol 2017; 37: 138-147.
- Pillinger T, McCutcheon RA, Vano L, et al: Effetti comparativi di 18 antipsicotici sulla funzione metabolica nei pazienti con schizofrenia, predittori di disregolazione metabolica e associazione con la psicopatologia: una revisione sistematica e una meta-analisi di rete. Lancet Psychiatry 2020; 7: 64-77.
- Marteene W, Winckel K, Hollingworth S, et al: Strategie per contrastare l’aumento di peso associato agli antipsicotici nei pazienti con schizofrenia. Expert Opinion on Drug Safety 2019; 18: 1149-1160.
InFo NEUROLOGIA & PSICHIATRIA 2021; 19(4): 6-9.