La terapia con anticorpi anti-PD-1, anti-PDL-1 e anti-CTLA-4 può anche ottenere remissioni a lungo termine nei pazienti con malattie tumorali precedentemente incurabili. La risposta di un paziente affetto da carcinoma al trattamento con inibitori del checkpoint può essere valutata da alcuni fattori predittivi. Poiché l’immunoterapia comporta una forte attivazione del sistema immunitario, possono verificarsi effetti collaterali autoimmuni. Per fornire la migliore assistenza possibile ai pazienti affetti da carcinoma, è necessaria una collaborazione interdisciplinare tra oncologi e medici di base.
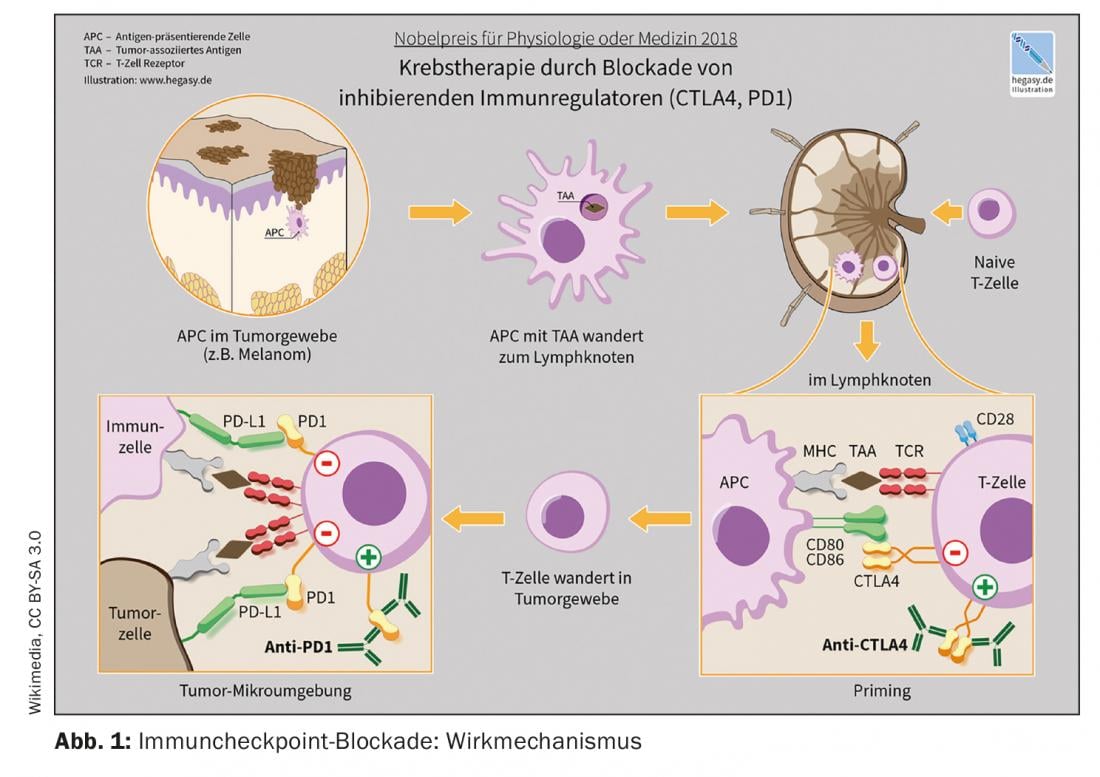
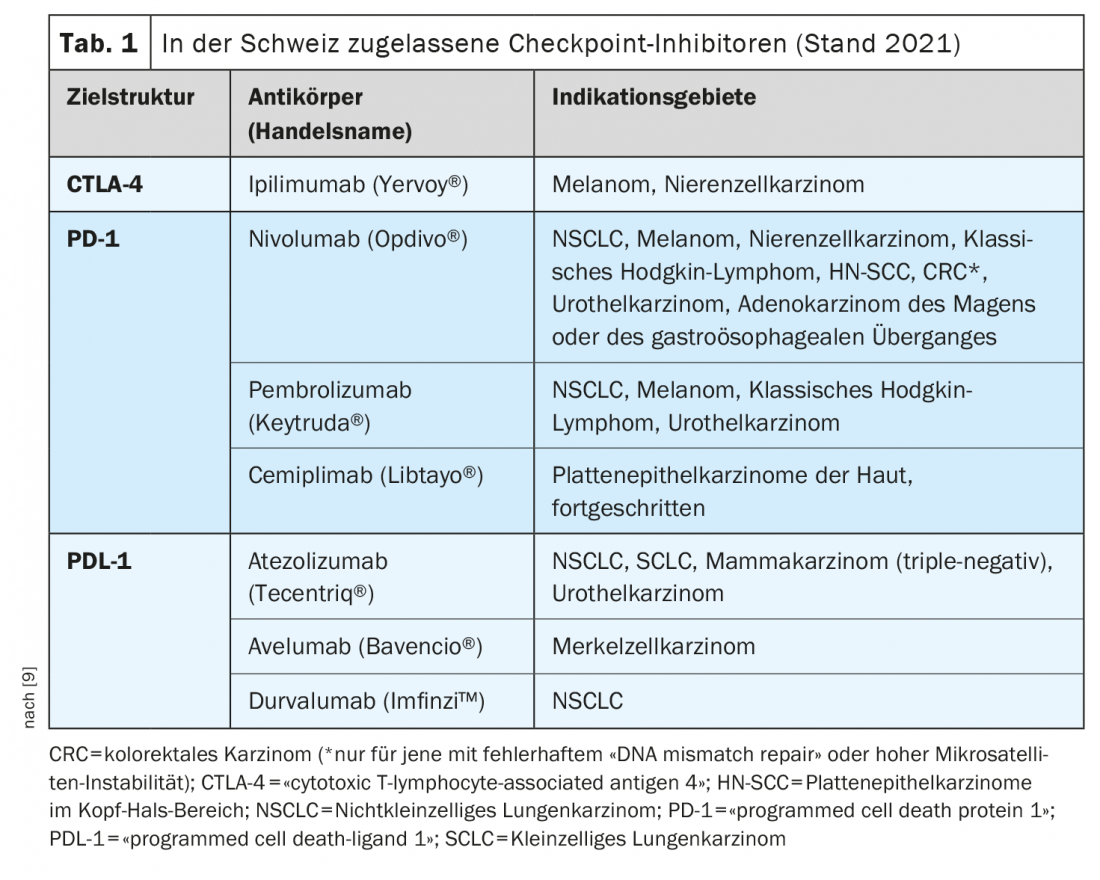
L’approvazione sul mercato dei cosiddetti inibitori del checkpoint è uno degli sviluppi più innovativi dell’immuno-oncologia degli ultimi anni. Gli inibitori del checkpoint attivano le cellule T nella lotta contro le cellule tumorali. Oggi sono disponibili diversi anticorpi monoclonali che hanno come bersaglio i checkpoint immunitari PD-1 (morte programmata-1), PDL-1 (PD ligand 1) e CTLA-4 (antigene citotossico dei linfociti T-4) [1]. Queste opzioni di trattamento sono considerate il nuovo standard per un numero sempre maggiore di entità tumorali, da sole o in combinazione con la chemioterapia, spiega Raphaël Delaloye, MD, Centro Tumori, Ospedale Universitario di Basilea [2]. L’inibizione del checkpoint è una delle strategie più utilizzate nel campo dell’immunoterapia. La loro efficacia si basa sull’attivazione della difesa del tumore, interrompendo le interazioni inibitorie tra le cellule di presentazione dell’antigene e i linfociti T nei cosiddetti checkpoint. “Gli inibitori del checkpoint immunitario possono ripristinare l’equilibrio tra le cellule tumorali e la risposta immunitaria”, spiega il relatore [2]. Con Ipilumumab (Yervoy®), il primo anticorpo anti-CTLA-4 è stato approvato nel 2011, seguito dagli anticorpi anti-PD-1 Nivolumab (Opdivo®) e Pembrolizumab (Keytruda®) nel 2015. La combinazione ipilimumab/nivolumab ha ricevuto l’approvazione di Swissmedic nel 2016 per il trattamento del melanoma [2,3]. Un esempio dell’uso combinato dell’inibizione del checkpoint immunitario e della chemioterapia è la combinazione di pembrolizumab (anti-PD-1-Ak) più carboplatino e paclitaxel o nab-paclitaxel, approvata in Svizzera per il trattamento di prima linea degli adulti con carcinoma polmonare squamoso non a piccole cellule (NSCLC) metastatico.
È possibile prevedere la risposta alla terapia?
Ci sono due fattori principali che spiegano perché non tutti i pazienti mostrano la stessa risposta alla terapia con inibitori del checkpoint immunitario. Da un lato, la rilevanza dei meccanismi bloccati per la tolleranza tumorale è decisiva. La determinazione dell’espressione di PDL-1 nei campioni di tumore ha dimostrato di essere un biomarcatore predittivo della risposta agli inibitori di PD-1/PDL-1 [4]. Il relatore ha illustrato questo aspetto con il seguente esempio: nello studio CheckMate 057, è stata dimostrata un’associazione tra l’espressione di PDL-1 e la risposta clinica a nivolumab nel NSCLC come terapia di seconda linea [2,5]. I pazienti che avevano una forte espressione di PDL-1 avevano maggiori probabilità di rispondere al trattamento anti-PDL-1, tuttavia, anche quelli con meno dell’1% di PDL-1 hanno mostrato una risposta migliore rispetto alla chemioterapia (docetaxel) [2,5]. Il secondo fattore importante per la risposta alla terapia è il “microambiente” del tumore. Il microambiente circostante le cellule tumorali svolge un ruolo importante [2]. A seconda della presenza di cellule immunitarie attive nel tumore, questo viene definito infiammato (“caldo”) o non infiammato (“freddo”) [6]. Le firme geniche infiammatorie sono associate a una migliore risposta alle immunoterapie.

Gestione degli effetti collaterali: Cosa bisogna considerare?
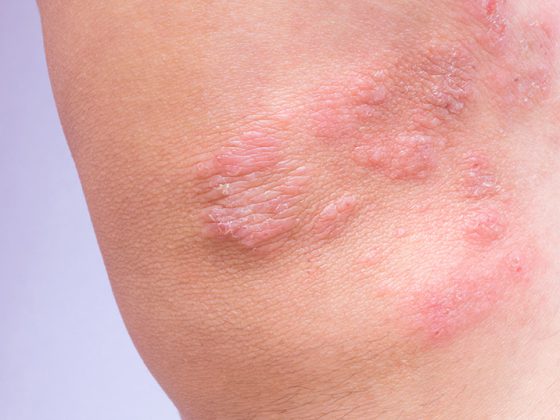
Gli inibitori del checkpoint immunitario possono essere utilizzati da soli, in combinazione con un’altra immunoterapia (ad esempio nel melanoma) o in combinazione con la chemioterapia (ad esempio nel NSCLC). L’intervallo di dosaggio dell’inibizione del checkpoint somministrato come infusione endovenosa è solitamente di due o tre settimane. “Di norma, questa infusione non richiede una premedicazione, a differenza della chemioterapia”, spiega il dottor Delaloye [2]. Di solito non c’è tossicità acuta, come nausea o reazione allergica; gli effetti collaterali si manifestano con l’immunoterapia solo dopo un certo ritardo. La forte attivazione del sistema immunitario legata alla terapia è accompagnata dal pericolo che le cellule immunitarie distruggano anche i tessuti sani dell’organismo, per cui in linea di principio ogni organo può essere attaccato. In alcuni casi, questi effetti collaterali possono essere pericolosi per la vita. La diagnosi precoce è fondamentale, e i medici di base svolgono un ruolo molto importante, sottolinea la dottoressa Delaloye [2]. Gli effetti collaterali più comuni si manifestano 6-8 settimane dopo l’inizio dell’immunoterapia. Pertanto, i pazienti in immunoterapia devono sempre essere considerati per un effetto collaterale immuno-mediato, se si presentano nuovi sintomi. I più comuni sono esantema, diarrea, colite o gastrite. Più raramente, possono verificarsi malattie della tiroide, insufficienza renale, epatite o polmonite. Il docente raccomanda di contattare gli specialisti oncologici curanti in caso di sospetto corrispondente e mostra, con l’aiuto di casi di studio, come può essere la gestione di successo degli effetti collaterali immuno-mediati (riquadro) [2].

Immunoterapia del cancro quo vadis – rimane eccitante
Oltre agli inibitori del checkpoint, le terapie con cellule T sono tra le innovazioni più promettenti nel campo dell’immuno-oncologia. Ne possono beneficiare soprattutto i pazienti con malattie tumorali avanzate. La terapia genica del TCR (recettore delle cellule T) prevede il trapianto di un recettore delle cellule T specifico per la mutazione in cellule T fresche ottenute dal sangue del paziente. Le cellule T geneticamente modificate in questo modo non sono limitate dal punto di vista funzionale e possono quindi, di nuovo nel corpo della persona malata, combattere il cancro [8]. La terapia con cellule T CAR (recettore antigenico chimerico) si basa su cellule T geneticamente modificate con recettori sintetici specifici per l’antigene. Tisagenlecleucel è un composto del gruppo delle cellule CAR-T, approvato nel 2018 [7].
Un altro tema importante dell’immuno-oncologia è la ricerca sui vaccini contro il cancro [7]. Questi si basano su un principio simile a quello degli inibitori del checkpoint, ma dovrebbero comportare un rischio minore di effetti collaterali tossici. Per i pazienti i cui tumori non presentano neoantigeni, gli scienziati possono attingere a un’ampia selezione di epitopi di antigeni germinali ampiamente specifici del tumore per lo sviluppo di vaccini [7]. La ricerca si concentra anche sull’ulteriore sviluppo di nuove piattaforme tecnologiche che generano profili di biomarcatori altamente complessi basati su analisi microscopiche, genetiche, molecolari e sperimentali, al fine di prevedere meglio il successo degli interventi terapeutici [7].
Congresso: Forum per la formazione medica continua
Letteratura:
- Kähler KC, et al: per il Comitato Effetti Collaterali Cutanei del Gruppo di Lavoro sull’Oncologia Dermatologica: JDDG 2020; 18(6): 582-609.
- Delaloye R: Immunoterapia e terapie mirate in oncologia. Raphaël Delaloye, MD, Forum per la formazione medica continua 27.01.2022
- Informazioni sui farmaci, www.swissmedicinfo.ch (ultimo accesso 30.03.2022)
- Prelaj A, et al: Eur J Cancer 2019; 106: 144-159.
- Horn L, et al: J Clin Oncol 2017; 35: JCO2017743062-33.
- Hegde PS, Karanikas V, Evers S: Clin Cancer Res 2016; 22(8): 1865-1874.
- Consorzio Tedesco per la Ricerca Traslazionale sul Cancro, https://dktk.dkfz.de (ultimo accesso 30.03.2022).
- Centro Max Delbrück per la Medicina Molecolare, www.mdc-berlin.de/de/news (ultimo accesso 30.03.2022)
- Riggenbach E, et al.: Swiss Med Forum 2021; 21(0506): 78-82.
PRATICA GP 2022; 17(4): 38-39