L’uso dell’inibitore VEGF bevacizumab migliora l’esito dei pazienti con carcinoma colorettale metastatico, indipendentemente dalla chemioterapia scelta. Dati recenti suggeriscono che la durata dell’inibizione del VEGF gioca un ruolo importante nell’esito del trattamento.
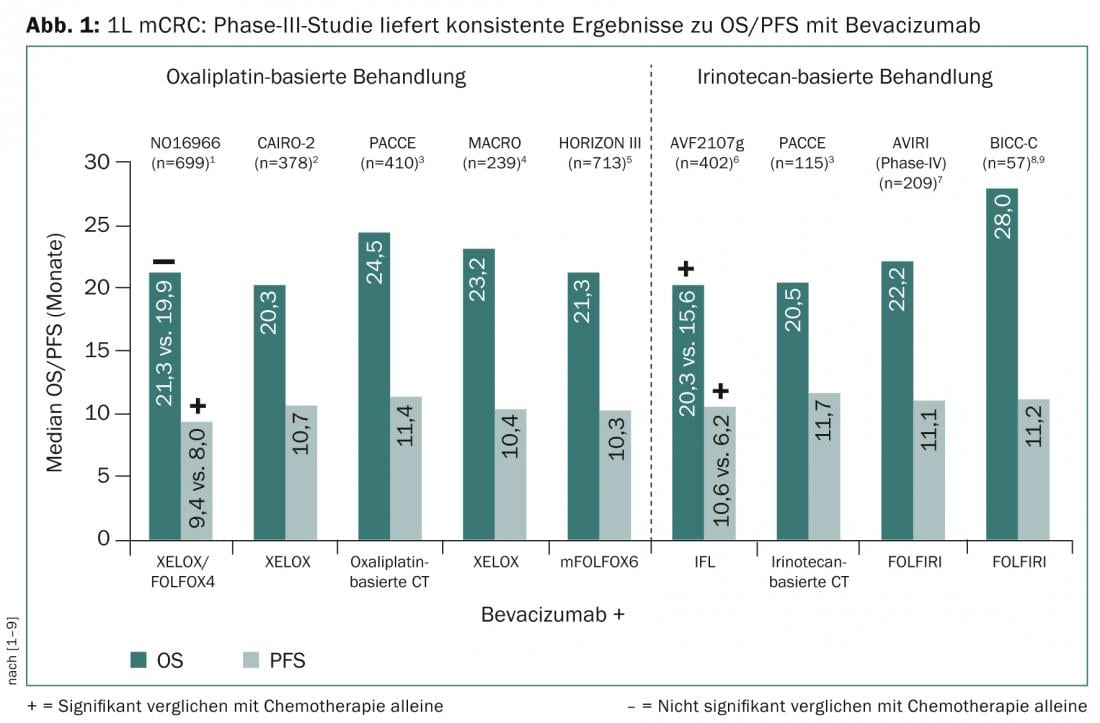
La possibilità di ridurre le metastasi primarie irresecabili e di massimizzare il tempo di sopravvivenza sono tra gli obiettivi terapeutici del carcinoma colorettale metastatico (mCRC). Negli studi sul trattamento di prima linea del mCRC, l’uso dell’inibitore del fattore di crescita endoteliale vascolare (VEGF) bevacizumab in aggiunta alla chemioterapia di combinazione a base di oxaliplatino o irinotecan ha mostrato costantemente una sopravvivenza libera da progressione (PFS) di 10-12 mesi e un prolungamento della sopravvivenza globale (OS) di 22-28 mesi (Fig. 1).
Buone ragioni per l’uso dell’inibitore del VEGF come monoterapia nel mCRC naïve alla terapia sono state fornite dallo studio AVEX [10]. Questo ha dimostrato che bevacizumab più capecitabina ha portato a un aumento significativo della PFS rispetto alla sola capecitabina (9,1 mesi vs. 5,1; HR: 0,53; p<0,0001). “Si tratta di un grande passo avanti e di una buona ragione per combinare terapie meno intensive, in particolare con un inibitore VEGF”, ha detto il Prof. Dirk Arnold, MD, Direttore del Centro di Biologia dei Tumori di Friburgo i. Br. alla 2ª Conferenza sul cancro gastrointestinale EORTC di San Gallo. L’esperto ha risposto alla domanda sull’uso degli inibitori di VEGF in una tripla combinazione basandosi sui risultati di TRIBE, uno studio di fase III che ha confrontato bevacizumab in combinazione con FOL-FOXIRI (5-FU, acido folinico, oxaliplatino, irinotecan) o con FOLFIRI (5-FU, acido folinico, irinotecan) nella terapia di prima linea del mCRC irresecabile [11]. C’è stato un miglioramento significativo della PFS (12,2 vs. 9,7 mesi; 0,73; p=0,0012) e del tasso di risposta (65 vs. 53%) con la tripla combinazione più bevacizumab. “Lo studio TRIBE mostra una tollerabilità sorprendentemente buona e i migliori risultati di efficacia di tutti gli studi di fase III sul mCRC fino ad oggi”, ha spiegato il Prof. Arnold. La strategia della tripla terapia è supportata dai dati dello studio OLIVIA, che ha mostrato, tra l’altro, un tasso di resezione R0 doppio (endpoint secondario; 48,8 vs. 23,1) con FOLFOXIRI più bevacizumab rispetto a un regime FOLFOX6 modificato più bevacizumab [12].
I dati sul beneficio degli inibitori di VEGF nella terapia di seconda linea provengono dallo studio E3200 sulla chemioterapia a base di oxaliplatino (FOLFOX) più bevacizumab e dallo studio VELOUR sull’aflibercept come aggiunta a FOLFIRI [13,14]. Entrambe le strategie hanno mostrato un miglioramento significativo della sopravvivenza globale.
L’evidenza che gli inibitori di VEGF dovrebbero essere utilizzati in modo continuativo tra la prima e la seconda linea di terapia deriva dallo studio TML. Questo ha dimostrato che la somministrazione continua di bevacizumab oltre la progressione della combinazione di chemioterapia di prima linea, in combinazione con la terapia di seconda linea, ha migliorato la sopravvivenza globale dei pazienti [15]. Tale approccio è supportato dai risultati dello studio BEBYP e da una sottoanalisi di VELOUR – in questo caso con aflibercept [16,17]. Tuttavia, un confronto indiretto dei dati degli studi TML e VELOUR ha mostrato che l’aggiunta di aflibercept ha portato a un aumento più significativo degli effetti collaterali legati alla chemioterapia, mentre questi non sono aumentati con la continuazione del bevacizumab [17]. Dallo scorso anno, si discute anche se il trattamento con gli inibitori del VEGF debba essere continuato o interrotto durante il periodo libero da progressione come “terapia di mantenimento”. I risultati di fase III dello studio CAIRO-3, presentati all’ASCO GI a gennaio, supportano il trattamento end-to-end [18]. Maggiori informazioni saranno fornite dai risultati di AIO 0207, i cui risultati saranno presentati all’ASCO 2014.
Fonte: “I biologici nel cancro del colon-retto – stato dell’arte”, Simposio satellite di Roche alla2a Conferenza sul Cancro Gastrointestinale (GICC) dell’EORTC (Organizzazione Europea per la Ricerca e la Cura del Cancro) di San Gallo 2014, 7 marzo 2014, San Gallo.
Letteratura:
- Saltz, et al: JCO 2008; 26(12): 2013-2019.
- Tol, et al: NEJM 2009; 360(6): 563-572.
- Hecht, et al: JCO 2009; 27(5): 672-680.
- Díaz-Rubio, et al: Oncologist 2012; 17(1):15-25.
- Schmoll, et al: JCO 2012; 30(29): 3588-3595.
- Hurwitz, et al: NEJM 2004; 350(23): 2335-2342.
- Sobrero, et al: Oncologia 2009; 77(2): 113-119.
- Fuchs, et al: JCO 2008; 26(4): 689-690.
- Fuchs, et al: JCO 2007; 25(30): 4779-4786.
- Cunningham D, et al: Lancet Oncol 2013; 14(11): 1077-1085.
- Falcone A, et al: JCO 2013 (Suppl. abstr 3505).
- Bridgewater J, et al: Congresso europeo sul cancro 2013, abstract 2159.
- Giantonio BJ, et al: JCO 2007; 25(12): 1539-1544.
- Van Cutsem E, et al: JCO 2012; 30(28): 3499-3506.
- Bennouna J, et al: Lancet Oncol 2013; 14(1): 29-37.
- Masi G, et al: Ann Oncol 2012; 23 (Suppl. 9): abstract LBA17.
- Carmen JA, et al: JCO 2012; 31 (Suppl. abstr 3505).
- Koopman M, et al: JCO 2013; 31 (Suppl. abstr 3502).
InFo ONCOLOGIA & EMATOLOGIA 2014; 2(5): 30-31