Dopo l’impianto di stent, la trombosi dello stent è una delle complicanze acute più importanti. È quindi indicata un’efficace inibizione dell’aggregazione piastrinica. Ma che aspetto ha?
Agli albori dell’angiografia coronarica, le lesioni venivano inizialmente trattate solo con la dilatazione con palloncino. Solo a metà degli anni ’80 sono stati sviluppati i primi stent [1,2]. Da allora, la tecnologia degli stent, ma anche le possibilità nel campo dell’inibizione dell’aggregazione piastrinica, si sono sviluppate costantemente.
Ruolo della doppia terapia antiaggregante (DAPT) e suo sviluppo
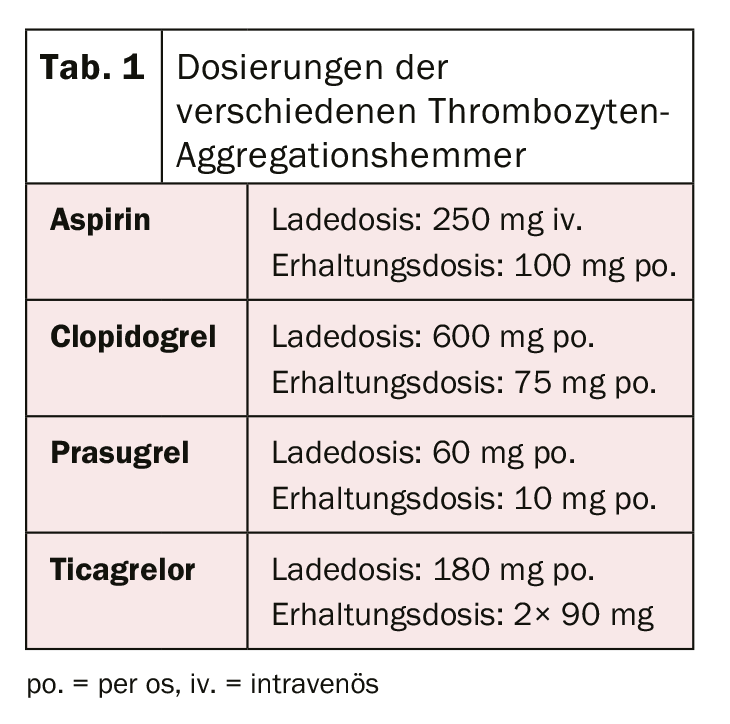
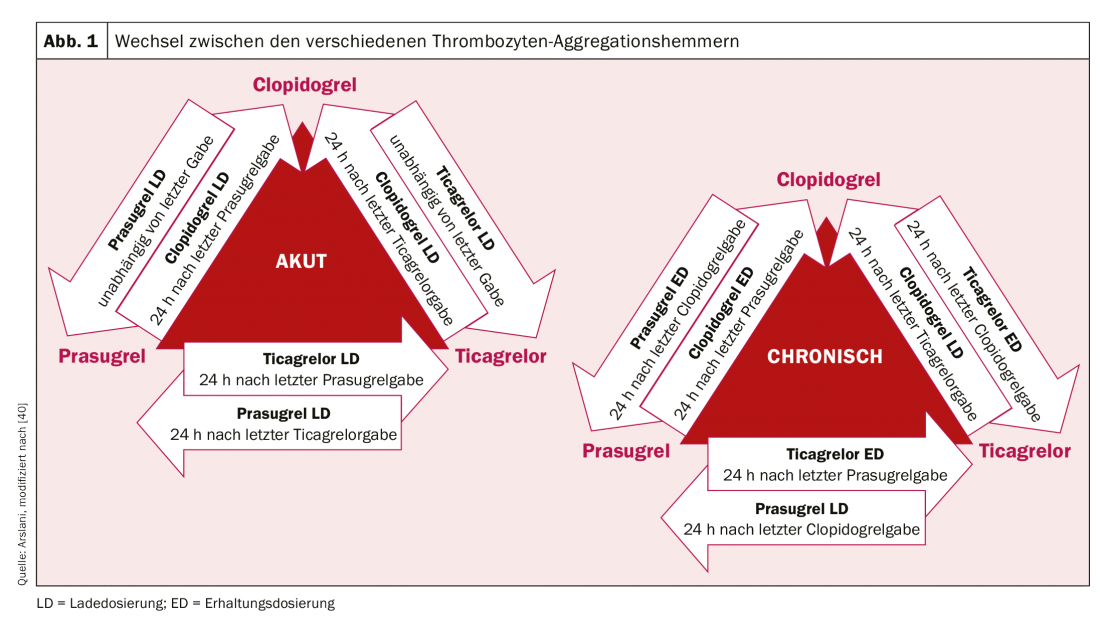
Dopo la rivoluzione del primo impianto di stent nel 1986 da parte di Sigwart et al. [2], le prime difficoltà e complicazioni associate si sono manifestate in tempi relativamente brevi. La complicanza acuta più importante dopo l’impianto di stent è e rimane la trombosi dello stent, che si è verificata con un tasso di quasi il 20% nei primi giorni. Per evitarlo, sono state valutate diverse terapie per la fluidificazione del sangue o l’inibizione dell’aggregazione piastrinica dopo l’impianto di stent. Dopo che il trattamento con destrano a basso peso molecolare, aspirina (ASA), dipiridamolo ed eparina per via endovenosa non ha raggiunto i risultati desiderati, i pazienti sono stati sistematicamente anticoagulati per via orale con warfarin dopo l’impianto di stent. Sebbene questo abbia comportato una riduzione significativa della trombosi acuta e subacuta dello stent al 3,5%, è stato anche associato a un aumento significativo delle complicanze emorragiche. [3–5]. Nella ricerca dell’equilibrio ideale tra la prevenzione della temuta trombosi dello stent e l’aumento del rischio di sanguinamento, sono stati successivamente studiati diversi altri regimi terapeutici. La doppia (dual) inibizione dell’aggregazione piastrinica è sembrata la più efficace. Per esempio, uno studio di Leon et al. ha dimostrato che una riduzione significativa della trombosi dello stent e delle complicanze associate può essere ottenuta con una terapia combinata con ASA e ticlopidina. [6,7]. Poiché con la ticlopidina si sono verificati gravi effetti collaterali (tra cui allergie, ulcere, diarrea, disfunzione epatica e neutropenia), questo farmaco è stato rapidamente sostituito dal clopidogrel, molto più tollerato [8]. L’ASA impedisce l’attivazione piastrinica mediata dal trombossano e il clopidogrel impedisce l’attivazione piastrinica mediata dall’ADP, per cui entrambi i blocchi agiscono in modo additivo e quindi l’inibizione e quindi anche la riduzione della formazione di trombi è significativamente più efficace rispetto alla monoterapia. Il clopidogrel è un farmaco che viene prima metabolizzato nel fegato dal citocromo P450 2C19 e da altri enzimi CYP, e il suo metabolita attivo si lega successivamente in modo irreversibile ai recettori P2Y12 delle piastrine, riducendo così l’attivazione piastrinica mediata dall’ADP. Poiché gli enzimi che attivano il clopidogrel nel fegato sono geneticamente diversi, l’effetto antiaggregante piastrinico del clopidogrel non è ugualmente pronunciato in tutte le persone. Dopo i pazienti con stenting elettivo, l’efficacia della doppia terapia antiaggregante con ASA e clopidogrel è stata dimostrata anche nei pazienti con infarto miocardico acuto non-ST-elevato, con una riduzione significativa degli eventi cardiovascolari [9]. L’ulteriore ottimizzazione dell’inibizione dell’aggregazione piastrinica è stata ottenuta grazie all’uso di nuovi inibitori del recettore P2Y12. Anche il prasugrel è un prodrug del gruppo delle tienopiridine, viene metabolizzato (o attivato) nel fegato e si lega in modo irreversibile, ma più rapido e forte, ai suddetti recettori. Inoltre, a differenza del clopidogrel, non ci sono differenze geneticamente determinate nell’attivazione del prasugrel. Lo studio TRITON-TIMI 38 [10] ha dimostrato che prasugrel ha portato ad un’ulteriore riduzione degli eventi cardiovascolari rispetto a clopidogrel. Nonostante l’aumento delle complicanze emorragiche, il beneficio clinico è stato chiaramente dimostrato a favore di prasugrel, con una riduzione significativa degli endpoint ischemici (tranne che nei pazienti di età ≥75 anni, con basso peso corporeo (<60 kg) e nei pazienti dopo eventi cerebrovascolari). A causa del rischio più elevato di emorragia, prima della somministrazione di prasugrel si deve conoscere anche lo stato coronarico o l’intenzione di impiantare uno stent. Il carico pre-interventistico è attualmente raccomandato solo per l’infarto miocardico con elevazione del segmento ST [11]. Il ticagrelor appartiene alla classe delle ciclopentriazolopirimidine ed è un inibitore P2Y12 competitivo e quindi reversibile, che viene assunto come metabolita attivo (senza attivazione enzimatica). Anche nello studio PLATO [12], il ticagrelor si è dimostrato superiore al clopidogrel. È stata dimostrata una riduzione della mortalità cardiovascolare, dell’infarto miocardico e della trombosi dello stent, e non è stata riscontrata alcuna evidenza di un aumento delle complicanze emorragiche. Rispetto ad altri studi, tuttavia, in alcuni casi sono state utilizzate definizioni di sanguinamento diverse. A differenza del prasugrel, l’effetto positivo è stato osservato anche nei pazienti trattati in modo conservativo (senza intervento e stenting) o con un intervento di bypass [12,13]. Nei pazienti con infarto miocardico con sopraslivellamento ST, è stato dimostrato che il pretrattamento con ticagrelor prima dell’angiografia coronarica comporta tassi inferiori di trombosi dello stent [14]. Purtroppo non è ancora stato effettuato un confronto tra le sostanze ticagrelor e prasugrel. La dose di carico iniziale e la dose di mantenimento dei diversi farmaci sono riassunte nella tabella 1. Nella pratica clinica quotidiana, può essere necessario passare da una preparazione all’altra (ad esempio, in caso di intolleranza al farmaco). L’algoritmo per il passaggio da una preparazione all’altra in base al contesto clinico (cronico o acuto) è illustrato nella figura 1 .
Sviluppo degli stent
Come già detto, agli albori dell’intervento coronarico, il vaso veniva trattato solo con la dilatazione con palloncino. Tuttavia, a causa della dissezione, del contraccolpo elastico in caso di allungamento eccessivo e del rimodellamento tardivo con proliferazione intimale, spesso si è verificata una nuova occlusione del vaso e una restenosi. Per contrastare questo fenomeno e mantenere i vasi aperti dopo la dilatazione, sono state sviluppate reti vascolari con palloncino o autoespandibili (stent), che sono state impiantate dopo il pre-trattamento con dilatazione con palloncino. All’inizio, questi stent erano difficili da usare a causa della loro natura, del materiale utilizzato e della tecnica di impianto ancora giovane (per lo più in acciaio inossidabile con puntoni spessi). Nel corso del tempo, tuttavia, questi stent metallici (oggi noti anche come stent di metallo nudo, BMS) sono stati ulteriormente sviluppati in modo da essere molto più facili da usare (impianto mediante espansione con palloncino, stent più sottili, leghe più leggere). Sebbene all’inizio sia stato dimostrato che i BMS sono superiori alla semplice dilatazione con palloncino [3,4], il decorso a lungo termine ha mostrato tassi rilevanti di ristenosi istintiva dovuta all’eccessiva proliferazione intimale. Per contrastare questa proliferazione, sono stati sviluppati i cosiddetti stent a rilascio di farmaco (DES). I DES di prima generazione erano realizzati con le stesse leghe del BMS, ma erano rivestiti con un farmaco antiproliferativo a rilascio polimerico, come il sirolimus o il paclitaxel. Questo ha portato a una riduzione della formazione di neo-intima e quindi a una diminuzione significativa della restenosi istintiva [15–17]. Tuttavia, a causa dell’endotelizzazione ritardata causata dai farmaci antiproliferativi e quindi del contatto più lungo degli stent con il flusso sanguigno, diversi studi hanno evidenziato un tasso significativamente maggiore di trombosi tardiva dello stent e di infarto miocardico [18,19]. In risposta, è stata ulteriormente sviluppata non solo l’inibizione dell’aggregazione piastrinica, ma anche la composizione dello stent. Nei DES di seconda e terza generazione, sono stati utilizzati polimeri biocompatibili e farmaci più efficienti, come l’everolimus, in dosi più basse per il rivestimento, con il risultato di una più rapida e migliore endotelizzazione degli stent. Insieme alla DAPT migliorata, è stato possibile dimostrare una sicurezza significativamente migliorata con la stessa efficacia con i DES in uso oggi rispetto alla prima generazione di DES [20,21], che ha praticamente portato alla scomparsa dei BMS non rivestiti. In un ulteriore passo, oltre ai nuovi stent, anche la dilatazione con palloncino si è sviluppata ulteriormente ed è possibile trattare i vasi più piccoli utilizzando palloncini rivestiti di farmaci (DCB) senza l’impianto di stent [22].
Durata della DAPT dopo l’impianto di stent
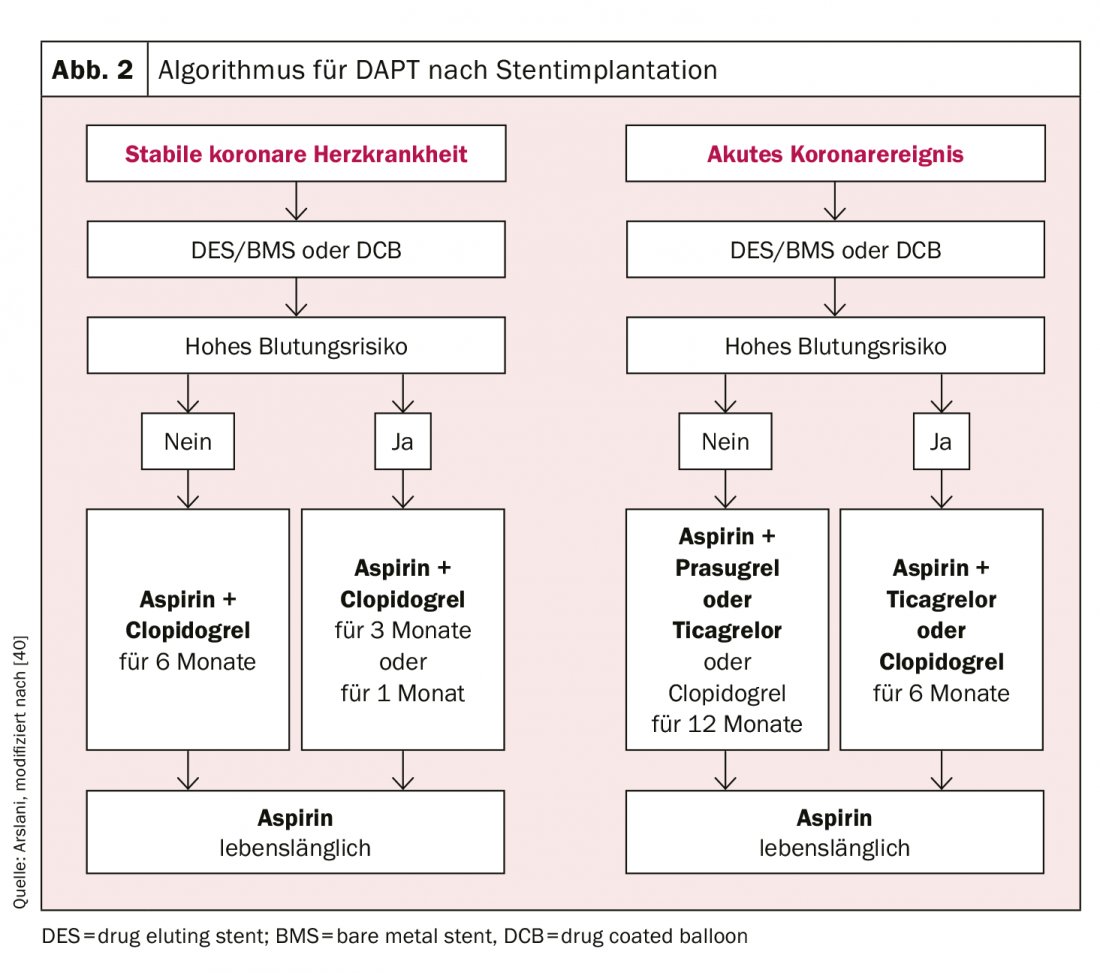
Per quanto riguarda la durata della DAPT, occorre fare una chiara distinzione tra i pazienti con infarto miocardico acuto e i pazienti con malattia coronarica stabile. Nei pazienti con malattia coronarica stabile, è stato dimostrato che non c’è differenza negli eventi cardiovascolari e nella mortalità tra una durata del trattamento di 6 mesi e ≥12 mesi [23,24]. D’altra parte, c’è stato un aumento significativo delle complicanze emorragiche rilevanti con una durata del trattamento superiore a 12 mesi ed è stato dimostrato un aumento della mortalità [25,26]. Poiché non sono stati condotti studi sulla DAPT composta da ASA e ticagrelor o prasugrel nei pazienti con malattia coronarica stabile, in questo contesto si raccomanda la DAPT con clopidogrel. Tuttavia, in pazienti selezionati ad alto rischio ischemico, si può scegliere uno degli altri farmaci. In sintesi, la doppia terapia antiaggregante con ASA e clopidogrel per 6 mesi è raccomandata nei pazienti con coronaropatia stabile dopo l’intervento, indipendentemente dal tipo di stent, e anche dopo il trattamento con un DCB da solo [27]. Se c’è un aumento del rischio di sanguinamento (punteggio Precise-DAPT ≥25, www.precisedaptscore.com) [28], la durata della terapia può essere ridotta a 3 mesi [29,30] e in casi selezionati anche a 1 mese [31,32]. Tuttavia, se la durata della terapia viene ridotta (soprattutto a 1 mese), il rischio di recidiva di eventi cardiovascolari deve essere attentamente valutato rispetto al rischio di sanguinamento.
Le raccomandazioni per i pazienti dopo una sindrome coronarica acuta si basano sugli studi comparativi di prasugrel o ticagrelor con clopidogrel. Questi studi sono alla base dell’attuale raccomandazione che i pazienti dovrebbero ricevere una doppia terapia antiaggregante con ASA e ticagrelor o prasugrel per 12 mesi dopo un evento acuto, anche indipendentemente dal tipo di stent [9,10,12]. Secondo i dati attuali, in particolare lo studio PEGASUS [33] La terapia antiaggregante doppia prolungata deve essere utilizzata solo nei pazienti a maggior rischio ischemico (età ≥50 anni e più di uno dei seguenti fattori: >65 anni, diabete mellito che richiede un trattamento, ulteriore infarto del miocardio, malattia coronarica multivelocitaria o insufficienza renale con una clearance di <60 ml/min) e senza precedenti complicazioni emorragiche devono essere presi in considerazione. La terapia con ticagrelor 60 mg due volte al giorno è preferibile [27]. Una riduzione della durata della terapia a 6 mesi è possibile anche con un rischio accettabile in caso di aumento del rischio di sanguinamento (punteggio Precise-DAPT ≥25) [28]. Nei dati finora disponibili, solo una riduzione a <6 mesi ha mostrato un aumento sostanziale degli eventi cardiovascolari.
Anticoagulazione e DAPT
Un’altra sfida è rappresentata dai pazienti con indicazione all’anticoagulazione orale. Anche in questo caso, è importante trovare l’equilibrio ideale tra il rischio di sanguinamento e i rischi di trombosi dello stent o di eventi cardiovascolari. Si raccomanda una tripla terapia con ASA, clopidogrel e un’anticoagulazione orale consolidata con un antagonista della vitamina K (VKA) o uno dei nuovi anticoagulanti orali (NOAK). Il valore INR a cui mirare deve essere selezionato al limite inferiore (INR 2-2,5) e il dosaggio più basso approvato per la prevenzione degli eventi cerebrovascolari deve essere selezionato per i NOAK (dabigatran 110 mg 2× al giorno, rivaroxaban 15 mg 1× al giorno, apixaban 5 mg 2× al giorno o 2,5 mg se sono presenti 2 dei seguenti fattori di rischio: età ≥80 anni, peso ≤60 kg, creatinina ≥133 umol/l). [27]. Anticoagulazione orale combinata con ASA e clopidogrel [34], poiché ci sono pochi dati sugli altri inibitori P2Y12 e nei dati dei registri è stato descritto un aumento del rischio di sanguinamento [35]. Nel determinare la durata della triplice terapia, il rischio di emorragia (punteggio HAS-BLED [ipertensione, funzione renale/fegato anormale, storia di ictus, storia di emorragia, situazione di INR instabile, età superiore a 65 anni, abuso di alcol/medicinali, ad esempio FANS; rischio elevato di emorragia con ≥3 punti) [36] deve essere nuovamente soppesato rispetto al rischio di trombosi. Se il rischio di sanguinamento è elevato, la triplice terapia deve essere limitata a un mese, seguita da una duplice terapia (ASA o clopidogrel + anticoagulazione orale a dosaggio normale) per un totale di un anno [34,37]. Se il rischio di trombosi è elevato, si raccomanda di prolungare la triplice terapia fino a 6 mesi [38], dopodiché si deve seguire anche la duplice terapia con ASA o clopidogrel per altri 6 mesi. Dopo un anno, la monoterapia con anticoagulazione orale può essere proseguita nella maggior parte dei casi [39].
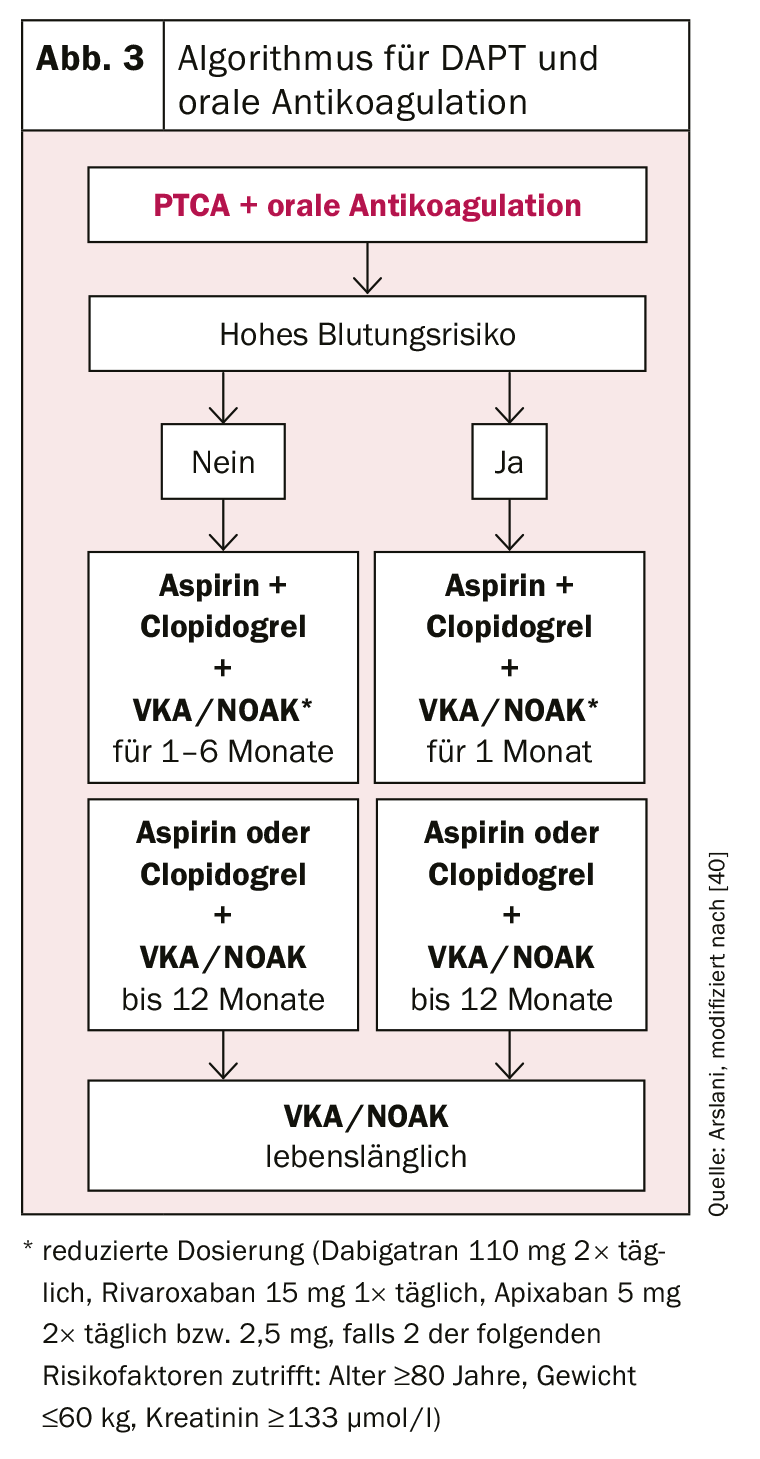
L’uso dei diversi inibitori dell’aggregazione piastrinica secondo le attuali raccomandazioni della Società Europea di Cardiologia sono riassunte nelle figure 2 e 3 .
Letteratura:
- 1 Gruntzig A: Dilatazione transluminale della stenosi coronarica. Lancet, 1978. 1(8058): 263.
- 2 Sigwart U, et al: Stent intravascolari per prevenire l’occlusione e la restenosi dopo l’angioplastica transluminale. N Engl J Med, 1987. 316(12): 701-706.
- Fischman DL, et al: Un confronto randomizzato tra il posizionamento di uno stent coronarico e l’angioplastica con palloncino nel trattamento della malattia coronarica. Studi sulla ristenosi dello stent Investigatori. N Engl J Med, 1994. 331(8): 496-501.
- Serruys PW, et al: Un confronto tra l’impianto di stent espandibili con palloncino e l’angioplastica con palloncino nei pazienti con malattia coronarica. Gruppo di studio BenestentN Engl J Med, 1994. 331(8): 489-495.
- Cohen DJ, et al: Esiti economici intraospedalieri e a un anno dopo lo stenting coronarico o l’angioplastica con palloncino. Risultati di uno studio clinico randomizzato. Studi sulla ristenosi dello stent Investigatori. Circolazione, 1995. 92(9): 2480-2487.
- Leon MB, et al: Uno studio clinico che confronta tre regimi di farmaci antitrombotici dopo lo stenting dell’arteria coronaria. Gli investigatori dello Studio sulla Restenosi con Anticoagulazione dello Stent. N Engl J Med, 1998. 339(23): 1665-1671.
- Schomig A, et al: Un confronto randomizzato della terapia antiaggregante e anticoagulante dopo il posizionamento di stent coronarici. N Engl J Med, 1996. 334(17): 1084-1089.
- Bertrand ME, et al: Studio in doppio cieco sulla sicurezza del clopidogrel con e senza dose di carico in combinazione con l’aspirina rispetto alla ticlopidina in combinazione con l’aspirina dopo lo stenting coronarico: lo studio cooperativo internazionale clopidogrel aspirina stent (CLASSICS). Circolazione, 2000, 102(6): 624-629.
- Yusuf S, et al: Effetti del clopidogrel in aggiunta all’aspirina nei pazienti con sindromi coronariche acute senza innalzamento del segmento ST. N Engl J Med, 2001. 345(7): 494-502.
- Wiviott SD, et al: Prasugrel rispetto a clopidogrel nei pazienti con sindromi coronariche acute. N Engl J Med, 2007. 357(20): 2001-2015.
- Montalescot G, et al: Pretrattamento con prasugrel nelle sindromi coronariche acute senza elevazione del segmento ST. N Engl J Med, 2013. 369(11): 999-1010.
- Wallentin L, et al: Ticagrelor rispetto a clopidogrel nei pazienti con sindromi coronariche acute. N Engl J Med, 2009. 361(11): 1045-57.
- Roe MT, et al: Prasugrel rispetto a clopidogrel per le sindromi coronariche acute senza rivascolarizzazione. N Engl J Med, 2012. 367(14): 1297-1309.
- Montalescot G, et al: Ticagrelor pre-ospedaliero nell’infarto miocardico con innalzamento del segmento ST. N Engl J Med, 2014. 371(11): 1016-1027.
- Morice MC, et al: Confronto randomizzato tra uno stent a rilascio di sirolimus e uno stent standard per la rivascolarizzazione coronarica. N Engl J Med, 2002. 346(23): 1773-1780.
- Moses JW, et al: Stent a rilascio di sirolimus rispetto a stent standard in pazienti con stenosi in un’arteria coronarica nativa. N Engl J Med, 2003. 349(14): 1315-1323.
- Stone GW, et al: Uno stent a base di polimeri, a rilascio di paclitaxel nei pazienti con malattia coronarica. N Engl J Med, 2004. 350(3): 221-231.
- McFadden EP, et al: Trombosi tardiva negli stent coronarici a rilascio di farmaco dopo l’interruzione della terapia antipiastrinica. Lancet, 2004. 364(9444): 1519-1521.
- Lagerqvist B, et al: Trombosi da stent in Svezia: un rapporto del Registro Svedese di Angiografia Coronarica e Angioplastica. Circ Cardiovasc Interv, 2009. 2(5): 401-408.
- Stone GW, et al: Stent a rilascio di Everolimus rispetto a stent a rilascio di paclitaxel nella malattia coronarica. N Engl J Med, 2010. 362(18): 1663-1674.
- Planer D, et al: Confronto tra stent a rilascio di everolimus e paclitaxel nei pazienti con sindromi coronariche acute e stabili: risultati raggruppati degli studi SPIRIT (A Clinical Evaluation of the XIENCE V Everolimus Eluting Coronary Stent System) e COMPARE (A Trial of Everolimus-Eluting Stents and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice). JACC Cardiovasc Interv, 2011. 4(10): 1104-1115.
- Jeger RV, et al: Palloncini rivestiti di farmaci per la malattia coronarica di piccole dimensioni (BASKET-SMALL 2): uno studio randomizzato in aperto di non inferiorità. Lancet, 2018. 392(10150): 849-856.
- Gwon HC, et al: Terapia antiaggregante doppia a sei mesi rispetto a quella a 12 mesi dopo l’impianto di stent a rilascio di farmaco: lo studio randomizzato, multicentrico Efficacy of Xience/Promus Versus Cypher to Reduce Late Loss After Stenting (EXCELLENT). Circolazione, 2012. 125(3): 505-513.
- Valgimigli M, et al: Durata a breve e a lungo termine della terapia doppia antiaggregante dopo lo stenting coronarico: uno studio multicentrico randomizzato. Circolazione, 2012. 125(16): 2015-2026.
- Costa F, et al: Impatto della presentazione clinica sugli esiti ischemici e di sanguinamento nei pazienti che ricevono una durata di 6 o 24 mesi della duplice terapia antiaggregante dopo l’impianto di stent: un’analisi prespecificata dello studio PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia). Eur Heart J, 2015. 36(20): 1242-1251.
- Bittl JA, et al: Durata della doppia terapia antiaggregante: una revisione sistematica per l’aggiornamento focalizzato sulle linee guida ACC/AHA del 2016 sulla durata della doppia terapia antiaggregante nei pazienti con malattia coronarica: un rapporto della task force dell’American College of Cardiology/American Heart Association sulle linee guida di pratica clinica. J Am Coll Cardiol, 2016. 68(10): 1116-1139.
- Valgimigli M, et al: [2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS.]. Cardiol Pol, 2017. 75(12): 1217-1299.
- Costa F, et al: Derivazione e validazione del punteggio di previsione delle complicanze emorragiche nei pazienti sottoposti a impianto di stent e successiva terapia antipiastrinica duale (PRECISE-DAPT): un’analisi congiunta di set di dati individuali di studi clinici. Lancet, 2017. 389(10073): 1025-1034.
- Kim BK, et al: Una nuova strategia per l’interruzione della duplice terapia antipiastrinica: lo studio RESET (REal Safety and Efficacy of 3-month dual antiplatelet Therapy followin Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol, 2012. 60(15): 1340-1348.
- Feres F, et al: Tre vs dodici mesi di doppia terapia antiaggregante dopo gli stent a rilascio di zotarolimus: lo studio randomizzato OPTIMIZE. JAMA, 2013. 310(23): 2510-2522.
- Urban P, et al: Stent coronarici rivestiti con farmaci senza polimeri in pazienti ad alto rischio di sanguinamento. N Engl J Med, 2015. 373(21): 2038-47.
- Valgimigli M, et al: Stent a rilascio di zotarolimus rispetto a stent di metallo nudo in candidati incerti a stent a rilascio di farmaco. J Am Coll Cardiol, 2015. 65(8): 805-815.
- Bonaca MP, Braunwald E, Sabatine MS: Uso a lungo termine di Ticagrelor nei pazienti con infarto miocardico precedente. N Engl J Med, 2015. 373(13): 1274-1275.
- Dewilde WJ, et al: Uso di clopidogrel con o senza aspirina nei pazienti che assumono una terapia anticoagulante orale e si sottopongono a un intervento coronarico percutaneo: uno studio controllato, randomizzato e in aperto. Lancet, 2013. 381(9872): 1107-1115.
- Sarafoff N, et al: Tripla terapia con aspirina, prasugrel e antagonisti della vitamina K nei pazienti con impianto di stent a rilascio di farmaco e indicazione all’anticoagulazione orale. J Am Coll Cardiol, 2013. 61(20): 2060-2066.
- Roldan V, et al: Il punteggio HAS-BLED ha un’accuratezza predittiva migliore per i sanguinamenti maggiori rispetto ai punteggi CHADS2 o CHA2DS2-VASc nei pazienti anticoagulati con fibrillazione atriale. J Am Coll Cardiol, 2013. 62(23): 2199-2204.
- Gibson, C.M, et al: Prevenzione del sanguinamento nei pazienti con fibrillazione atriale sottoposti a PCI. N Engl J Med, 2016. 375(25): 2423-2434.
- Fiedler KA, et al: Durata della tripla terapia nei pazienti che richiedono l’anticoagulazione orale dopo l’impianto di uno stent a rilascio di farmaco: lo studio ISAR-TRIPLE. J Am Coll Cardiol, 2015. 65(16): 1619-1629.
- Lamberts M, et al: Terapia antiaggregante per la malattia coronarica stabile nei pazienti con fibrillazione atriale che assumono un anticoagulante orale: uno studio di coorte a livello nazionale. Circolazione, 2014, 129(15): 1577-1585.
- Valgimigli M, et al: Aggiornamento focalizzato ESC 2017 sulla doppia terapia antipiastrinica nella malattia coronarica, sviluppato in collaborazione con EACTS. European Heart Journal, 2018; 39: 213-254.
CARDIOVASC 2019; 18(4): 16-18