In un clima soleggiato di inizio primavera, è stato difficile rimanere nelle aule senza luce del 25° Corso di Formazione Continua per Medici in Oncologia Clinica a San Gallo, ma ne è valsa la pena. Il PD Dr. med. Markus Jörger, Oncologia ed Ematologia, San Gallo, ha fornito informazioni complete sulle interazioni farmacologiche nelle terapie oncologiche nella sua conferenza.
La definizione di interazioni avverse tra farmaci (AMI) è la seguente: “Un cambiamento misurabile nell’effetto specifico del farmaco (in termini di grandezza o durata) dovuto alla somministrazione precedente o concomitante di un altro farmaco”. In pratica, però, l’AMI può essere causata non solo dai farmaci, ma anche da alimenti, sostanze vegetali, sostanze nocive come l’alcol e il fumo e altre sostanze chimiche. Il rischio di IMA aumenta con il numero di farmaci somministrati, l’uso di farmaci con un range terapeutico ristretto, l’aumento della compromissione delle funzioni degli organi (fegato, reni) e le comorbidità. Inoltre, le persone con sensibilità particolari (sovrappeso, cachessia, età avanzata) sono più colpite dall’IMA.
Farmaceutica, cinetica e dinamica
Fondamentalmente, l’AMI può essere suddiviso in tre forme:
- Le interazioni farmaceutiche sono dovute alle proprietà chimiche dei principi attivi. Ad esempio, la dipendenza dal pH dell’assorbimento gastrico di un farmaco è clinicamente significativa.
- Nelle interazioni farmacocinetiche, un farmaco influenza l’assorbimento, la distribuzione, il metabolismo o l’eliminazione (ADME) di un altro farmaco. Le variazioni delle concentrazioni plasmatiche hanno un effetto sull’attività o sulla tossicità di un altro principio attivo, per cui potrebbe essere necessaria una riduzione o un aumento della dose. Gli enzimi CYP-P450 epatici e l’eliminazione renale dei farmaci sono importanti.
- Nelle interazioni farmacodinamiche, un farmaco altera l’efficacia di un secondo farmaco senza abbassare o aumentare la concentrazione plasmatica. Queste interazioni possono essere utilizzate anche a livello terapeutico: Esempi tipici sono la combinazione di diversi antipertensivi, la somministrazione di antagonisti nei casi di intossicazione o la combinazione di citostatici in oncologia.
Attenzione al cibo
Gli IMA si verificano frequentemente: Secondo le stime, il 7% di tutte le reazioni avverse ai farmaci (ADR) nei pazienti ospedalizzati e il 30% di tutte le ADR fatali sono dovute all’IMA. Più farmaci assume un paziente, più alto è il rischio.
Fondamentalmente, la maggior parte degli AMI è evitabile se si è consapevoli del rischio e delle situazioni di rischio particolari (Tab. 1). I farmaci ad alto rischio comprendono non solo i gruppi di sostanze ben noti (farmaci oncologici, FANS, anticoagulanti, ecc.), ma anche preparati a base di erbe come l’echinacea e l’erba di San Giovanni. Quest’ultimo è un forte induttore del CYP e può quindi ridurre l’efficacia di altri farmaci. I due effetti più significativi dell’erba di San Giovanni riguardano gli effetti della ciclosporina (crisi di rigetto dei trapianti d’organo) e dei contraccettivi (sanguinamento intermittente e gravidanze indesiderate). La soia contiene flavonoidi con effetti pro-estrogenici, per cui le pazienti con cancro al seno e trattamento con tamoxifene devono essere caute nell’assumere prodotti di soia.
Soprattutto con i farmaci oncologici orali, anche le interazioni farmaco-cibo possono giocare un ruolo importante. Un pasto ricco di grassi aumenta l’assorbimento degli inibitori della tirosin-chinasi (TKI) e quindi il rischio di effetti collaterali. Il digiuno è quindi consigliato per la maggior parte dei TKI, anche se ci sono delle eccezioni come l’imatinib o il dasatinib. “Per evitare il più possibile l’IMA, bisogna informare i pazienti quando devono assumere i farmaci”, ha sottolineato il dottor Jörger. “A San Gallo, le infermiere, che distribuiscono anche i farmaci, hanno le schede corrispondenti, in modo da poter trasmettere le informazioni in dettaglio ai pazienti. Anche i succhi di frutta (succo di mela, succo di pompelmo, succo d’arancia, ecc.) possono essere problematici: Rallentano l’escrezione e quindi aumentano il rischio di IMA e di complicanze come il prolungamento del QT, le aritmie o la mielosoppressione.
Nella seconda parte della sua presentazione, il dottor Jörger ha presentato vari casi di AMI.

Capezitabina e Marcoumar
Una paziente di 66 anni con carcinoma mammario metastatico riceveva Marcoumar dal gennaio 2007 a causa di embolie polmonari bilaterali. Da gennaio 2008, il paziente è stato trattato con Capezitabina (Xeloda®). A novembre, il paziente ha sviluppato un ematoma subdurale cronico. La ragione di ciò è stata trovata rapidamente: Capezitabina è un forte inibitore del CYP2C9 e quindi impedisce la degradazione di Marcoumar. Il dottor Jörger ha affermato che i pazienti in trattamento con Xeloda® dovrebbero passare da Marcoumar a un’eparina a basso peso molecolare (LMWH) per evitare complicazioni emorragiche.
Erlotinib e simvastatina
Una paziente di 75 anni con adenocarcinoma del polmone è stata trattata con erlotinib (Tarceva®) come terapia di seconda linea. Dopo sei settimane, è stata ricoverata in ospedale come caso di emergenza con dolori muscolari e astenia, e le è stata diagnosticata una rabdomiolisi acuta. A causa delle corrispondenti comorbidità, la paziente aveva assunto aspirina, atenololo, amlodipina e simvastatina per anni senza complicazioni. L’inibizione del CYP3A4 da parte di erlotinib ha aumentato la concentrazione plasmatica di simvastatina, provocando rabdomiolisi. L’interruzione della simvastatina dopo la fase di recupero ha permesso di proseguire senza problemi il trattamento con erlotinib.
L’EGFR TKI orale erlotinib interagisce con un’ampia gamma di sostanze. A causa dell’induzione del CYP3A4, esiste il rischio di un’efficacia ridotta in caso di combinazione con agenti come la fenitoina, l’erba di San Giovanni, il desametasone, ecc. Questo problema esiste anche nei fumatori, che presentano livelli plasmatici significativamente più bassi rispetto ai non fumatori alla dose standard di 150 mg/d. D’altra parte, esiste il rischio di un aumento della tossicità quando erlotinib viene combinato con azoli, succo di pompelmo, macrolidi, antagonisti del Ca, nelfinavir, ecc. L’assunzione contemporanea di erlotinib e di inibitori della pompa protonica (PPI) deve essere evitata se possibile, oppure l’assunzione deve essere programmata separatamente (erlotinib al mattino, PPI alla sera).
Sunitinib e carbamazepina
In un paziente di 76 anni con carcinoma a cellule renali metastatico, trattato con carbamazepina e fenitonina, era in discussione la terapia con sunitinib (Sutent®). Sunitinib è un substrato del CYP3A4, mentre carbamazepina e fenitoina sono forti induttori del CYP3A4. In questa situazione, si raccomanda il passaggio a un farmaco antiepilettico non enzimatico (non EIAED) da parte del neurologo (Tab. 2) . Se la combinazione di sunitinib e un EIAED è inevitabile, si dovrebbe almeno prendere in considerazione un aumento graduale della dose di sunitinib, se ben tollerato, per evitare la perdita di efficacia.
Capecitabina e diclofenac
Un paziente di 62 anni con cancro rettale ha ricevuto una chemioterapia adiuvante con capecitabina (Xeloda®). Dopo cinque mesi, è stato ricoverato d’urgenza con febbre neutrogena, diarrea, eruzione cutanea ed eritema sui palmi delle mani e sulle piante dei piedi. È stata fatta una diagnosi di sindrome mano-piede e disfunzione renale subacuta. Il paziente aveva assunto dosi elevate di diclofenac a causa di una lombalgia acuta.
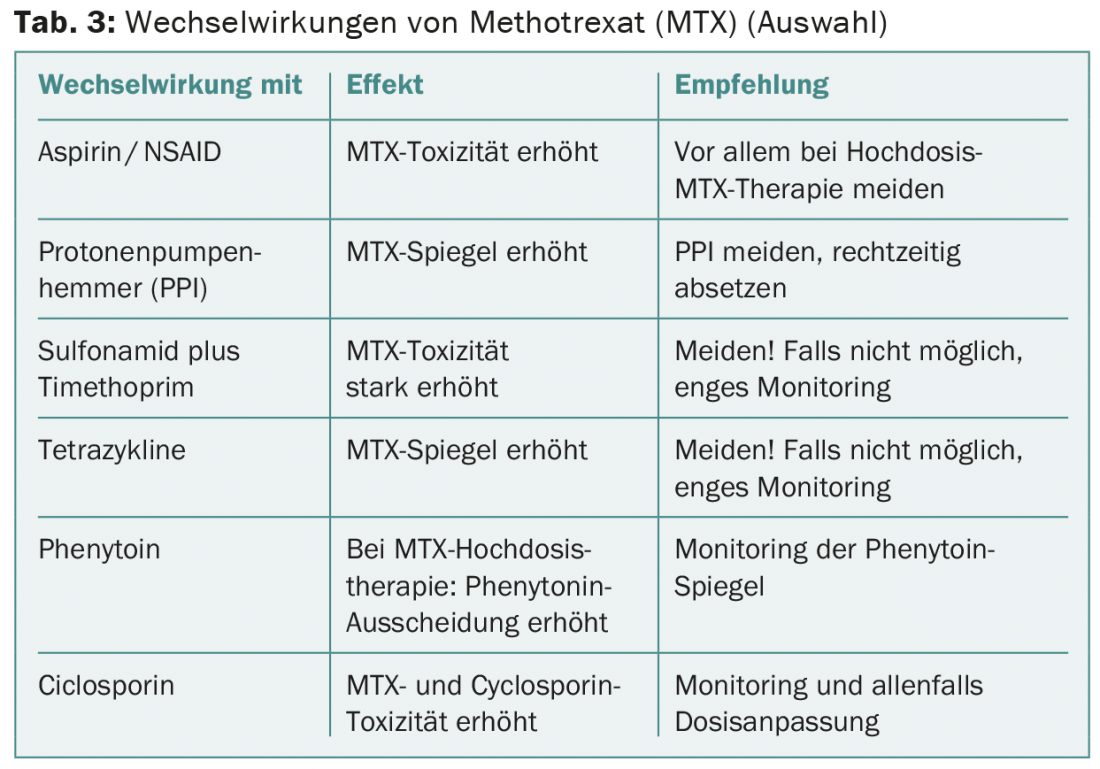
AMI con metotrexato
Il metotrexato (MTX) interagisce con molti altri farmaci (tab. 3). Un paziente di 65 anni con carcinoma laringeo è stato trattato con MTX 60 mg i.v. dopo una recidiva locale. Una settimana dopo, ha sofferto di una grave stomatite, di un esantema ulceroso e di una grave neutropenia. Inoltre, c’è stata una polmonite, a causa della quale il paziente alla fine è morto. Aveva assunto mefenazide in modo intermittente, che in questo caso aveva probabilmente portato a una disfunzione renale subacuta e a un grave ritardo nell’eliminazione renale del MTX.
AMI con imatinib
Un paziente di 75 anni con leucemia mieloide cronica (CML) ha iniziato la terapia con imatinib (Gleevec®). Un anno dopo, è stato ricoverato d’urgenza con dolore addominale superiore, ittero ed enzimi epatici gravemente elevati. È stata fatta una diagnosi di epatite lobulare subacuta, molto probabilmente tossico-medicinale. Due mesi prima, il paziente aveva iniziato a prendere un preparato a base di ginseng. Tuttavia, il ginseng è un inibitore del sistema CYP3A4 e inibisce anche la degradazione dell’imatinib, che ha portato ad un aumento dei livelli plasmatici di imatinib e ad una grave tossicità in questo paziente. Dopo la sospensione del farmaco, gli enzimi epatici si sono normalizzati nel giro di tre settimane e l’imatinib ha potuto essere reintrodotto senza problemi.
Anche la combinazione di imatinib e simvastatina è problematica. Prima di iniziare la terapia con imatinib, si raccomanda quindi di passare dalla simvastatina alla pravastatina.
Inoltre, occorre prestare attenzione quando si somministrano contemporaneamente paracetamolo e imatinib, poiché con questa combinazione può verificarsi anche una tossicità epatica. La dose massima giornaliera corrispondente di paracetamolo è di circa 1300 mg e non deve essere superata, se possibile.
Conclusione per la pratica
- Gli IMA sono comuni e clinicamente significativi.
- Molti AMI possono essere evitati.
- Evitare il più possibile la politerapia: Esamini attentamente l’elenco dei farmaci e valuti se qualcosa può essere omesso o modificato.
- La conoscenza dei farmaci e degli integratori comici specifici è importante.
- Supporto per la compliance ai farmaci.
- Chiedere ai pazienti di dire se stanno assumendo prodotti aggiuntivi (farmaci OTC, rimedi erboristici o alternativi).
Fonte: 25° Corso di formazione continua per medici Oncologia clinica, San Gallo, 19-21 febbraio 2015.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(3-4), 30-32