Grazie alla sua speciale funzione protettiva per il corpo, la pelle rappresenta un’eccezione nel processo di invecchiamento: Come confine meccanico e biologico tra gli organi interni e l’ambiente, la pelle è inoltre esposta quotidianamente a una moltitudine di influenze esogene che non agiscono solo una volta e direttamente (lesione), ma anche ripetutamente e con grande latenza. Pertanto, si distingue tra invecchiamento intrinseco ed estrinseco della pelle.
L’invecchiamento intrinseco è spesso definito anche come invecchiamento cronologico o genetico, l’invecchiamento estrinseco come invecchiamento esogeno o prematuro e, se la luce ultravioletta è l’agente nocivo esogeno, anche come invecchiamento luminoso. Dal punto di vista morfologico, l’invecchiamento cutaneo intrinseco non può essere sempre nettamente separato dall’invecchiamento estrinseco. Entrambi i processi procedono in parallelo e l’invecchiamento estrinseco della pelle può prevalere su quello intrinseco in misura variabile in diverse parti del corpo.
Poiché i meccanismi alla base dell’invecchiamento intrinseco ed estrinseco sono simili e le caratteristiche biochimiche, morfologiche e cliniche dell’invecchiamento cutaneo possono essere derivate direttamente dai pato-meccanismi, verranno prima presentati alcuni aspetti specifici. Alcuni fattori estrinseci sono evidenziati separatamente.
L’importanza delle specie reattive dell’ossigeno [1, 2].
Le specie reattive dell’ossigeno (ROS) svolgono un ruolo centrale nell’invecchiamento della pelle. Secondo la teoria dei radicali liberi dell’invecchiamento formulata da Harman [1], la formazione di tali molecole avviene continuamente nel corso della vita. Questo accade soprattutto nei tessuti con un elevato ricambio di ossigeno, come il cervello, i muscoli e il fegato.
A livello cellulare, i mitocondri sono il sito con il più alto turnover di ROS. Nel corso della produzione di energia da parte della catena respiratoria, l’H2O2 viene prodotto nella membrana mitocondriale interna. Questo viene prodotto anche durante l’invecchiamento alla luce, dove viene generato dagli anioni superossido dalle superossido dismutasi. Un gran numero di studi ha dimostrato che nel contesto dell’invecchiamento estrinseco, H2O2 e ossigeno singoletto sono i ROS più importanti indotti dalla luce UVA. I radicali idrossili, invece, si formano nella reazione fisiologica di Fenton insieme all’H2O2 e sono i radicali di ossigeno più importanti nell’invecchiamento cutaneo estrinseco nel contesto dell’esposizione ai raggi UVB.
I ROS sono quindi centrali nell’invecchiamento cutaneo sia intrinseco che estrinseco.
Nel corso dell’evoluzione, l’organismo ha sviluppato diversi meccanismi di difesa contro i ROS. Questi includono la catalasi, il citocromo p450, il glutatione, ecc. Se la capacità dei sistemi dell’organismo di neutralizzare i ROS viene superata, le molecole altamente reattive possono reagire con vari componenti della cellula e danneggiarli. Ad esempio, le macromolecole cellulari come il DNA, le proteine e le lipoproteine possono essere danneggiate direttamente. Il sovraccarico dei meccanismi di difesa dell’organismo attraverso la formazione continua di ROS porta a mutazioni genetiche e prolunga l’invecchiamento della pelle.
Sulla base della teoria dei radicali liberi dell’invecchiamento, oggi si sta cercando di limitare o addirittura prevenire la formazione di ROS a livello sistemico attraverso integratori alimentari e a livello topico con l’applicazione di prodotti contenenti antiossidanti naturali e sintetici. Purtroppo, è stato dimostrato che gli esperimenti di Harman non possono essere replicati completamente e che, a seconda dell’impostazione sperimentale nei vermi e nei topi, una maggiore presenza di ROS può persino portare a un prolungamento della durata della vita [3]. Si ipotizza che i ROS avviino una rete di riparazione cellulare. Oggi si presume addirittura che l’assunzione di dosi elevate di antiossidanti sotto forma di vitamine e altri integratori alimentari possa non avere alcun effetto o addirittura causare danni.
Mutazione del DNA mitocondriale [4, 5]
Il compito principale dei mitocondri è quello di fornire energia sotto forma di ATP. Questo avviene attraverso la catena respiratoria, che si svolge nella membrana mitocondriale interna. Questo processo non è sempre privo di errori. Gli errori nella catena respiratoria possono portare alla formazione di ROS, motivo per cui il mitocondrio è il sito con il più alto turnover di ROS nella cellula.
I mitocondri contengono il proprio materiale genetico (mtDNA). Il mtDNA si trova nelle immediate vicinanze della catena respiratoria e quindi in prossimità delle influenze dannose dei ROS che vengono prodotti. È stato dimostrato che le mutazioni del mtDNA si accumulano nel normale processo di invecchiamento e la funzione della catena respiratoria diminuisce in modo inversamente proporzionale, portando a una diminuzione della fornitura di energia (teoria mitocondriale dell’invecchiamento). Inoltre, si potrebbe dimostrare che oltre all’invecchiamento intrinseco di cui sopra, le mutazioni del mtDNA svolgono un ruolo nell’invecchiamento estrinseco della pelle (teoria mitocondriale dell’invecchiamento luminoso). La pelle esposta ripetutamente ai raggi UV ha mostrato un’induzione di mutazioni del mtDNA che portano a disturbi funzionali dei mitocondri (consumo di ossigeno, potenziale di membrana del mt, metabolismo energetico).
Metalloproteinasi di matrice [6, 7].
Le marixmetalloproteinasi (MMP) rappresentano una famiglia di enzimi la cui funzione è quella di degradare proteicamente le proteine della matrice dermica. Il substrato principale delle MMP sono le proteine strutturali del derma, come i collageni e la gelatina. La funzione delle MMP è importante nel contesto del rimodellamento dei tessuti che si verifica in vari processi biologici, come la morfogenesi, la guarigione delle ferite, l’angiogenesi o la crescita tumorale. Inoltre, le MMP hanno altre funzioni nell’elaborazione di molecole di segnalazione che controllano il comportamento delle cellule. Fisiologicamente, esistono inibitori delle metalloproteinasi di matrice (TIMP) specifici per il tessuto per le MMP. Riducono l’attività delle MMP e quindi frenano, ad esempio, l’eccessiva degradazione delle proteine. L’interazione tra le MMP e il TIMP non è ancora del tutto chiara.
Un’ampia mole di lavoro suggerisce che le MMP svolgono un ruolo importante nell’invecchiamento cutaneo estrinseco. Le MMP sono indotte direttamente e indirettamente dalla luce ultravioletta. La degradazione delle proteine della matrice dermica indotta in questo modo porta a un cambiamento della matrice extracellulare che contribuisce ai cambiamenti clinicamente e istologicamente visibili caratteristici della pelle fotoinvecchiata.
Gli studi indicano che i retinoidi hanno un effetto inibitorio sull’espressione delle MMP. L’accumulo di nuovo collagene non frazionato può quindi portare a un miglioramento significativo dell’aspetto della pelle.
Attivazione dei fattori di trascrizione [8, 9].
L’attivazione dei fattori di trascrizione da parte della luce UV porta all’induzione delle MMP. L’esposizione ai raggi UV della pelle umana porta non solo all’induzione diretta delle MMP, ma anche all’induzione dei fattori di trascrizione AP-1 e NF-κB. Questi fattori sono attivatori dei geni MMP. Questo percorso di attivazione indiretta delle MMP nella pelle invecchiata estrinsecamente esiste in aggiunta all’induzione diretta delle MMP da parte dei ROS.
I risultati degli esperimenti di laboratorio e sugli animali indicano che l’induzione dei fattori di trascrizione può essere inibita con estratti di piante (magnololo).
“Prodotti finali di glicazione avanzata” [10, 11].
I “prodotti finali di glicazione avanzata” (AGE) si formano in una reazione di Maillard attraverso la glicazione e l’ossidazione di varie proteine strutturali. In questo processo, le proteine (gruppi amminici liberi) o i lipidi reagiscono in modo non enzimatico con i carboidrati. Gli AGE sono coinvolti in diverse malattie legate all’età. La glicazione è coinvolta nell’invecchiamento cutaneo sia intrinseco che estrinseco (esposizione ai raggi UV) e altera i processi di crescita e differenziazione e le attività enzimatiche (MMP) nella matrice extracellulare della pelle. L’aumento del contenuto di AGE nella pelle modifica le proprietà meccaniche. Sono caratterizzate da una ridotta elasticità e da una maggiore rigidità.
I risultati dei test di laboratorio indicano che la formazione di AGE può essere inibita con estratti di piante (pompelmo rosso).
Vitamina D [12–15]
La vitamina D è una vitamina liposolubile che si forma principalmente nella pelle umana sotto la luce del sole (soprattutto UV-B). Tra le altre cose, regola l’assorbimento di calcio e fosfato dall’intestino e la loro incorporazione nelle ossa. La diminuzione dello spessore della pelle legata all’età comporta una riduzione significativa della sintesi di vitamina D nella pelle. Inoltre, nelle persone più anziane e meno mobili, una ridotta esposizione al sole ha un impatto negativo sullo stato della vitamina D.
L’importanza della vitamina D ha ricevuto molta attenzione negli ultimi anni ed è attualmente oggetto di un vivace dibattito. La revisione sistematica di Philippe Autier [15] del 6.12.13 mostra chiaramente che le opinioni che circolano frequentemente sulla vitamina D devono essere differenziate. Molti studi prospettici hanno dimostrato un’associazione tra basse concentrazioni di 25(OH) vitamina D e una serie di malattie acute e croniche. Tuttavia, un numero altrettanto elevato di studi randomizzati non ha potuto fornire prove che l’aumento della concentrazione di vitamina D prevenga l’insorgenza.
Senescenza immunitaria [16]
Anche nelle persone apparentemente sane, il sistema immunitario invecchiando subisce cambiamenti profondi e talvolta irreversibili che portano a una progressiva riduzione della funzione immunitaria – alla senescenza immunitaria. Questo colpisce tutti gli organi e le cellule del sistema immunitario innato e acquisito, comprese le cellule staminali ematopoietiche (HSC), le cellule progenitrici linfoidi (CLP) nel midollo osseo e nel timo, i linfociti T e B maturi negli organi linfoidi secondari, nonché i fagociti e le cellule presentanti l’antigene (APC) del sistema immunitario innato. A livello dell’organismo nel suo complesso, questi cambiamenti associati all’età portano principalmente a una maggiore tendenza alle infezioni e a una risposta ridotta alle vaccinazioni. Anche le malattie tumorali e autoimmuni sono più frequenti. Molti di essi riguardano il settore dermatologico, come i carcinomi epiteliali, il melanoma maligno, i linfomi cutanei, le collagenosi, le dermatosi bollose, l’herpes zoster, i disturbi della guarigione delle ferite e altri.
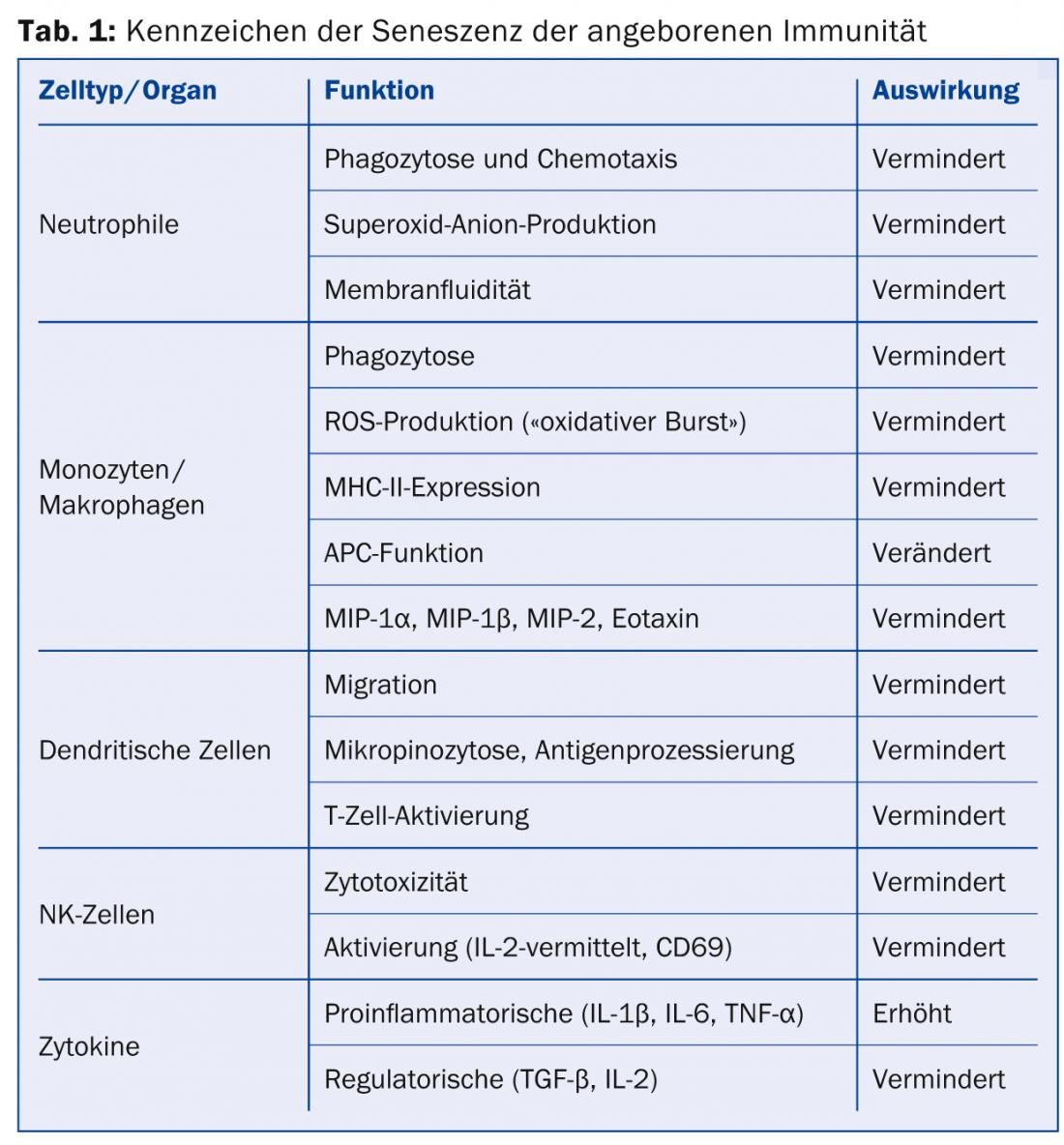
Invecchiamento dell’immunità innata: le cellule del sistema immunitario innato sono in prima linea nella difesa dagli agenti patogeni. Queste includono in particolare le cellule fagocitanti e/o presentanti l’antigene, come i neutrofili, i macrofagi e le cellule dendritiche (DC), ma anche quelle al limite dell’immunità acquisita, come le cellule NK. Alcuni dei cambiamenti legati all’età del sistema immunitario innato sono riassunti nella tabella 1 .
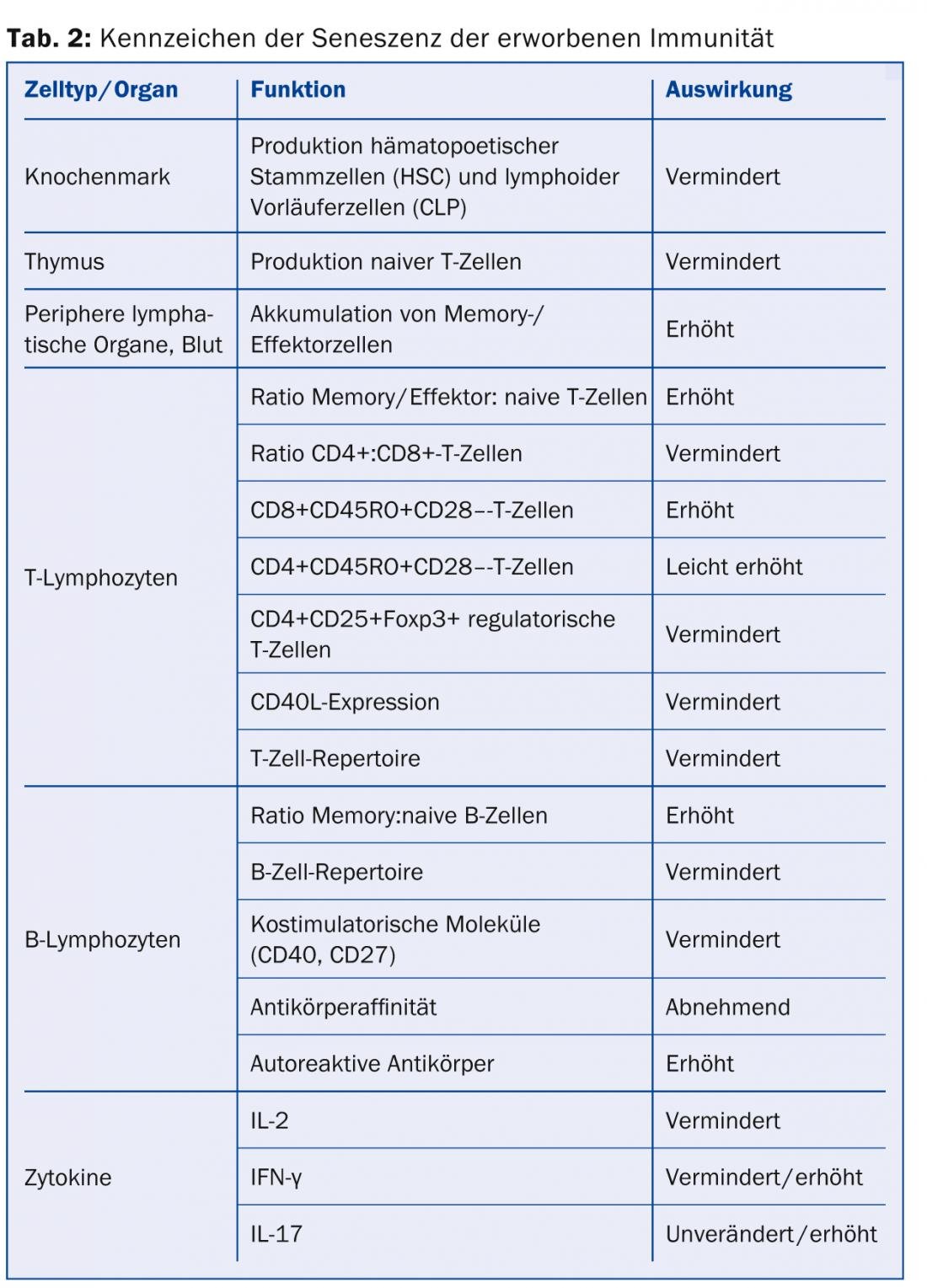
Invecchiamento dell’immunità acquisita: a differenza dell’immunità innata, l’immunità acquisita è in grado di dare risposte immunitarie antigene-specifiche, principalmente attraverso le cellule T e B. Anche questi sono soggetti a cambiamenti legati all’età, che, come nel caso dell’immunità innata, portano a un’efficacia ridotta (o mal indirizzata) contro gli agenti patogeni. Inoltre, però, l’immunità acquisita porta anche a una ridotta variabilità e quindi a una ridotta adattabilità agli antigeni (Tabella 2).
Cambiamenti ambientali nella pelle
Oggi, i cambiamenti ambientali della pelle sono causati principalmente dal fumo e dalle radiazioni ultraviolette (UV-S).
Fumo [17, 18]: La compromissione dei processi fisiologici della pelle da parte del fumo è ben studiata. Il fumo in genere compromette la circolazione sanguigna dei tessuti, compresa quella della pelle. La pelle dei fumatori è spesso pallida e grigiastra, è anche più secca e flaccida e si raggrinzisce prima e in modo più grave. I fenomeni sono stati documentati in modo impressionante in alcuni lavori su gemelli identici. Questi fenomeni appaiono prima e in modo più evidente nelle donne rispetto agli uomini. Diversi processi fisiologici della pelle sono responsabili della maggiore formazione di rughe nei fumatori, che sono compromessi dai numerosi radicali liberi presenti nel fumo di tabacco. Ad esempio, il fumo di tabacco inibisce la formazione di nuove fibre di collagene nel derma e, allo stesso tempo, favorisce la rottura delle fibre di collagene ed elastina. Il sistema finemente sintonizzato di costruzione e rottura delle fibre viene così sbilanciato. L’esposizione ai raggi UV compromette ulteriormente questi processi. Inoltre, la nicotina del fumo di tabacco restringe i vasi sanguigni, per cui anche la pelle non riceve una quantità sufficiente di sangue, e il monossido di carbonio riduce il trasporto di ossigeno attraverso gli eritrociti.
Esposizione ai raggi UV [19–22]: anche la compromissione dei processi fisiologici della pelle, soprattutto attraverso un’ampia esposizione ai raggi UV, è ben studiata (Fig. 1).

Questo è stato illustrato in modo particolarmente impressionante l’anno scorso in un articolo di Jennifer Gordon sul New England Journal of Medicine [20]. La presentazione clinica mostra un camionista di 69 anni, la cui pelle facciale sinistra si è ispessita e raggrinzita in modo asintomatico nel corso di 25 anni di lavoro, mostrando i segni tipici del danno cutaneo associato ai raggi UV-A. Ad oggi, si sa poco sull’invecchiamento epidermico da luce e i processi molecolari che portano ai disturbi pigmentari – tipici della pelle danneggiata dalla luce – non sono ancora adeguatamente compresi. L’invecchiamento da luce dermica è molto meglio studiato. A causa dell’aumento dell’attività della metalloproteinasi di matrice, della collagenasi, della 92-kd-gelatinasi e della stromelisina, il collagene viene sempre più degradato con l’età. Anche quantità piccole o intermittenti di luce UV attivano la metalloproteinasi di matrice e portano alla degradazione del collagene e all’inibizione della sintesi di collagene. Qui entra in gioco anche il trattamento con acido retinoico, per bloccare l’attivazione della metalloproteinasi di matrice indotta dai raggi UV. Processi simili sono descritti anche per l’elastina. L’interazione di questi processi porta alla tipica grinza indotta dalla luce.
Nel frattempo, c’è anche un lavoro che descrive in modo impressionante l’importanza dell’inquinamento ambientale per l’invecchiamento della pelle. Ma non solo il fumo e gli UV-S sono considerati fattori ambientali. Anche la gravità, l’espressione del viso e la posizione in cui si dorme sono fattori estrinseci che contribuiscono in modo non trascurabile ai cambiamenti visibili della pelle che invecchia: La gravità strattona incessantemente il nostro corpo e i suoi segni diventano particolarmente evidenti dopo i 50 anni. Sono particolarmente colpiti il naso, le orecchie, le palpebre e le labbra. Le rughe nasolabiali, marionette e del collo sono classificate come rughe gravitazionali e si verificano a causa del cedimento della pelle e del tessuto sottocutaneo.
L’espressione facciale provoca la formazione di un numero sempre maggiore di rughe con l’avanzare dell’età. Le rughe mimiche possono svilupparsi molto presto come parte di un’iperattività dei muscoli facciali. In linea di massima, si possono dividere in zampe di gallina, rughe di cipiglio, rughe della fronte e rughe della bocca, delle labbra o del fumatore, nonché rughe del mento o del naso.
Alcune posizioni del sonno provocano le tipiche rughe del sonno, che di solito corrono verticalmente nella zona delle guance e delle tempie.
Si possono osservare grandi differenze etniche nelle rughe legate all’età. In Giappone e in Corea del Sud, ad esempio, le donne rimangono quasi prive di rughe fino ai 50 anni, mentre in Francia le rughe d’espressione diventano visibili dai 20 ai 30 anni. Dopo i 50 anni, tuttavia, la situazione si ribalta nuovamente a favore delle donne europee.
Ingegneria genetica e cura della pelle [23]
Negli ultimi anni, i grandi progressi dell’ingegneria genetica e lo sviluppo dei “chip genetici” ci hanno permesso di conoscere più a fondo gli eventi molecolari dell’invecchiamento cutaneo. Le analisi dell’espressione genica hanno portato all’identificazione delle vie di segnalazione coinvolte nel processo di invecchiamento e questa conoscenza può senza dubbio contribuire allo sviluppo di nuove strategie di prevenzione e terapia.
Tuttavia, le relazioni spesso entusiastiche sull’effetto di nuovi ingredienti (a volte anche noti) sul processo di invecchiamento sono state realizzate in vitro, e il trasferimento alle situazioni “cliniche” di tutti i giorni è ancora in sospeso. Tuttavia, questi candidati principi attivi sono spesso offerti in dosi omeopatiche ricche di parole e colori nei cosiddetti cosmetici altamente efficaci e innovativi. La promozione delle cellule staminali è stata particolarmente impressionante da quando Michelle Obama ha trattato il suo viso con un siero contenente cellule staminali della varietà di mele svizzere di lunga durata “Uttwiler Spätlauber”. In questo modo, il consumatore – supportato da molta celebrità – è portato a credere che con questi prodotti le cellule staminali della pelle vengono nuovamente richiamate al loro compito di rendersi utili e di ringiovanire la pelle.
Conclusione per la pratica
- L’invecchiamento intrinseco è spesso definito come invecchiamento cronologico o genetico, mentre l’invecchiamento estrinseco è spesso definito come invecchiamento esogeno o prematuro.
- Le specie reattive dell’ossigeno (ROS) sono centrali nell’invecchiamento della pelle, sia intrinseco che estrinseco.
- Le mutazioni del DNA mitocondriale si accumulano nel normale processo di invecchiamento. La funzione della catena respiratoria diminuisce in modo inversamente proporzionale a questo, portando a una diminuzione della fornitura di energia (teoria mitocondriale dell’invecchiamento).
- Il fumo, i raggi UV-S, la gravità, l’espressione del viso e la posizione del sonno sono considerati fattori ambientali dell’invecchiamento cutaneo.
Prof. Dr. phil. nat. Christian Surber
Letteratura:
- Harman D: J Gerontol 1956; 11: 298-30000. PMID 13332224.
- Fortmann SP, et al: Ann Intern Med 2013; 159(12): 824-834. doi:10.7326/0003-4819-159-12-201312170-00729.
- Moyer MW: Sci Am 2013 Feb; 308(2): 62-67. PMID: 23367786.
- Berneburg M, et al: Photochem Photobiol Sci 2006; 5: 190-198. PMID: 16465305.
- Kazachkova N, et al: Aging Dis 2013; 4(6): 337-350. PMID: 24307967.
- Griffiths CE, et al: N Engl J Med 1993; 329(8): 530-535. PMID: 8336752.
- Hernández-Pérez M, et al: Am J Dermatopathol 2012; 34(6): 565-579. doi: 10.1097/DAD. 0b013e31821e8744.
- Muthusamy V, et al: Arch Dermatol Res 2010; 302(1): 5-17. doi: 10.1007/s00403-009-0994-y.
- Tanaka K, et al: Curr Drug Metab 2010; 11(5): 431-435. PMID: 20540695.
- Crisan M, et al: PLoS One 2013; 8(10): e75003. doi: 10.1371/journal.pone.0075003.
- Jariyapamornkoon et al: BMC Complement and Altern Med 2013; 13: 171. doi: 10.1186/1472-6882-13-171.
- Tang JY, et al: J Am Acad Dermatol 2012; 67(5): 803.e1-12, quiz 815-6. doi: 10.1016/j.jaad.2012.05.044.
- Tang JY, et al: J Am Acad Dermatol 2012; 67: 817.e1-11, quiz 827-8. doi: 10.1016/j.jaad.2012.07.022.
- Reid IR, et al: Lancet 2013 Oct 10. pii: S0140-6736(13)61647-5. doi: 10.1016/S0140-6736(13)61647-5.
- Autier P, et al: Stato della vitamina D e salute: una revisione sistematica. The Lancet Diabetes & Endocrinology, Disponibile online il 6 dicembre 2013. http://dx.doi.org/10.1016/S2213-8587(13)70165-7.
- Peters T: Dermatologo 2011; 62(8): 598-606, doi: 10.1007/s00105-011-2134-9.
- Morita A, et al: J Invest Dermatol Symp Proc 2009; 14: 53-55, doi:10.1038/jidsymp.2009.13.
- Okada HC, et al: Plast Reconstr Surg 2013; 132: 1085-1092, doi: 10.1097/PRS.0b013e3182a4c20a.
- Gilchrest BA: J Invest Dermatol 2013; 133(E1): E2–E6, doi:10.1038/skinbio.2013.176.
- Gordon JRS, et al: N Engl J Med 2012; 366: e25, doi: 10.1056/NEJMicm1104059.
- Valacchi G, et al: Ann NY Acad Sci 2012; 1271: 75-81, doi: 10.1111/j.1749-6632.2012.06724.x.
- Dennerstein L, et al: Menopause Int 2011; 17(3): 96-101. doi: 10.1258/mi.2011.011028.
- Tiesman JP: J Drugs Dermatol 2009; 8(7 Suppl): s12-14. PMID: 19623779.
Pratica dermatologica 2014; 24(1): 4-8











