Il beneficio dello screening del cancro al polmone in gruppi di rischio definiti è stato dimostrato da due grandi studi. Nelle fasi iniziali della malattia, la resezione limitata con linfoadenectomia è il trattamento di scelta.
Il carcinoma bronchiale primario è uno dei tumori maligni più comuni al mondo. In Svizzera, è il secondo tumore maligno più comune negli uomini, con un’incidenza dell’11,9%. Nelle donne, l’incidenza è dell’8,7%, il che lo rende il terzo tumore più comune. Con il 21,9%, il carcinoma bronchiale ha la più alta mortalità associata al tumore negli uomini e, con il 15,4%, la seconda più alta nelle donne dopo il carcinoma mammario [1].
La prognosi a lungo termine dipende dallo stadio clinico della malattia tumorale al momento della diagnosi. Di conseguenza, il tasso di sopravvivenza a 5 anni è dell’80-90% per lo stadio IA1-IA3, del 73% per lo stadio IB, del 65% per IIA, del 56% per IIB, del 41% per IIIA, del 24% per IIIB e del 12% per IIIC. Sulla base di questi dati di sopravvivenza, nello stesso studio sono state pubblicate le raccomandazioni per l’ottava edizione della classificazione TNM per il NSCLC, con le relative modifiche degli stadi clinici [2].
Diagnosi precoce del NSCLC – risultati attuali dei nuovi studi
Il fatto che la prognosi sia relativamente buona in una fase precoce della malattia e che il carcinoma bronchiale sia uno dei principali tumori maligni nelle donne e negli uomini ha portato a diversi studi internazionali sullo screening del carcinoma bronchiale negli ultimi anni.
Lo studio più grande, il “National Lung Screening Trial” (NLST) del Nord America, pubblicato nel 2011, ha randomizzato 53 454 pazienti con un rischio definito. Un gruppo ha ricevuto una tomografia computerizzata a “basso dosaggio” (LDCT) per tre anni consecutivi, mentre l’altro gruppo ha ricevuto solo una radiografia del torace convenzionale. Nel gruppo LDCT, l’endpoint primario di una riduzione del 20% della mortalità per cancro al polmone è stato raggiunto e lo studio è stato interrotto. Non si sa quanto si sarebbe ridotta la mortalità per cancro al polmone se lo studio fosse continuato. La mortalità complessiva è stata ridotta del 6,7%. Il Number Needed to Screen era di 320 pazienti a rischio per prevenire il decesso [3].
Il più grande studio randomizzato in Europa e il secondo al mondo è il Dutch-Belgian Lung Cancer Screening Trial (NELSON), iniziato nel 2003. I dati completi sono attesi per dicembre 2018, ma i contenuti principali sono già stati presentati a settembre 2018 alla “Conferenza mondiale sul cancro al polmone” di Toronto [4,5]. Sono stati inclusi i fumatori attuali o gli ex fumatori con dieci anni o meno di astinenza, con più di 15 sigarette al giorno in 25 anni o più di dieci sigarette al giorno in 30 anni. Lo studio conclude che il 50% dei carcinomi è stato diagnosticato in uno stadio precoce, il 65-70% in uno stadio IA-II. Il 70% dei carcinomi nel gruppo di controllo era di stadio III-IV. La mortalità per tutte le cause è stata ridotta del 26% in un periodo di 10 anni nei pazienti maschi ad alto rischio e fino al 61% nelle donne.
Tra gennaio 2016 e novembre 2018, sono disponibili i dati attuali della Foundation for Lung Diagnostics in questo Paese: Sono stati eseguiti 961 esami. La ripartizione dei gruppi di rischio è riportata nella tabella 1. Tra le persone esaminate, cinque carcinomi bronchiali sono stati diagnosticati di recente, due in stadio IA e una persona ciascuno in stadio IIA, IIIA e IV. 102 persone hanno smesso di fumare.

Dati sulle resezioni limitate (sublobari) per il NSCLC
I risultati degli studi di screening sono notevoli anche per quanto riguarda le opzioni di terapia chirurgica. Lo studio NELSON ha potuto dimostrare che il 65-70% dei carcinomi corrisponde a uno stadio IA-II [4]. Cosa significano questi risultati in termini di terapia chirurgica?
Negli ultimi anni, è stato studiato intensamente se una resezione limitata nel senso di una segmentectomia o di una resezione extra-anatomica (wedge) rappresenti un’alternativa sensata alla classica lobectomia – sia a livello oncologico che generale. L’intenzione di eseguire una segmentectomia è quella di preservare la maggior quantità possibile di tessuto polmonare sano, il che è particolarmente vantaggioso nei pazienti con riserva polmonare limitata.
I dati sulla resezione del segmento sembrano inizialmente controversi. Diversi studi dal 1990 a circa il 2012 mostrano un chiaro vantaggio in termini di sopravvivenza globale e libera da recidiva a favore della lobectomia in tutti gli stadi trattabili chirurgicamente, soprattutto negli stadi I e II [6,7]. Wolf et al. tuttavia, ha dimostrato che nelle segmentectomie con linfadenectomia mediastinica, il tasso di recidiva locale e la sopravvivenza libera da recidiva erano identici. Questo risultato è stato notevole e ha dato origine a studi più dettagliati, incentrati sul rispetto dell’anatomia segmentale e sulla linfoadenectomia sistematica [8]. Lo sviluppo della tecnica chirurgica minimamente invasiva in direzione di una vera resezione anatomica del segmento (non semplicemente una resezione a cuneo) è stato decisivo. Questo rispetta automaticamente il drenaggio linfatico anatomicamente predeterminato e l’asportazione chirurgica radicale, nonostante la resezione limitata e salva-parenchima [9].
Altorki et al. 2014 e Tsutani et al. 2013 ha mostrato tassi di sopravvivenza uguali a dieci anni nello stadio IA e nella sopravvivenza libera da recidiva a 3 anni negli adenocarcinomi. Allo stesso modo, l’indagine retrospettiva di Kodama et al. 2016 (312 pazienti con stadio clinico cT1 N0 M0) nessun aumento del tasso di recidiva locale o differenze nella sopravvivenza globale nel gruppo di resezione segmentale [10–12].
L’influenza positiva sulla funzione polmonare post-operatoria dopo la resezione limitata è stata dimostrata in alcuni studi [13,14].
Importanza della linfoadenectomia mediastinica
Come già accennato, l’influenza di una linfadenectomia mediastinica coerente e sufficiente rispetto alla sopravvivenza libera da recidiva è un aspetto importante. Ludwig et al. e Gulack et al. ha dimostrato che un vantaggio di sopravvivenza è associato a un numero crescente di linfonodi resecati [15,16].
Allo stesso modo, il lavoro di Stiles et al. l’impatto della linfoadenectomia nel NSCLC di stadio IA. È stato dimostrato un chiaro vantaggio in termini di sopravvivenza a lungo termine e di sopravvivenza libera da recidiva per la resezione sublobare con linfoadenectomia rispetto alla resezione sublobare senza linfoadenectomia [17].
Impatto di questo sviluppo nella chirurgia toracica di tutti i giorni
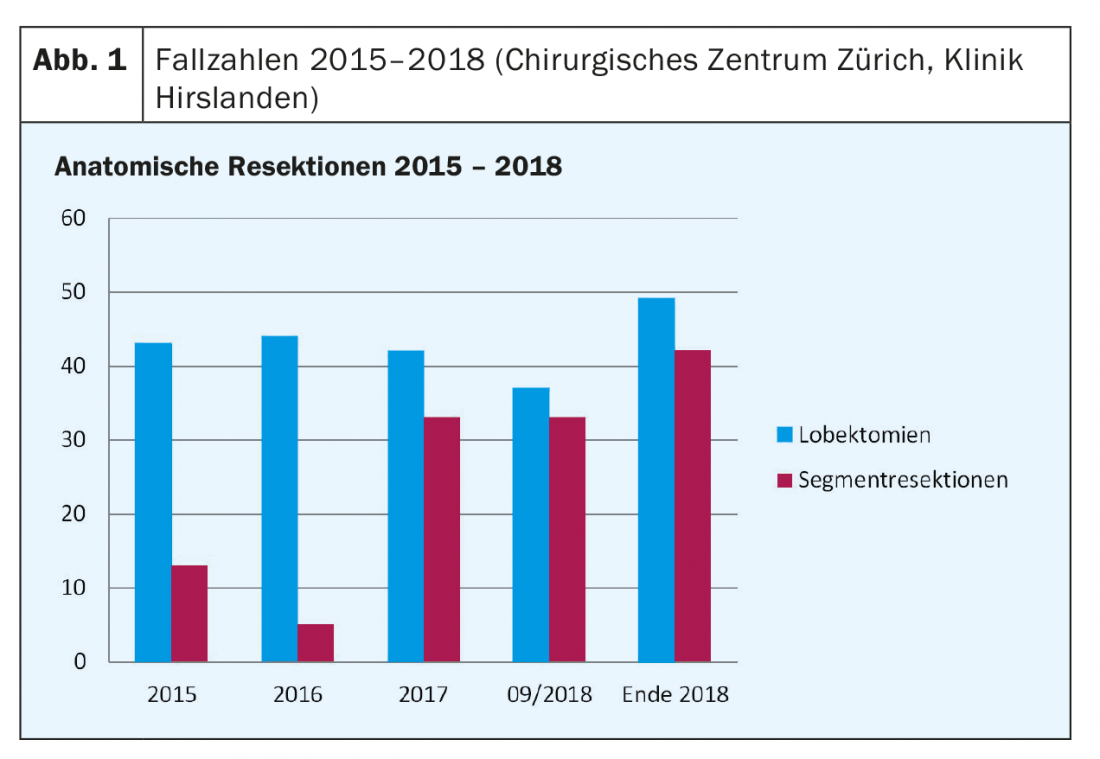
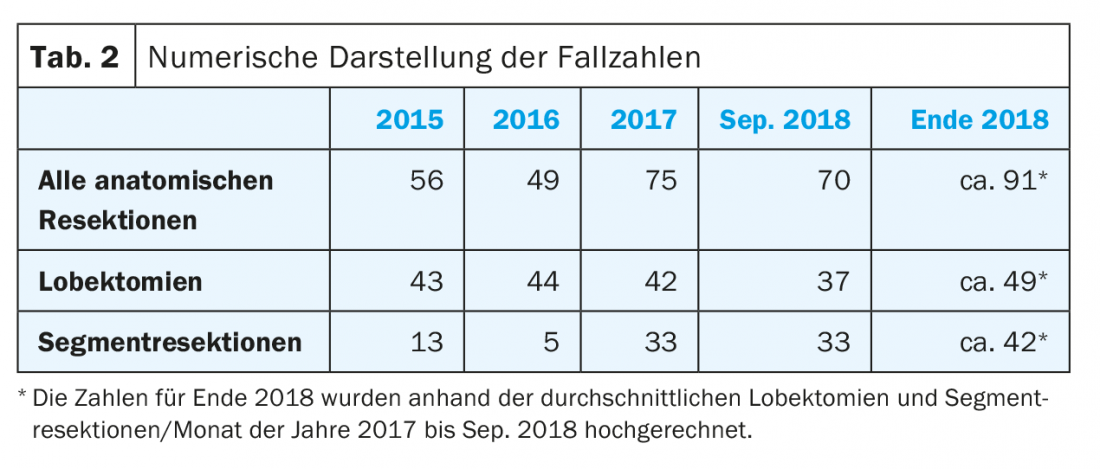
Presso il Centro chirurgico di Zurigo della Clinica Hirslanden stiamo effettivamente assistendo a un aumento costante della percentuale di resezioni di segmenti anatomici. Inoltre, si è registrato un aumento complessivo del numero di tutte le resezioni anatomiche dall’inizio del 2015 (Fig. 1 e Tab. 2).
I risultati dell’ultimo periodo in dettaglio
Tra gennaio 2016 e settembre 2018, nel nostro istituto sono state eseguite 194 resezioni anatomiche, di cui 123 (63%) erano lobectomie. Il numero di resezioni di segmenti anatomici è stato di 71 pazienti (37%), in aumento rispetto ai 13 pazienti (23%) del 2015, e già aumentato a 33 pazienti (44%) nel 2017. Si prevedono circa 42 pazienti (46%) entro la fine del 2018.
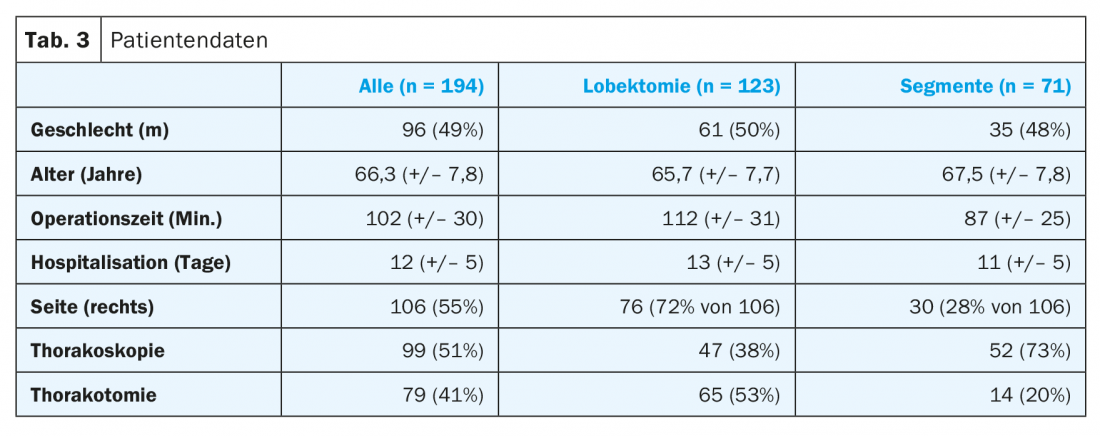
La durata dell’intervento è stata in media di 25 minuti più lunga per le lobectomie con 112 minuti (+/- 31) rispetto alle resezioni segmentali con 87 minuti (+/- 25). A 13 giorni (+/- 5), la durata del ricovero tendeva ad essere di due giorni più lunga per le lobectomie. Oltre il 70% delle operazioni di resezione segmentale sono state eseguite per via toracoscopica, con poco meno della metà delle lobectomie minimamente invasive (Tab. 3).
In quasi tre quarti di tutti i pazienti, la diagnosi postoperatoria è stata di cancro al polmone non a piccole cellule (Fig. 2).
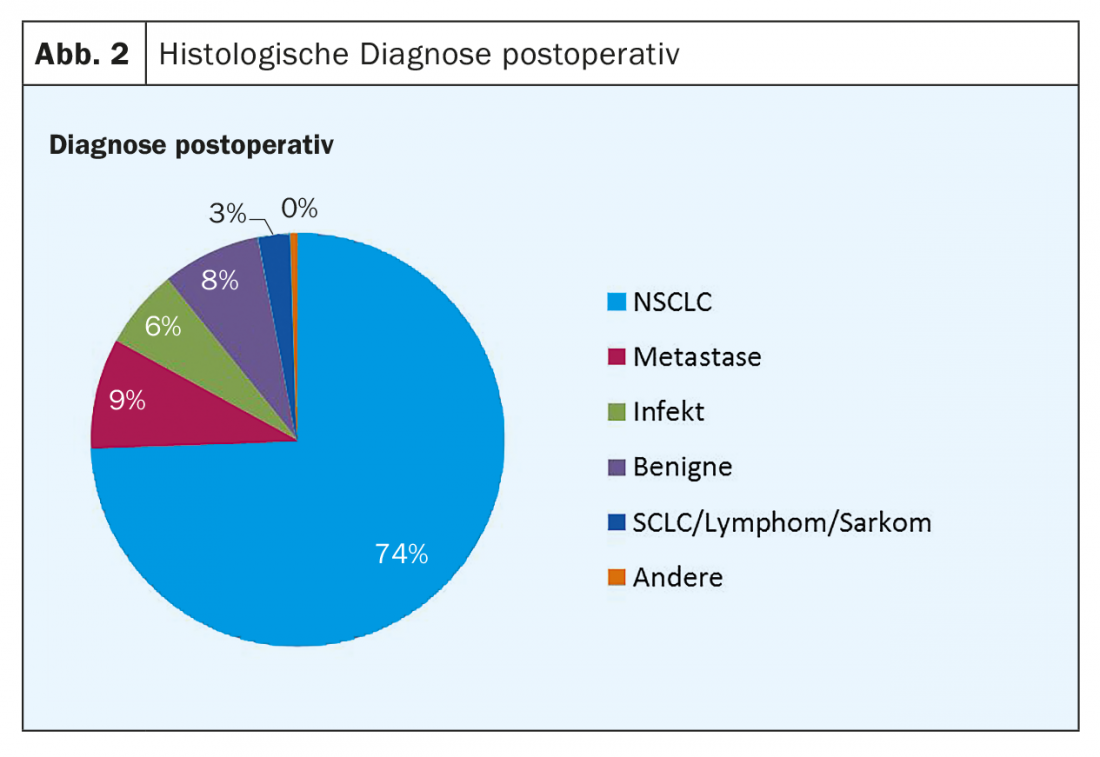
Tra le lobectomie, la proporzione di NSCLC è stata di 94 pazienti (76%), seguiti da reperti benigni o infettivi con il 14% e metastasi con il 6%. Per le resezioni segmentali, la percentuale di NSCLC è stata di 50 pazienti (70%), oltre al 15% di risultati benigni e infettivi e al 14% di metastasi.
Istologicamente, il 66% dei NSCLC era di tipo adenocarcinoma, il 23% carcinoma a cellule squamose, il 7% carcinoide, il 3% carcinoma pleomorfo e l’1% carcinoma a grandi cellule (Fig. 2).
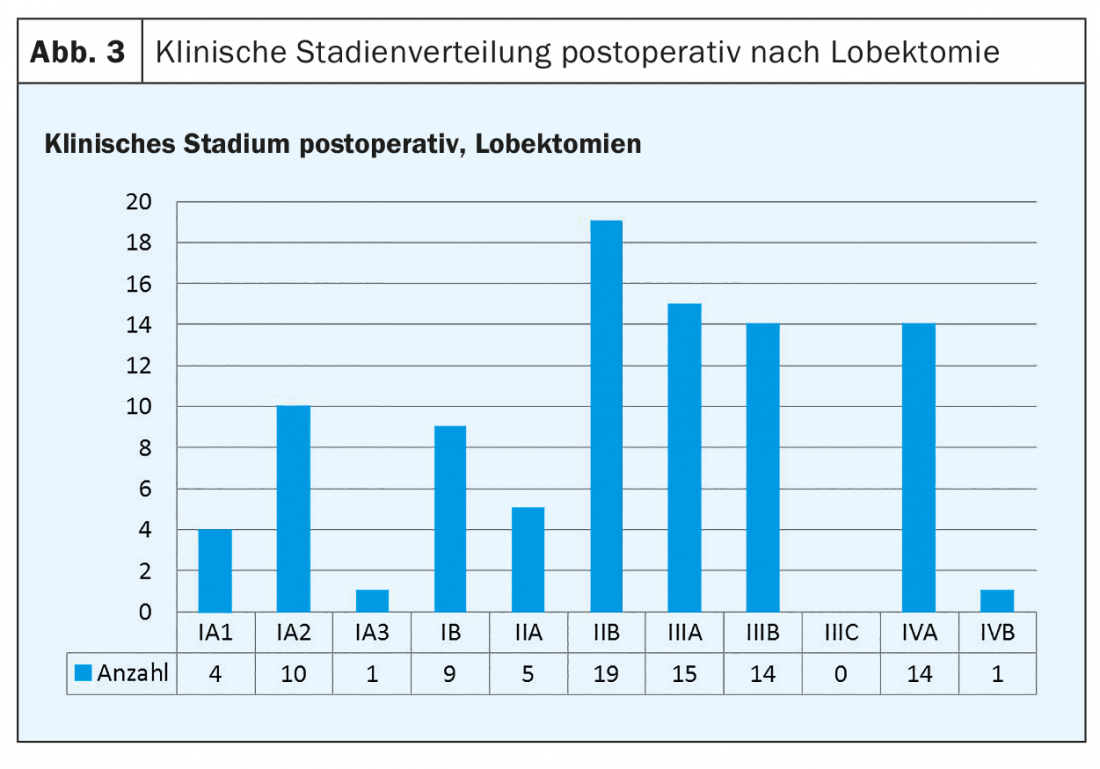
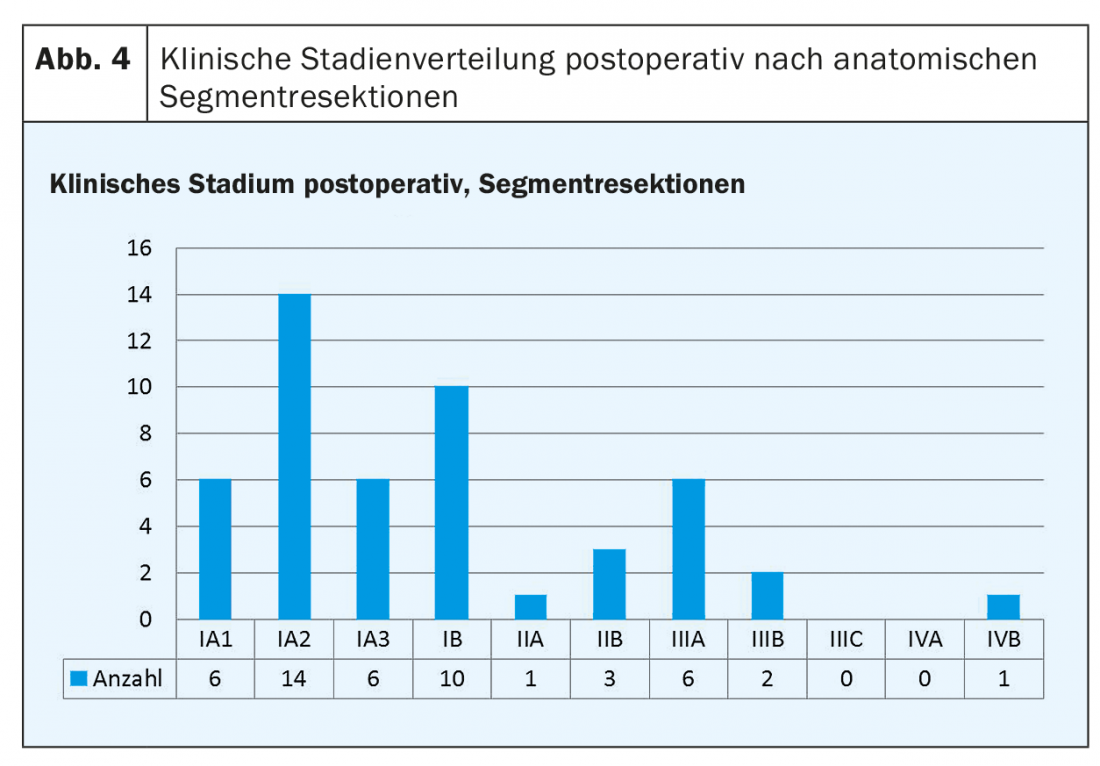
Le figure 3 e 4 mostrano ciascuna la distribuzione degli stadi clinici postoperatori per le lobectomie (Fig. 3) e le resezioni segmentali (Fig. 4).
Morbosità e mortalità
La mortalità a 30 giorni di tutte le resezioni anatomiche (n=194) è stata di tre decessi (1,5%).
La morbilità complessiva è stata del 9,5%, senza alcuna differenza tra i due gruppi. La complicanza più frequente è stata una perdita d’aria persistente (definita >7 giorni), seguita da polmonite, empiema postoperatorio, complicanze cardiache come la fibrillazione atriale ed ematoma/emorragia postoperatoria.
Discussione
La tendenza verso le moderne resezioni oncologiche, sempre più salvapolmoni, è chiaramente riconoscibile nel nostro istituto dal 2015. Questo dimostra che un concetto sempre più personalizzato viene applicato non solo nel trattamento farmacologico dei carcinomi polmonari, ma anche nella chirurgia. Non ci sono stati cambiamenti in termini di morbilità e mortalità. Tuttavia, la percentuale di interventi minimamente invasivi sta aumentando e la durata della degenza ospedaliera tende ad essere più breve.
La corretta esecuzione tecnica di una resezione segmentale (lungo le strutture anatomiche) è di grande importanza per poter procedere alla fine in modo radicale oncologico, nonostante la resezione limitata. Solo allora la sopravvivenza libera da recidiva sarà buona come in passato, quando la lobectomia era il gold standard. È interessante notare che l’80% delle resezioni segmentali che abbiamo eseguito presentava uno stadio post-operatorio I-IIB. I restanti dieci pazienti hanno mostrato una situazione N2 occulta nella maggior parte dei casi. Sono proprio questi “sottotagli”, alcuni dei quali sono già stati rilevati intraoperatoriamente, che animeranno sempre la discussione sulla possibilità di far prevalere la tendenza. Dyas et al. sono riusciti a dimostrare nel 2018, sulla base di uno studio prospettico di 1444 pazienti, che nonostante la tomografia computerizzata del torace, la PET-CT e ulteriori chiarimenti, una situazione N2 occulta era presente nel 10% dei pazienti con NSCLC classificati come stadio I e nel 21% di quelli classificati come stadio II [18]. L’influenza positiva della linfoadenectomia sulla sopravvivenza libera da recidiva è stata dimostrata in diversi studi [15–17]. Sulla base di questi dati, tutti i nostri pazienti con NSCLC vengono sottoposti a linfadenectomia mediastinica radicale. La diagnosi intraoperatoria rapida, anche nelle stazioni linfonodali, è di estrema importanza ed è una fonte di informazioni molto importante per impostare il percorso giusto fin dall’inizio, soprattutto in caso di resezioni limitate.
Messaggi da portare a casa
- Due importanti studi internazionali dimostrano il beneficio dello screening del cancro al polmone in gruppi di rischio definiti.
- Il trattamento di scelta nelle fasi iniziali è la resezione limitata (resezione del segmento anatomico) con linfoadenectomia, preferibilmente minimamente invasiva o assistita da robot.
Letteratura:
- Krebsliga: Il cancro in Svizzera: figure importanti. 2016.
- Goldstraw P, et al: The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol 2016 Jan; 11(1): 39-51.
- Aberle DR, et al: Riduzione della mortalità per cancro al polmone con lo screening tomografico computerizzato a basso dosaggio. N Engl J Med 2011; 365: 395-409.
- De Koning H, et al: Effetti dello screening del cancro al polmone con TAC volumetrica: risultati sulla mortalità dello studio randomizzato-controllato basato sulla popolazione NELSON. Conferenza mondiale sul cancro al polmone 2018; Abstract PL02.05.
- Zhao YR, et al: Studio di screening del cancro al polmone NELSON. Cancer Imaging 2011; 11(1A): S79-S84.
- Gruppo di studio sul cancro del polmone: Studio randomizzato sulla lobectomia rispetto alla resezione limitata per il cancro del polmone non a piccole cellule T1 N0. Annali di chirurgia toracica 1995; 60(3): 615-623.
- Whitson A, et al: Sopravvivenza dopo la lobectomia rispetto alla segmentectomia per il tumore al polmone non a piccole cellule in stadio I: un’analisi basata sulla popolazione. Annali di chirurgia toracica 2011; 92(6): 1943-1950.
- Wolf AS, et al: Lobectomia rispetto alla resezione sublobare per i tumori polmonari non a piccole cellule di piccole dimensioni (2 cm o meno). Annali di chirurgia toracica 2011; 92(5): 1819-1825.
- Koike T, et al: Analisi dei fattori di rischio della recidiva locoregionale dopo la resezione sublobare nei pazienti con carcinoma polmonare non a piccole cellule in stadio clinico IA. Il Journal of Thoracic and cardiovascular surgery 2013; 146 (2): 372-378.
- Altorki NK, et al: La resezione sublobare è equivalente alla lobectomia per il carcinoma polmonare in stadio clinico 1A nei noduli solidi. Il Journal of Thoracic and cardiovascular surgery 2014; 147(2): 754-764.
- Tsutani Y, et al. Esiti oncologici della segmentectomia rispetto alla lobectomia per l’adenocarcinoma polmonare in stadio clinico IA: analisi con punteggio di propensione in uno studio multicentrico. Il Journal of Thoracic and cardiovascular surgery 2013; 146(2): 358-364.
- Kodama K, et al: Esiti oncologici della segmentectomia rispetto alla lobectomia per il carcinoma polmonare non a piccole cellule clinico T1a N0 M0. Annali di chirurgia toracica 2016; 101(2): 504-511.
- Macke RA, et al: Le resezioni anatomiche che preservano il parenchima comportano una minore perdita di funzionalità polmonare nei pazienti con carcinoma polmonare non a piccole cellule in stadio I. J Cardiothorac Surg 2015; 10: 49.
- Saito H, et al: Funzione polmonare dopo la lobectomia rispetto alla segmentectomia nei pazienti con tumore al polmone non a piccole cellule in stadio I. World Journal of Surgery agosto 2014; 38(8): 2025-2031.
- Ludwig MS, et al: Sopravvivenza postoperatoria e numero di linfonodi campionati durante la resezione del carcinoma polmonare non a piccole cellule nodo-negativo. Chest 2005; 128(3): 1545-1550.
- Gulack BC, et al: L’impatto delle dimensioni del tumore sull’associazione tra l’estensione della resezione linfonodale e la sopravvivenza nel carcinoma polmonare non a piccole cellule in stadio clinico I. Cancro al polmone 2015; 90(3): 554-560.
- Stiles BM, et al: L’importanza della dissezione linfonodale che accompagna la resezione a cuneo per il carcinoma polmonare in stadio clinico IA. Eur J Cardiothorac Surg 2017; 51(3): 511-517.
- Dyas AR, et al: Errori clinici e fattori di rischio della malattia nodale occulta nel tumore del polmone non a piccole cellule. Annali di chirurgia toracica 2018; 106(5): 1492-1498.
InFo ONcOLOGIA & EMATOLOGIA 2018; 6(6): 4-7.