L’ictus è una malattia molto diffusa. Il più delle volte porta a un’invalidità permanente in età adulta. Pertanto, sono in corso progetti di ricerca per migliorare la diagnostica e la terapia.
L’ictus è una malattia molto diffusa. A livello globale, il numero di pazienti con ictus ischemico ed emorragico è aumentato rispettivamente del 37% e del 47% tra il 1990 e il 2010. Poiché anche il numero assoluto di decessi è aumentato di conseguenza e l’ictus è la malattia che più frequentemente porta a un’invalidità permanente in età adulta, si stanno portando avanti numerosi progetti di ricerca che mirano principalmente a migliorare la diagnostica, la terapia acuta e la prevenzione secondaria. Di seguito, verrà delineata una panoramica dei risultati degli studi attuali e delle conseguenze per la routine clinica. Poiché gli ictus ischemici (IS) rappresentano l’85-90% di tutti gli ictus e i risultati più importanti sono stati ottenuti nei pazienti con IS, il focus di questo articolo sarà su di loro.
Terapia acuta – “Il tempo è cervello”!
Le terapie ricanalizzanti sono la base e il prerequisito fondamentale per il successo del trattamento acuto dell’IS. Attualmente, questo trattamento comprende la trombolisi endovenosa con l’attivatore del plasminogeno ricombinante di tipo tissutale (rtPA) [1] e la trombectomia meccanica, solitamente eseguita con stent retrievers [2]. Entrambe le opzioni terapeutiche sono accomunate dal fatto che la terapia è critica dal punto di vista del tempo, il che è riassunto dal noto slogan “il tempo è cervello”. Si stima che nell’IS acuta, quasi due milioni di neuroni al minuto vengano distrutti in modo irreversibile. Il concetto di penombra è rilevante dal punto di vista fisiopatologico, secondo il quale il cosiddetto nucleo dell’infarto viene perso in modo irreversibile molto rapidamente dopo l’insorgenza dei sintomi, mentre la penombra circonda il nucleo dell’infarto, ma è almeno brevemente rifornita dai collaterali e quindi potenzialmente salvabile. A un certo punto, il danno potenziale della misura di ricanalizzazione supera il beneficio atteso, per cui la terapia non dovrebbe essere effettuata. Mentre solo pochi anni fa si cercava di definire finestre temporali generalmente vincolanti (trombolisi endovenosa: 4,5 ore; trombectomia: 6 ore), sta diventando sempre più chiaro che esistono grandi differenze interindividuali nella dinamica della progressione dell’infarto, che presumibilmente dipendono in modo significativo dallo stato collaterale del rispettivo paziente. Di conseguenza, anche la terapia, cioè la valutazione della finestra temporale, del trattamento ricanalizzante deve essere adattata individualmente. Di seguito, vari esempi spiegheranno l’attuale situazione di studio in questo campo.
La trombectomia a volte ha successo anche ore dopo l’insorgenza dei sintomi
Lo studio DAWN [3] ha analizzato i risultati delle trombectomie in una finestra temporale compresa tra le sei e le ventiquattro ore (“last seen well”). I pazienti con angiografia TC (CTA) o angiografia RM (MRA) con evidenza di occlusione dell’arteria carotide interna intracranica (ACI) o del segmento M1 dell’arteria cerebrale media (ACM) sono stati inclusi se c’era una mancata corrispondenza tra il volume dell’infarto e la gravità dei sintomi clinici. Ulteriori criteri di inclusione includevano una scala Rankin modificata (mRS) pre-morbosa di 0-1. I pazienti sono stati randomizzati al gruppo trombectomia (n=107) e al gruppo di controllo (n=99). Il punteggio mediano della National Institutes of Health Stroke Scale (NIHSS) è stato di 17 in entrambi i gruppi e il volume mediano dell’infarto è stato di 7,6 ml nel gruppo della trombectomia e di 8,9 ml nel gruppo di controllo. Dopo 90 giorni, il 49% del gruppo trombectomia era funzionalmente indipendente (mRS 0-2), rispetto a solo il 13% del gruppo di controllo. Già dopo 24 ore, c’era una differenza nel volume mediano dell’infarto (8 ml nel gruppo trombectomia contro 22 ml nel gruppo di controllo). Gli endpoint avversi non differivano nei due gruppi.
Un altro studio che ha analizzato la procedura di trombectomia in una finestra temporale estesa è lo studio DEFUSE-3 [4]. È stata studiata una finestra temporale di 6-16 ore (gruppo trombectomia: n=92; gruppo controllo: n=90), con un volume infartuale iniziale di massimo 70 ml e un rapporto tra volume infartuale e area minacciata di almeno 1,8 con una penombra di almeno 15 ml. Doveva esserci un’occlusione dell’ACI o dell’ACM prossimale confermata con CTA o MRA. Il punteggio mRS a 90 giorni è stato scelto come endpoint primario. Inoltre, sono stati valutati il volume infartuale dopo 24 ore, l’aumento del volume infartuale, la riperfusione e la riapertura dell’arteria occlusa. Dopo 90 giorni, il 45% del gruppo trombectomia e il 17% del gruppo di controllo erano funzionalmente indipendenti. Nel gruppo della trombectomia, l’aumento mediano del volume dell’infarto è stato di 23 ml, nel gruppo di controllo di 33 ml.
Entrambi gli studi indicano che in pazienti selezionati, la trombectomia può essere eseguita con successo clinico anche molte ore dopo la comparsa dei sintomi. È indispensabile che questo venga considerato nella routine clinica.
Risonanza magnetica d’emergenza 24 ore su 24, 7 giorni su 7, in caso di finestra temporale poco chiara.
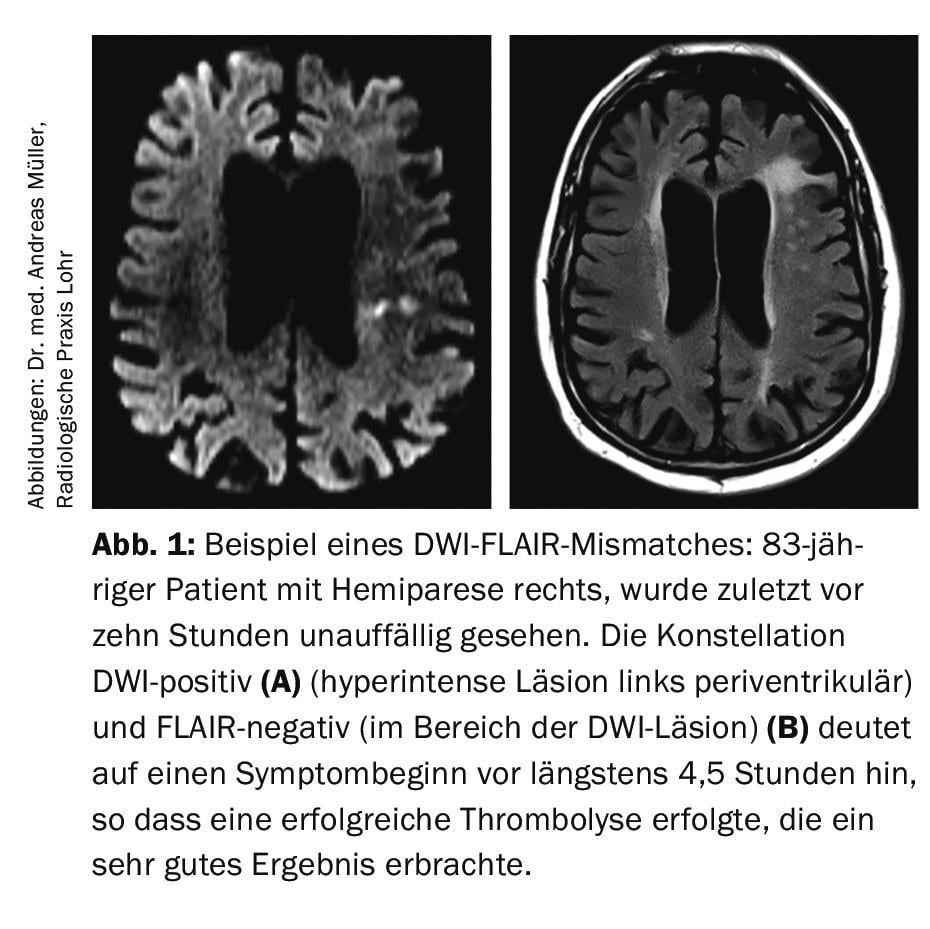
È noto che in un massimo del 30% di tutte le IS, la finestra temporale (cioè l’insorgenza dei sintomi) è sconosciuta, per cui formalmente, secondo i criteri di approvazione dell’rtPA, esiste una controindicazione alla trombolisi endovenosa. Con l’obiettivo di trattare questi pazienti con la trombolisi endovenosa, il gruppo di lavoro di Amburgo, guidato dal Prof. Dr. med. Götz Thomalla, ha valutato la cosiddetta imaging DWI-FLAIR mismatch (DWI=”imaging pesato con la diffusione”; FLAIR=”recupero di inversione attenuato dal fluido”). La sequenza DWI mostra l’edema citotossico, che di solito si sviluppa molto presto dopo l’insorgenza di un ictus ischemico. Al contrario, la sequenza FLAIR indica l’edema vasogenico, che di solito si sviluppa a partire da 4,5 ore dopo l’insorgenza dell’infarto. Ne consegue che se un paziente presenta un’anomalia di segnale DWI-positiva ma non FLAIR, è relativamente probabile che il momento dell’insorgenza dei sintomi sia entro 4,5 ore prima dell’esecuzione della RM. (Fig.1). Nello studio multicentrico randomizzato e controllato con placebo, sono stati inclusi pazienti con IS (DWI-positivi, FLAIR-negativi) e randomizzati 1:1 tra rtPA 0,9 mg/kg di peso corporeo o placebo [5]. Lo studio è stato interrotto anticipatamente perché in un’analisi ad interim l’endpoint primario (mRS dopo 90 giorni 0-1 punti) è stato raggiunto significativamente più spesso nel gruppo verum (53,3%) rispetto al gruppo placebo (41,8%). Il tasso di emorragie intracraniche è aumentato in modo non significativo nel gruppo verum con il 2,0% rispetto al gruppo placebo con lo 0,4%. Nel complesso, lo studio è stato salutato come un grande successo. Questo ha portato all’idea che una struttura per la risonanza magnetica d’emergenza dovrebbe essere disponibile 24 ore su 24, in modo da non perdere l’opportunità della trombolisi se la finestra temporale non è chiara.
I neurologi che pensano in modo critico si sono chiesti da tempo se, nel caso di un singolo paziente, non sarebbe anche concepibile a) nonostante una finestra temporale <4,5 ore (perché, ad esempio, i collateralismi sono molto scarsi e un nucleo infartuale ampio o una penombra piccola/assente sono già presenti dopo poco tempo), oppure b) nonostante una finestra temporale >4,5 ore per eseguire la trombolisi nei casi in cui c’è un nucleo infartuale relativamente piccolo e una penombra ampia.
Mentre la costellazione a) non è stata quasi mai studiata ed è anche probabile che si verifichi molto meno frequentemente, è la costellazione b) frequentemente incontrati nella routine clinica. Ci sono studi recenti che hanno esaminato la trombolisi endovenosa fino a 9 ore dopo l’insorgenza di un ictus ischemico. Lo studio multicentrico randomizzato e controllato con placebo EXTEND ha incluso 225 pazienti con IS e aree cerebrali ipoperfuse, compresa la penombra potenzialmente salvabile, nella finestra temporale da 4,5 a 9 ore dopo l’insorgenza dei sintomi, e randomizzati 1:1 ai gruppi 0,9 mg/kg di peso corporeo o placebo [6]. Dopo la pubblicazione dello studio wake-up positivo [5], anche lo studio EXTEND è stato interrotto prematuramente. L’endpoint primario (mRS a 90 giorni 0-1 punti) è stato raggiunto nel 35,4% dei pazienti nel gruppo verum e nel 29,5% dei pazienti nel gruppo placebo (p=0,04). Le emorragie intracerebrali sono state diagnosticate nel 6,2% dei casi nel gruppo Verum e nello 0,9% dei casi nel gruppo placebo (p=0,05).
In sintesi, la trombolisi endovenosa da 4,5 a 9 ore dopo l’insorgenza dei sintomi in una popolazione di pazienti selezionati porta a un esito clinico migliore a 90 giorni, nonostante un aumento del tasso di emorragia cerebrale. Questa affermazione è supportata da una recente meta-analisi [7]. Tuttavia, un trasferimento immediato di questi risultati nella routine clinica generale sembra troppo presto. In definitiva, tuttavia, si può ipotizzare che nei prossimi anni ci sarà una crescente individualizzazione della terapia acuta per l’ictus ischemico basata sull’imaging multimodale.
Tenecteplase come alternativa all’alteplase?
Per la trombolisi, attualmente solo l’alteplase (0,9 mg/kg di peso corporeo, massimo. 90 mg) è approvato. Le sostanze alternative sono ancora oggetto di ricerca con l’obiettivo di una terapia con maggiore sicurezza ed efficacia. Il tenecteplase potrebbe essere un’alternativa promettente.
Il tenecteplase ha una maggiore affinità per la fibrina e un’emivita più lunga. Ciò consentirebbe la somministrazione tramite un bolo rispetto all’infusione di un’ora con alteplase. Nello studio NOR-TEST [8], sono stati trattati 1100 pazienti, 549 con tenecteplase (0,4 mg/kg) e 551 con alteplase (0,9 mg/kg). L’endpoint di un mRS di 0-1 a tre mesi è stato raggiunto dal 64% dei pazienti nel gruppo tenecteplase e dal 63% nel gruppo di controllo. Non è stata riscontrata una superiorità del tenecteplase rispetto all’alteplase, né il profilo di sicurezza ha mostrato differenze significative.
Nello studio EXTEND-IA TNK [9], invece, è stata studiata la cosiddetta lisi ponte prima della trombectomia con tenecteplase (n=101, dose 0,25 mg/kg) rispetto ad alteplase (n=101). I pazienti si trovavano nella finestra temporale di 4,5 ore ed erano programmati per la trombectomia per un’occlusione accertata dell’ACI, dell’ACM o dell’arteria basilare. L’endpoint primario era la riperfusione di almeno il 50% o l’assenza di trombo interventricolare. Questo endpoint è stato raggiunto nel 22% dei pazienti nel gruppo tenecteplase e nel 10% nel gruppo di controllo. Anche l’esito funzionale a 90 giorni è stato migliorato nel gruppo tenecteplase (mRS mediano 2 vs. 3), senza alcun raggruppamento di effetti avversi. Ulteriori studi, TASTE e ATTEST, non hanno mostrato la superiorità della tenecteplase rispetto all’alteplase, ma il pooling dei pazienti ha mostrato un vantaggio per quei pazienti che avevano un’occlusione completa del vaso, con ricanalizzazione completa a 24 ore nel 71% del gruppo tenecteplase rispetto al 43% del gruppo di controllo [10].
Sono in corso ulteriori studi. I risultati finora ottenuti suggeriscono almeno una non inferiorità del tenecteplase con una modalità di applicazione più semplice, che potrebbe essere un vantaggio rilevante soprattutto in caso di trasporto secondario prima della trombectomia. I prossimi anni mostreranno se la promettente trombolisi alternativa con tenecteplase entrerà effettivamente a far parte della routine clinica.
Prevenzione secondaria attraverso l’anticoagulazione orale o la chiusura dell’appendice atriale.
Qualsiasi terapia antitrombotica attualmente approvata per la prevenzione secondaria dell’IS aumenta la probabilità di complicazioni emorragiche. Nel caso della fibrillazione atriale, la terapia farmacologica consiste nell’anticoagulazione orale. A questo scopo sono possibili gli antagonisti della vitamina K (ad esempio il fenprocumone, target INR 2-3) o gli anticoagulanti orali non dipendenti dalla vitamina K (NOAKs, inibitori anti-Xa o l’inibitore diretto della trombina dabigatran), che dimezzano approssimativamente il rischio di emorragia cerebrale rispetto agli antagonisti della vitamina K.
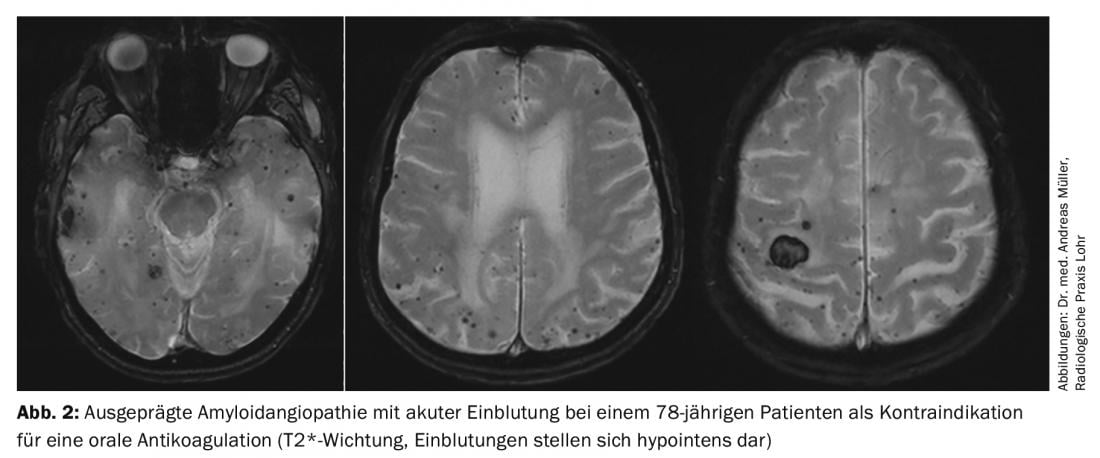
Tuttavia, ci sono pazienti che non possono essere trattati con anticoagulanti orali a causa di un aumento del rischio di sanguinamento. Per questi, la chiusura interventistica dell’appendice atriale è un’opzione di principio. Si ritiene che il 90% di tutti i trombi cardiaci si formino nell’atrio sinistro. Sono stati sviluppati diversi dispositivi per la chiusura dell’appendice atriale, ma i dati attuali sono i migliori per il cosiddetto dispositivo Watchman®. Recentemente sono stati pubblicati i dati a 5 anni degli studi PREVAIL e PROTECT AF, che hanno mostrato un minor rischio di sanguinamento e una minore mortalità rispetto al warfarin [11]. In sintesi, la chiusura interventistica dell’appendice atriale sinistra con il dispositivo Watchman® può offrire dei vantaggi, in particolare nei pazienti con un alto rischio di emorragia (punteggio HASBLED elevato) o controindicazione all’anticoagulazione orale, in quanto il rischio di emorragia (in particolare di emorragia cerebrale) è significativamente ridotto (Fig. 2). I punti critici da notare sono: a) Mancanza di dati a lungo termine, b) complicazioni periinterventistiche, c) Possibilità di formazione di trombi cardiaci al di fuori dell’orecchio atriale, d) Necessità di una doppia inibizione temporanea della funzione piastrinica. Il confronto tra NOAK e chiusura dell’appendice atriale, per il quale non sono ancora stati pubblicati studi, è ancora in discussione. È ipotizzabile che il vantaggio della chiusura dell’appendice atriale in termini di riduzione delle complicanze emorragiche non sia presente con l’anticoagulazione con NOAKs.
Gli under 60 con ESUS e PFO beneficiano della chiusura del PFO più TFH
Per un altro intervento cardiaco, la situazione dello studio è cambiata in modo significativo nel 2017. Mentre fino ad allora i pazienti con IS e forame ovale persistente (PFO) come causa presunta dell’ictus venivano trattati solo con un inibitore della funzione piastrinica (TFH), diversi lavori hanno dimostrato che in pazienti selezionati fino a 60 anni di età con ictus criptogenetico e PFO con almeno uno shunt destro-sinistro moderato, la chiusura interventistica del PFO più TFH è superiore al solo TFH. [12–14]. L’anticoagulazione orale non offre esplicitamente alcun vantaggio. Il limite di età di 60 anni si basa sul presupposto che i pazienti più anziani hanno maggiori probabilità di avere una causa alternativa di ictus rispetto ai pazienti più giovani (in particolare la fibrillazione atriale). In definitiva, però, la linea è tracciata arbitrariamente e resta da vedere se anche i pazienti di età superiore ai 60 anni non possano beneficiare della chiusura del PFO.
Poiché il termine “ictus criptogenetico” non è definito con precisione, nel 2014 è stato introdotto il termine ESUS (“ictus embolico di origine non determinata”) [15]. Sulla base di questa precisa definizione, è stato studiato se i pazienti con ESUS (cioè con fibrillazione atriale sospetta ma non accertata) sono più protetti da una recidiva di IS con NOAK che con ASA. Lo studio NAVIGATE-ESUS, che ha confrontato rivaroxaban con ASA, ha dovuto essere interrotto prematuramente dopo 3609 pazienti, perché non c’era più alcun vantaggio da aspettarsi nel gruppo di intervento. [16]. Lo studio RE-SPECT-ESUS ha anche confermato che l’anticoagulazione orale rispetto al TFH con ASA non apporta benefici al gruppo complessivo di pazienti ESUS [17]. Quest’ultimo studio ha coinvolto 5390 pazienti di 564 centri di studio. Hanno ricevuto ASA 100 mg o dabigatran a 110 mg o 150 mg due volte al giorno. L’endpoint primario era la recidiva di IS. Dopo una mediana di 19 mesi, il 4,1% dei pazienti nel braccio dabigatran ha avuto un secondo evento all’anno, rispetto al 4,8% all’anno nel braccio ASA dello studio. La riduzione del rischio relativo del 15% non ha raggiunto la significatività statistica (p=0,10). Il sanguinamento grave si è verificato nell’1,7% (dabigatran) e nell’1,4% (ASA) dei pazienti all’anno. C’è stata una differenza significativa a svantaggio di dabigatran nei sanguinamenti clinicamente rilevanti, non gravi (1,6 vs. 0,9 % all’anno). Gli studi ATTICUS e ARCADIA che confrontano apixaban con ASA sono ancora in corso. A prescindere da questo, ci sono prove sempre più evidenti che, in caso di ESUS, l’anticoagulazione orale con NOAK è superiore al TFH in pazienti selezionati (ad esempio, con PFO [18] o allargamento dell’atrio sinistro [19]). Tuttavia, sono necessari ulteriori studi per riprodurre questi risultati.
Il doppio TFH può prevenire le recidive
Da molti anni è chiaro che la doppia TFH permanente (di solito con ASA e clopidogrel) è sfavorevole nel rapporto rischio/beneficio. In alcune costellazioni, tuttavia, un doppio TFH temporaneamente limitato può essere utile e necessario. I motivi noti sono, ad esempio, stenosi intracraniche sintomatiche [20] o posizionamento di stent nelle arterie che riforniscono il cervello. Al contrario, è nuova la scoperta che i pazienti con TIA e alto rischio di recidiva (punteggio ABCD2 ≥4) o IS lieve (“ictus minore”, NIHSS ≤3) sono più protetti dagli eventi di recidiva ischemica precoce da una doppia TFH con ASA e clopidogrel per una durata di 10-21 giorni rispetto alla monoterapia con ASA [21,22]. Il rischio di emorragia è aumentato. Tuttavia, gli autori dello studio POINT stimano che la doppia TFH previene tre volte di più le IS ricorrenti rispetto alle emorragie gravi [22]. Si prevede che una raccomandazione sarà presto inclusa nelle linee guida della Società tedesca di neurologia (DGN). Una dichiarazione positiva sulla procedura è già stata pubblicata sulla homepage della DGN.
Prospettiva
I risultati terapeutici elencati negli ultimi anni sono espressione di un’intensa attività di ricerca e di un approccio rigorosamente basato sull’evidenza. Si spera e si presume che questo sviluppo continuerà. Con ogni probabilità, il trattamento dell’ictus diventerà più complicato, in quanto verranno sempre più identificati i singoli pazienti (gruppi) che rispondono particolarmente bene o male a una particolare opzione terapeutica. L’individualizzazione della medicina sta progredendo.
Letteratura:
- Hacke W, et al: Trombolisi con alteplase da 3 a 4,5 ore dopo un ictus ischemico acuto. N Engl J Med 2008; 359(13): 1317-1329.
- Berkhemer OA, et al: Uno studio randomizzato sul trattamento intraarterioso per l’ictus ischemico acuto. N Engl J Med 2015; 372(1): 11-20.
- Nogueira RG, et al: Trombectomia da 6 a 24 ore dopo l’ictus con una mancata corrispondenza tra deficit e infarto. N Engl J Med 2018; 378: 11-21.
- Albers GW, et al: Trombectomia per ictus a 6-16 ore con selezione mediante imaging di perfusione. N Engl J Med 2018; 378(8): 708-718.
- Thomalla G, et al: Trombolisi guidata dalla risonanza magnetica per l’ictus con momento di insorgenza sconosciuto. N Engl J Med 2018; 379(7): 611-622.
- Ma H, et al: Trombolisi guidata dall’imaging di perfusione fino a 9 ore dopo l’insorgenza dell’ictus. N Engl J Med 2019; 380(19): 1795-1803.
- Campbell BCV, et al: Estendere la trombolisi a 4,5-9 ore e risvegliare l’ictus usando l’imaging di perfusione: una revisione sistematica e una meta-analisi dei dati dei singoli pazienti. Lancet 2019; 394(10193): 139-147.
- Logallo N, et al: Tenecteplase versus alteplase per la gestione dell’ictus ischemico acuto (nor-test): uno studio di fase 3, randomizzato, open-label, con endpoint in cieco. Lancet Neurol 2017; 16: 781-788.
- Campbell BCV, et al: Tenecteplase rispetto ad alteplase prima della trombectomia per l’ictus ischemico. N Engl J Med 2018; 378(17): 1573-1582.
- Bivard A, et al: La tenecteplase nell’ictus ischemico offre una ricanalizzazione migliore. Neurologia 2017; 89(1): 62-67.
- Reddy VY, et al: Esiti a 5 anni dopo la chiusura dell’appendice atriale sinistra: dagli studi PREVAIL e PROTECT AF. J Am Coll Cardiol 2017; 70(24): 2964-2975.
- Søndergaard L, et al: Chiusura del forame ovale o terapia antiaggregante per l’ictus criptogenetico. N Engl J Med 2017; 377(11): 1033-1042.
- Mas JL, et al: Chiusura del forame ovale o anticoagulazione rispetto agli antiaggreganti dopo un ictus. N Engl J Med 2017; 377(11): 1011-1021.
- Saver JL, et al: Esiti a lungo termine della chiusura del forame ovale o della terapia medica dopo un ictus. N Engl J Med 2017; 377(11): 1022-1032.
- Hart RG, et al: Ictus embolico di origine indeterminata: il caso di un nuovo costrutto clinico. Lancet Neurol 2014; 13(4): 429-438.
- Hart RG, et al: Rivaroxaban per la prevenzione dell’ictus dopo un ictus embolico di origine indeterminata. N Engl J Med 2018; 378(23): 2191-2201.
- Diener HC, et al: Dabigatran per la prevenzione dell’ictus dopo un ictus embolico di origine indeterminata. N Engl J Med 2019; 380(20): 1906-1917.
- Kasner SE, et al: Rivaroxaban o aspirina per il forame ovale pervio e l’ictus embolico di origine non determinata: un’analisi di sottogruppo prespecificata dello studio NAVIGATE ESUS. Lancet Neurol 2018; 17(12): 1053-1060.
- Healey JS, et al: Ictus ricorrente con Rivaroxaban rispetto ad Aspirina in base ai predittori di fibrillazione atriale: analisi secondaria dello studio clinico randomizzato NAVIGATE ESUS. JAMA Neurol 2019, in stampa.
- Chimowitz MI, et al: Stenting rispetto alla terapia medica aggressiva per la stenosi arteriosa intracranica. N Engl J Med 2011; 365(11): 993-1003.
- Prasad K, et al: Terapia antiaggregante doppia con aspirina e clopidogrel per l’attacco ischemico transitorio acuto ad alto rischio e l’ictus ischemico minore: una linea guida di pratica clinica. BMJ 2018; 363: k5130.
- Johnston SC, et al: Clopidogrel e Aspirina nell’ictus ischemico acuto e nel TIA ad alto rischio. N Engl J Med 2018; 379(3): 215-225.
InFo NEUROLOGIA & PSICHIATRIA 2019; 17(5): 5-9