Il restringimento della valvola aortica è il difetto valvolare acquisito più comune e viene corretto mediante AKE o TAVI. Tuttavia, nonostante i progressi della terapia, spesso si verificano problemi di ritmo. Cosa fare?
In Svizzera, migliaia di pazienti si sottopongono ogni anno alla sostituzione chirurgica della valvola aortica (ACE) o all’impianto transcatetere della valvola aortica (TAVI). Nella maggior parte dei casi, l’indicazione primaria è la stenosi della valvola aortica calcificante, che colpisce il 3-5% della popolazione di età superiore ai 75 anni [1].
Le tachiaritmie, in particolare la fibrillazione atriale (FA) e i disturbi della conduzione atrioventricolare (AV), soprattutto il blocco di branca sinistra (LSB) e il blocco AV di grado superiore, sono tra i problemi di ritmo più comuni prima, durante e dopo l’intervento chirurgico di LCE o TAVI. Queste aritmie aumentano la morbilità e la mortalità, comportano una degenza ospedaliera prolungata e aumentano i costi.
L’impatto clinico di queste aritmie nei pazienti con vizio della valvola aortica è vario e lo spettro della sintomatologia varia dalla completa assenza di sintomi e disturbi, a palpitazioni occasionali, affaticamento, vertigini, dispnea o dolore toracico, fino a insufficienza cardiaca grave clinicamente manifesta, sincope, shock cardiogeno e morte.
Fibrillazione atriale – Cercate e troverete!
La fibrillazione atriale è l’aritmia cardiaca più comune, con un forte aumento della prevalenza con l’età: nelle persone con più di 80 anni, la prevalenza è già superiore al 10% [1]. La prevalenza aumenta anche nell’insufficienza renale, nella BPCO, nell’insufficienza cardiaca e nei pazienti dopo un intervento chirurgico alla valvola (Fig. 1) [2]. Nei pazienti con stenosi valvolare aortica grave, questa prevalenza aumenta di nuovo in modo significativo e, secondo la letteratura, è dell’8-13% prima dell’AKE chirurgica e del 16-51% prima della TAVI [3].
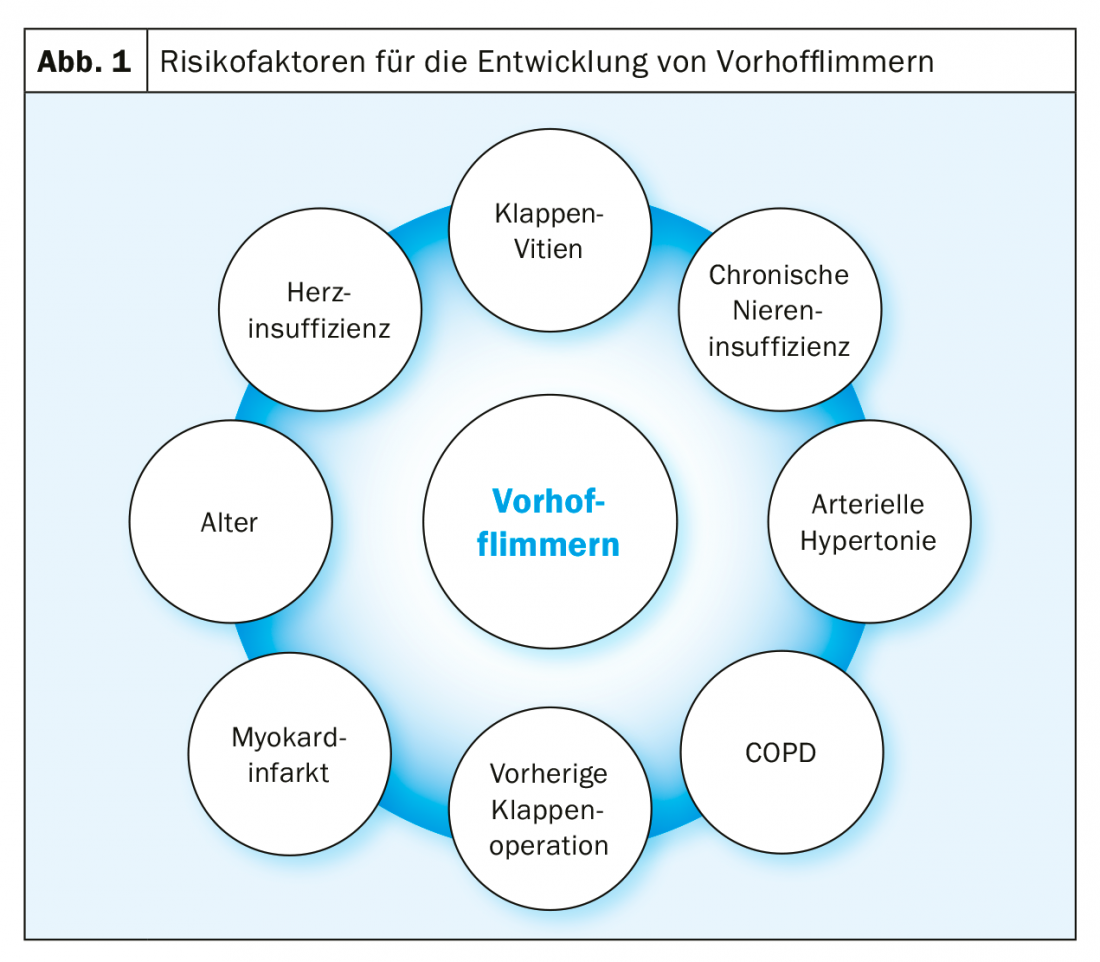
Questa prevalenza molto elevata di VCF nella stenosi valvolare aortica grave è dovuta da un lato alla co-incidenza dei fattori di rischio per entrambe le malattie: in generale, i pazienti con stenosi valvolare aortica grave sono per lo più molto anziani. D’altra parte, il vitium stesso porta anche a cambiamenti emodinamici, che si traducono in un carico di pressione sull’atrio sinistro e in una fibrosi atriale sinistra consecutiva, con anche cambiamenti elettrici degli atri. Nel complesso, questa trasformazione del substrato favorisce la comparsa della VHF (Fig. 2).
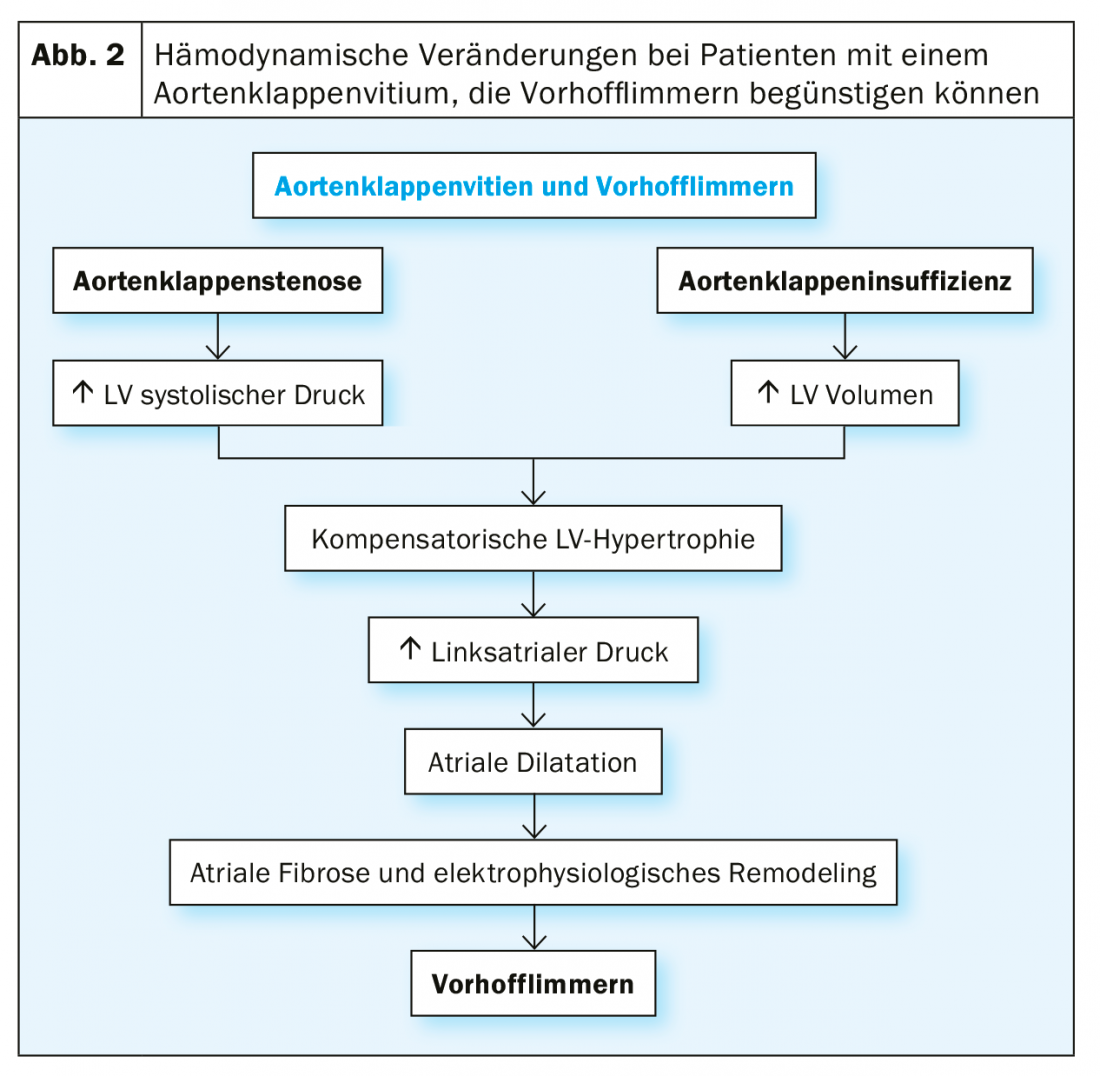
Soprattutto nell’AKE chirurgico, viene generato uno stato iperadrenergico periintervento e viene indotta una risposta infiammatoria cardiaca dal trauma chirurgico, che si ritiene sia in parte responsabile dello sviluppo della VCF periinterventistica.
Anche dopo l’AKE chirurgica o la TAVI, la VHF è l’aritmia più comune diagnosticata di recente. L’incidenza dipende fortemente dal metodo di screening utilizzato: più lungo è il monitoraggio del ritmo, più frequentemente si riscontra la VCF.
In generale, sono stati descritti alti tassi di incidenza di VCF dopo l’ACE chirurgico e la TAVI (31-64% e 4-32%, rispettivamente) [4]. Uno studio pubblicato di recente da Kalra et al, che ha analizzato i dati di 171.480 pazienti dopo una LCE chirurgica e una TAVI, ha rilevato un tasso di incidenza di VCF di circa il 50% in entrambi i gruppi [2]. Nell’importante studio NOTION, 52 pazienti sono stati monitorati continuamente con un registratore di eventi dopo l’AKE chirurgica o la TAVI [4]. L’incidenza della VCVA è stata del 100% dopo la LCE chirurgica e dell’82% dopo la TAVI. Dopo l’AKE chirurgica, la nuova diagnosi di FA si è verificata entro i primi 61 giorni in tutti i pazienti e dopo la TAVI entro i primi 41 giorni. Il carico di aritmia nelle prime 2 settimane dopo l’AKE chirurgico e la TAVI è stato significativamente maggiore (2,8%) nei pazienti dopo l’AKE chirurgico rispetto allo 0,04% dopo la TAVI (p=0,01). Tuttavia, il carico di aritmia è diminuito significativamente dopo 3 mesi nei pazienti dopo la LFS chirurgica [4].
È probabile che molti di questi pazienti avessero una VCF preesistente ma asintomatica. La sottodiagnosi della fibrillazione atriale asintomatica è un problema generale e non riguarda solo i pazienti con stenosi valvolare aortica grave.
Una nuova diagnosi di VCF dopo l’ACE chirurgico o la TAVI comporta un prolungamento dell’ospedalizzazione rispetto ai pazienti senza VCF (9 vs. 6 giorni per entrambi i gruppi; p<0,001) [2]. In questi pazienti, si osserva anche un aumento significativo della mortalità durante il ricovero ospedaliero dopo l’ACE chirurgico e la TAVI, rispetto ai pazienti senza VCVA di nuova diagnosi. Inoltre, la mortalità a 1 anno dei pazienti con VCF incisionale dopo TAVI è significativamente aumentata rispetto ai pazienti senza VCF di nuova diagnosi (31% vs. 14%; p<0,01) [5].
L’anticoagulazione orale per la profilassi del tromboembolismo deve essere utilizzata in tutti i pazienti con VCF e rischio aumentato di tromboembolismo.
Disturbi della conduzione AV e requisiti del pacemaker
I fattori di rischio più importanti per i disturbi della conduzione AV sono l’età, l’insufficienza cardiaca, la malattia coronarica, l’ipertensione arteriosa e il diabete mellito [6]. Non sorprende quindi che i disturbi della conduzione AV siano molto comuni nei pazienti tipicamente piuttosto anziani con stenosi valvolare aortica grave: nel 10-20% dei pazienti che ricevono un’AKE chirurgica o una TAVI, è già stato impiantato un pacemaker in precedenza [7]. Ulteriori fattori di rischio per i disturbi della conduzione AV dopo la TAVI sono in particolare il blocco completo del fascio destro e il blocco AV di 1° grado (Fig. 3).
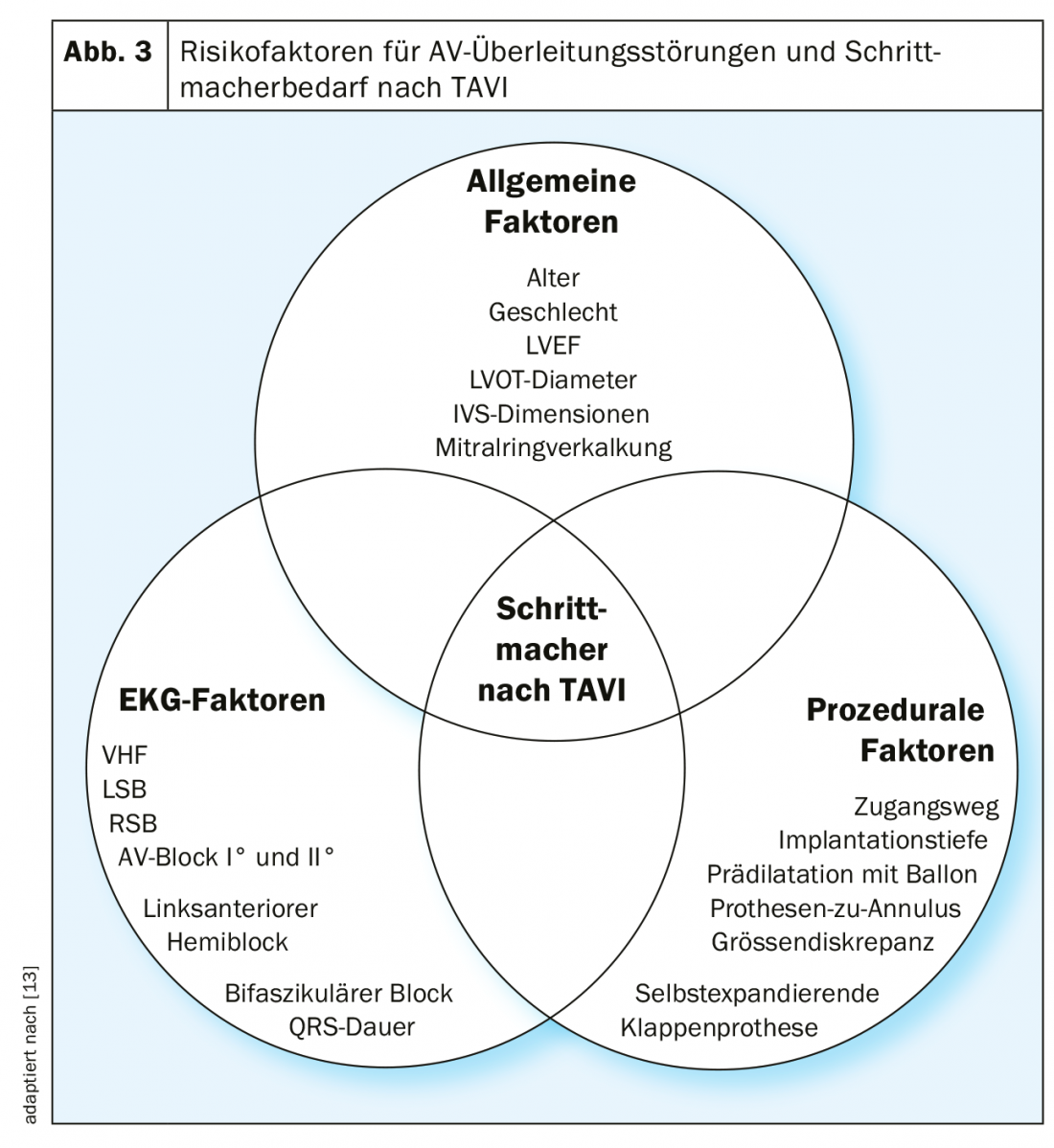
Lo sviluppo di disturbi della conduzione AV durante e dopo l’AKE chirurgico o la TAVI è dovuto anche alla stretta relazione anatomica della valvola aortica con il sistema di conduzione. Quindi, il fascicolo sinistro corre in modo relativamente superficiale direttamente sotto la valvola aortica nel tratto di deflusso del ventricolo sinistro. La compressione meccanica di questa regione da parte di una valvola aortica profondamente impiantata durante la TAVI, o la lesione di questa regione durante l’AKE chirurgico, provocherà un blocco di branca sinistra o addirittura un blocco AV completo, quest’ultimo soprattutto in presenza di un blocco di branca destra preesistente.
Se è presente una valvola aortica bicuspide o una stenosi valvolare aortica gravemente calcificata, si osserva anche una maggiore prevalenza di anomalie della conduzione AV e di necessità di stimolazione, a causa della necessità di uno sbrigliamento esteso.
L’incidenza dei difetti di conduzione AV dopo la TAVI dipende anche dal modello di valvola impiantata. Questo è generalmente più alto con le protesi valvolari autoespandibili rispetto ai modelli espandibili con palloncino. Anche la dimensione dell’anulus della valvola aortica in relazione al diametro della valvola protesica gioca un ruolo, insieme alla profondità di impianto.
I difetti di conduzione atrioventricolare di solito si verificano durante o poco dopo l’impianto della valvola, ma possono anche verificarsi alcuni giorni dopo la TAVI [8]. Quest’ultimo aspetto rende difficile la gestione di questi pazienti e porta a un’indicazione molto più liberale per l’impianto di pacemaker dopo la TAVI rispetto all’AKE chirurgica. Al contrario, dopo l’AKE chirurgico, in caso di blocco AV completo, si attende fino a una settimana e si impianta un pacemaker solo se il blocco AV non si riprende.
L’incidenza del blocco del fascio sinistro dopo l’AKE chirurgico è del 3-4% e l’incidenza del blocco AV completo persistente con necessità di stimolazione è del 3-12% [8,9]. Al contrario, l’incidenza del blocco del fascio sinistro dopo la TAVI è del 18-65% per le valvole protesiche autoespandibili e del 4-30% per quelle espandibili con palloncino [10]. Un pacemaker viene reimpiantato nel 25-28% dei pazienti dopo la TAVI con una valvola protesica autoespandibile e nel 5-7% dei pazienti che hanno ricevuto una valvola protesica espandibile con palloncino [10].
È intuitivo supporre che il blocco di branca sinistro completo sia prognosticamente sfavorevole a causa della dissincronia ventricolare associata, soprattutto in presenza di una concomitante compromissione della funzione ventricolare sinistra. Allo stesso modo, un nuovo blocco di branca del fascio sinistro iatrogeno comporta il rischio di progressione del disturbo di conduzione AV fino al blocco AV completo.
In una meta-analisi, Regueiro et al. descrivono. nei pazienti con nuovo blocco di branca sinistra dopo la TAVI, un tasso più elevato di impianto di pacemaker (RR 2,18; 95% CI, 1,28-3,70; p<0,01), una mortalità cardiaca più elevata (RR 1,39, 95% CI, 1,04-1,86, p=0,03) e un effetto negativo sulla funzione di pompa ventricolare sinistra entro il primo anno dopo la TAVI rispetto ai pazienti senza nuovo blocco di branca del fascio sinistro. [11]. Tuttavia, i dati sono contraddittori a questo proposito: un’altra meta-analisi, ad esempio, non ha dimostrato un aumento della mortalità nei pazienti con un nuovo blocco di branca sinistra dopo la TAVI [12].
Fornire ai pazienti giusti un pacemaker al momento giusto dopo la TAVI rimane una sfida clinica difficile.
Letteratura:
- Go AS, Hylek EM, Phillips KA, et al: Prevalenza della fibrillazione atriale diagnosticata negli adulti. Jama 2001; 285: 2370.
- Kalra R, Patel N, Doshi R, et al: Valutazione dell’incidenza della fibrillazione atriale di nuova insorgenza dopo la sostituzione della valvola aortica. JAMA Intern Med 2019; 35294: 1-9.
- Tarantini G, Mojoli M, Urena M, Vahanian A: Fibrillazione atriale nei pazienti sottoposti a impianto di valvola aortica transcatetere: epidemiologia, tempistica, predittori ed esito. Eur Heart J 2017; 38: 285-293.
- Jørgensen TH, Thyregod HGH, Tarp JB, et al: Cambiamenti temporali della fibrillazione atriale di nuova insorgenza nei pazienti randomizzati alla sostituzione chirurgica o transcatetere della valvola aortica. Int J Cardiol Elsevier B.V.; 2017; 234: 16-21.
- Stortecky S, Buellesfeld L, Wenaweser P, et al: Fibrillazione atriale e stenosi aortica. Circ Cardiovasc Interv 2013; 6: 77-84.
- Kerola T, Eranti A, Aro AL, et al: Fattori di rischio associati al blocco atrioventricolare. JAMA Netw open 2019; 2: e194176.
- Franzone A, Windecker S: L’enigma dell’impianto di pacemaker permanente dopo l’impianto di valvola aortica transcatetere. Circ Cardiovasc Interv 2017; 10: 1-4.
- Roten L, Stortecky S, Scarcia F, et al: Conduzione atrioventricolare dopo l’impianto di valvola aortica transcatetere e la sostituzione chirurgica della valvola aortica. J Cardiovasc Electrophysiol 2012; 23: 1115-1122.
- Khounlaboud M, Flécher E, Fournet M, et al: Predittori e impatto prognostico del nuovo blocco di branca sinistra dopo la sostituzione chirurgica della valvola aortica. Arch Cardiovasc Dis Elsevier Masson SAS; 2017; 110: 667-675.
- Auffret V, Puri R, Urena M, et al: Disturbi della conduzione dopo la sostituzione transcatetere della valvola aortica: stato attuale e prospettive future. Circolazione 2017; 136: 1049-1069.
- Regueiro A, Altisent OAJ, Trigo M Del, et al: Impatto del blocco di branca sinistra di nuova insorgenza e dell’impianto di pacemaker permanente periprocedurale sugli esiti clinici dei pazienti sottoposti a sostituzione transcatetere della valvola aortica. Circ Cardiovasc Interv 2016; 9: 1-10.
- Ando T, Takagi H: L’impatto prognostico del blocco del fascio sinistro persistente di nuova insorgenza dopo l’impianto della valvola aortica transcatetere: una meta-analisi. Clin Cardiol 2016; 39: 544-550.
- Siontis GCM, Jüni P, Pilgrim T, et al: Predittori di impianto di pacemaker permanente in pazienti con stenosi aortica grave sottoposti a TAVR. J Am Coll Cardiol Elsevier Inc; 2014; 64: 129-140.
CARDIOVASC 2019; 18(5): 10-12