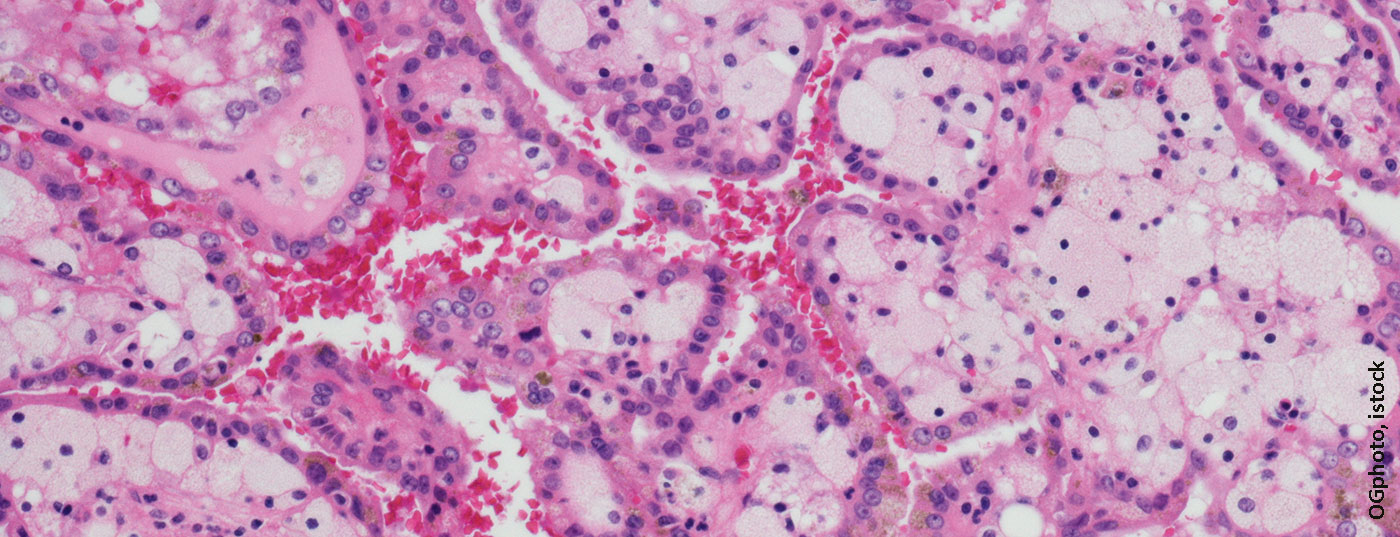
Il carcinoma a cellule renali è una delle entità tumorali piuttosto rare. Pertanto, le opzioni di trattamento sono state molto limitate per anni e la terapia è stata difficile. Nel frattempo, le opzioni potrebbero essere ampliate dagli inibitori della tirosin-chinasi. È ipotizzabile anche una terapia con inibitori del checkpoint.
Con una quota del 2,4% dei nuovi casi di cancro all’anno in Svizzera, il carcinoma a cellule renali è una delle entità tumorali più rare [1]. Il carcinoma renale a cellule chiare è il sottogruppo più grande di tutti i carcinomi a cellule renali, che rappresenta circa il 75% [2]. Importanti fattori di rischio per lo sviluppo di tumori renali sono il consumo di nicotina, l’obesità, l’esposizione professionale a solventi, petrolati ed erbicidi [3,4]. Circa il 2% di tutti i carcinomi a cellule renali sono associati a sindromi di predisposizione al tumore, come la malattia di von Hippel-Lindau [5].
Circa il 12% delle nuove diagnosi sono tumori metastatici primari dovuti alla presenza di metastasi a distanza [6]. Per molti anni, le opzioni terapeutiche per il carcinoma a cellule renali metastatico erano molto limitate e il trattamento era difficile. Nel 2007, per la prima volta, è stato dimostrato che il sunitinib come terapia di prima linea nel contesto metastatico, una sostanza del gruppo degli inibitori della tirosin-chinasi (TKI), prolunga la sopravvivenza libera da progressione (PFS) e aumenta il tasso di risposta rispetto all’interferone-alfa [7]. Poco più di 10 anni dopo, lo studio di fase III CheckMate-214 ha dimostrato la superiorità dell’inibitore del checkpoint (CPI) nivolumab in combinazione con l’inibitore CTLA-4 ipilimumab rispetto alla terapia standard sunitinib, utilizzata fino ad allora [8]. A questo studio sono seguiti altri studi – alcuni con CPI da solo o anche con terapie di combinazione con CPI e TKI (Fig. 1). Questo articolo ECM tratta esclusivamente il trattamento del carcinoma renale a cellule chiare in situazione metastatica.
Classificazione del rischio
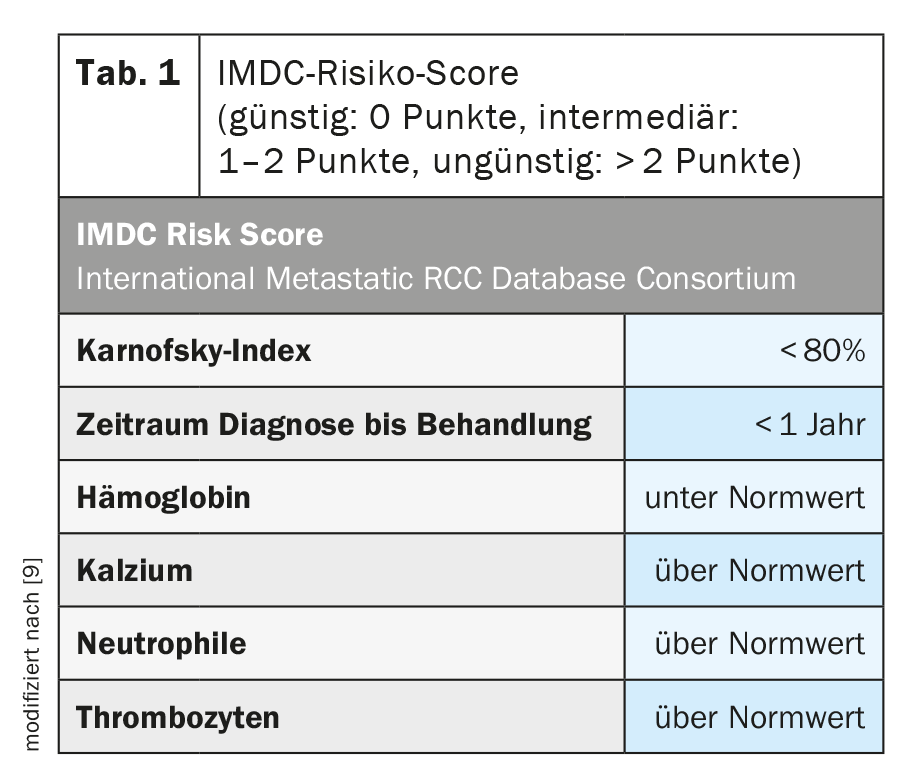
Per una migliore valutazione della situazione del tumore e della sua prognosi, è stata sviluppata una classificazione del rischio (Tab. 1) . In base al punteggio ottenuto nel punteggio di rischio IMDC, la malattia può essere classificata nei seguenti gruppi di rischio: favorevole, intermedio o sfavorevole. Questa classificazione non è solo importante per stimare la prognosi, ma è stata ed è anche inclusa negli studi clinici per la stratificazione e ha dimostrato di essere predittiva per gli interventi terapeutici. [10].
Terapia di prima linea
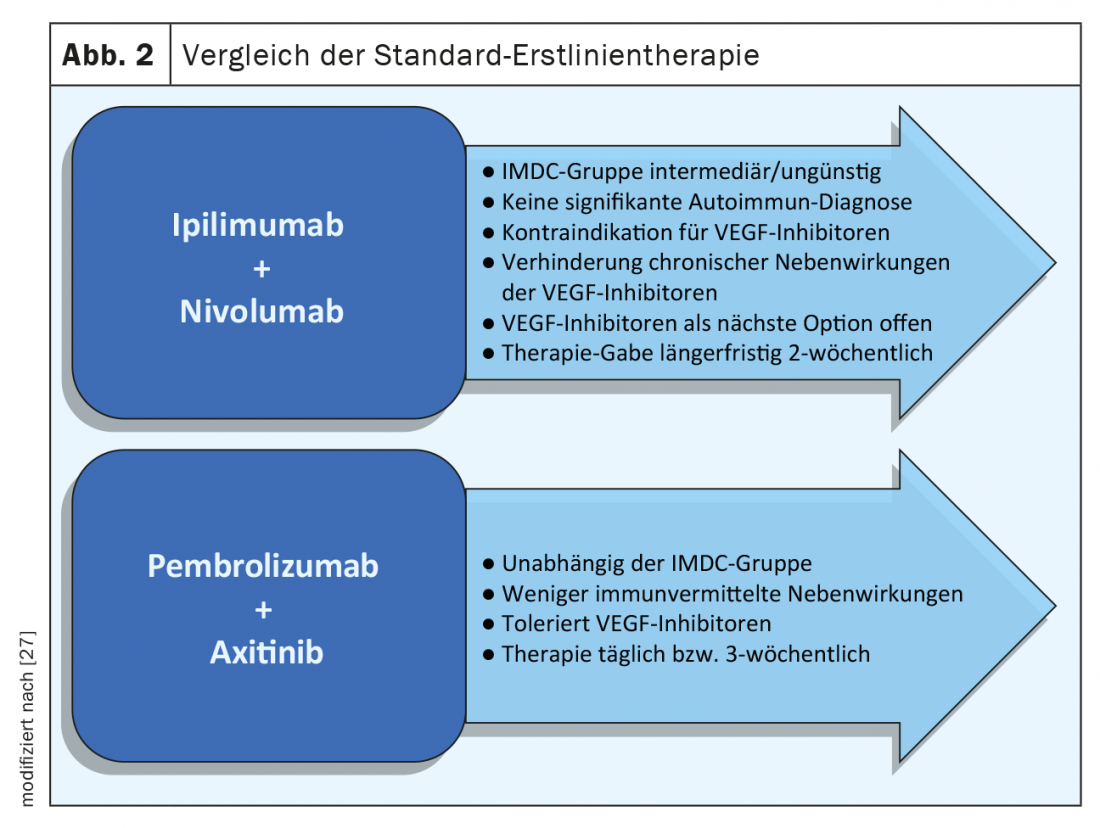
Il trattamento del carcinoma a cellule renali metastatico è cambiato in modo significativo negli ultimi anni, grazie all’uso di nuovi farmaci appartenenti a gruppi di sostanze conosciute (ad esempio, i TKI), ma anche grazie all’applicazione di nuove opzioni terapeutiche, come l’immunoterapia. Nel 2018, lo studio CheckMate-214 ha dimostrato un miglioramento del tasso di risposta obiettiva e della sopravvivenza globale (OS) con ipilimumab in combinazione con nivolumab rispetto a sunitinib. La OS è stata di 47 mesi nel braccio ipilimumab/nivolumab rispetto a 26,6 mesi nel braccio sunitinib, con un hazard ratio (HR) di 0,66 (p<0,0001) [11]. Questo effetto del trattamento è limitato nelle analisi ai pazienti con un rischio di IMDC intermedio o sfavorevole. In una costellazione di rischio favorevole, sunitinib mostra un tasso di risposta globale migliore e anche una migliore OS rispetto all’immunoterapia.
Sono seguiti ulteriori studi nella terapia di prima linea del carcinoma a cellule renali metastatico. Lo studio Keynote 426 ha confrontato la combinazione dell’inibitore PD-1 pembrolizumab e del TKI axitinib con il solo sunitinib. La combinazione terapeutica ha migliorato significativamente sia la OS che la PFS rispetto a sunitinib (p<0,001) [12]. Questi risultati sono stati osservati in tutti e tre i gruppi di rischio IMDC – favorevole, intermedio e sfavorevole .
In entrambi gli studi Checkmate-214 e Keynote-426, la remissione completa (CR) è stata osservata in circa il 9% degli approcci immunoterapici.
Al congresso ESMO di quest’anno, sono stati presentati i dati dello studio CheckMate 9ER, che confronta la terapia combinata nivolumab e cabozantinib rispetto a sunitinib, anche nella terapia di prima linea [13]. Nel processo, Choueiri et al. ha dimostrato che questa terapia combinata ha ottenuto un miglioramento significativo della PFS da 8,3 mesi (monoterapia con sunitinib) a 16,6 mesi (nivolumab + cabozantinib). È stata riscontrata anche una OS prolungata con un HR di 0,60. Il tasso di risposta obiettiva (ORR) è stato particolarmente impressionante, con il 55,7% nel braccio di combinazione rispetto al 27,1% con sunitinib. Il periodo di osservazione di 18 mesi ad oggi è ancora relativamente breve, per cui al momento non è ancora chiaro in che misura la risposta terapeutica sia a lungo termine.
Il confronto tra questi tre studi è difficile perché sono stati inclusi gruppi prognostici diversi e la distribuzione dei pazienti negli stessi era diversa. Anche i tempi di osservazione differiscono notevolmente. I regimi di CPI con combinazione di TKI (Keynote-426 e CheckMate 9ER) mostravano già una differenza nella sopravvivenza globale dopo un mese, mentre la combinazione ipilimumab e nivolumab mostrava una differenza solo dopo 6 mesi. Di conseguenza, la decisione terapeutica potrebbe ricadere su una terapia combinata con TKI anziché sulla sola immunoterapia in caso di pressione terapeutica elevata.
Per il trattamento di prima linea nel carcinoma a cellule renali metastatico, esistono anche dati di studi sul trattamento con avelumab in combinazione con axitinib (studio JAVELIN-Renal-101) [14]. Questo ha dimostrato una PFS prolungata rispetto a sunitinib, ma non ha mostrato questo beneficio nei dati di OS. In Svizzera non è stata richiesta l’approvazione per la combinazione avelumab + axitinib.
La terapia con un inibitore della tirosin-chinasi da solo rimane un’opzione in assenza di disponibilità o di controindicazioni a una delle nuove terapie di combinazione standard, soprattutto per i pazienti con rischio favorevole e dinamica della malattia molto lenta.
La sorveglianza attiva è possibile anche in pazienti ben selezionati, come dimostrato in una pubblicazione di Rini et al. La durata mediana dell’osservazione dei pazienti fino all’inizio della terapia sistemica è stata di 14,9 mesi [15].
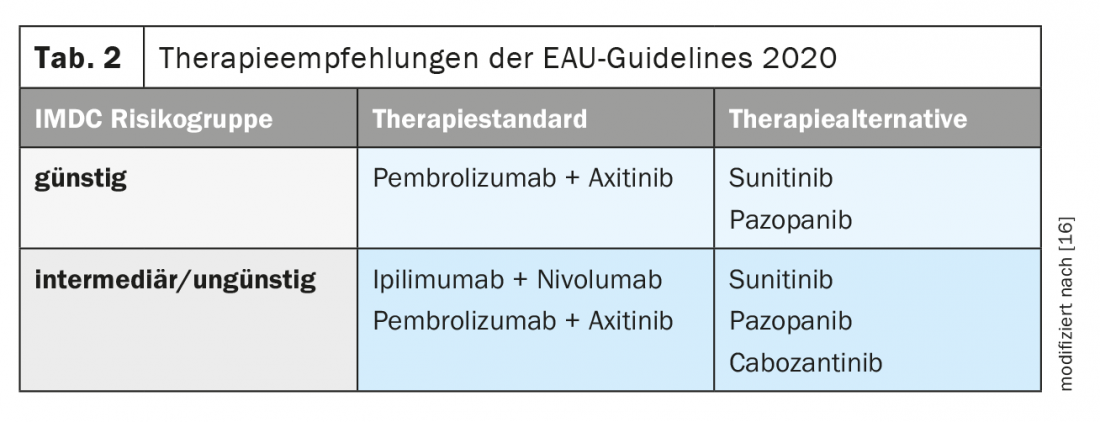
Nell’attuale linea guida sul carcinoma a cellule renali dell’Associazione Europea di Urologia (EAU), sono state registrate le raccomandazioni di trattamento (Tab. 2) [16].
Si attendono ancora i risultati dello studio di fase III CLEAR, che sta confrontando la combinazione di lenvatinib + everolimus o lenvatinib + pembrolizumab con il solo sunitinib come terapia di prima linea nel carcinoma a cellule renali metastatico, con un disegno a tre bracci. Lenvatinib e l’inibitore PD-1 hanno mostrato risultati promettenti nel carcinoma endometriale avanzato in uno studio pubblicato quest’anno [17].
Terapia di seconda linea
La scelta della classe di sostanze per la terapia di due linee dipende direttamente dalla terapia di prima linea già somministrata. Nello studio di fase III Checkmate-025, nivolumab è stato confrontato con everolimus dopo 1-2 precedenti terapie mirate VEGF. L’immunoterapia ha migliorato sia la OS che la qualità di vita. Anche la tossicità di grado 3/4 era meno frequente con nivolumab rispetto a everolimus (19% contro 37%). Non è stato osservato alcun miglioramento della PFS [18]. Un miglioramento paragonabile della OS, cioè di circa 5 mesi, è stato dimostrato anche con cabozantinib rispetto alla terapia con everolimus (studio Meteor) [19].
L’influenza della terapia di prima linea con gli inibitori del checkpoint sulle successive terapie di sistema non è chiara, poiché ad oggi non sono disponibili dati di studi randomizzati. Tuttavia, in Svizzera è in corso il reclutamento di uno studio di fase II (CaboPoint), in cui cabozantinib viene studiato come terapia di seconda linea – nella coorte A dopo la terapia di prima linea con ipiliumumab e nivolumab e nella coorte B in caso di progressione a una terapia combinata CPI e terapia mirata a VEGF.
Inoltre, in uno studio di fase III disponibile anche in Svizzera, la molecola MK-6482 PN011 – un inibitore di HIF-2α – viene confrontata con cabozantinib in combinazione con lenvatinib come terapia di due linee. L’HIF, come fattore indotto dall’ipossia, è coinvolto nell’espressione dei fattori di crescita VEGF.
All’ASCO 2020 sono stati presentati i dati di uno studio di fase II su lenvatinib + pembrolizumb dopo la progressione della terapia con PD-1/PD-L1 CPI. L’ORR dopo 24 settimane è stato del 55% (irRECIST secondo la valutazione dello sperimentatore), la PFS di 11,7 mesi. Questo trattamento appare quindi promettente anche dopo una precedente immunoterapia [20].
Profilo degli effetti collaterali
A causa dei diversi meccanismi d’azione delle classi di sostanze utilizzate nel carcinoma a cellule renali metastatico, esistono anche diversi profili di effetti collaterali. Nel caso delle immunoterapie, si tratta dei cosiddetti effetti collaterali immuno-mediati, per cui sono possibili reazioni negli organi più diversi e gli effetti collaterali possono talvolta essere anche gravi. È fondamentale conoscerli, riconoscerli e trattarli precocemente. Soprattutto gli effetti collaterali rari, come la miocardite e la neurotossicità, devono essere presi in considerazione [21,22]. La somministrazione di immunoterapie e l’ulteriore assistenza al paziente devono essere effettuate da un’équipe di medici esperti, per cui di solito è opportuno un approccio interdisciplinare. Lo studio CheckMate-214 ha dimostrato che la qualità della vita correlata alla salute era migliore nei pazienti trattati con ipilimumab + nivolumab rispetto al solo sunitinib [23]. Di conseguenza, l’incidenza di eventi avversi di grado 3/4 è stata maggiore con sunitinib. Gli effetti collaterali più comuni dei TKI includono diarrea, tossicità cutanea, affaticamento e possibili alterazioni ematologiche e cardiache.
Oltre alle diverse classi di sostanze, ci sono anche differenze nell’applicazione e negli intervalli terapeutici. Mentre ipilimumab/nivolumab viene sostituito da nivolumab da solo dopo tre mesi, le terapie combinate CPI e TKI comportano l’assunzione continua di compresse con una terapia infusionale aggiuntiva, di cui bisogna considerare le tossicità a lungo termine. La terapia in compresse è facilmente controllabile e gli effetti collaterali sono di solito rapidamente reversibili dopo l’interruzione (Fig. 2) . Per supportare i pazienti e migliorare l’aderenza e la sicurezza, si possono utilizzare gli opuscoli della Società Svizzera di Oncologia Medica (SGMO) e di Oncology Care Switzerland (OPS) [24].
Marcatori molecolari
I marcatori molecolari potrebbero aiutare a fare la scelta terapeutica migliore tra le tante opzioni di trattamento. Tuttavia, a parte il punteggio di rischio IMDC, non esiste un marcatore predittivo riconosciuto che possa essere utilizzato nel processo decisionale.
Secondo i dati di Checkmate-214, l’espressione di PD-L1 sembra essere importante per la risposta alla terapia con ipilimumab/nivolumab (espressione di PD-L1 <1%: ORR 37%; espressione di PD-L1 ≥1%: ORR 54%) e per la PFS (espressione di PD-L1 <1%: PFS 11 mesi; espressione PD-L1 ≥1%: PFS 22,8 mesi predittiva [10]. Tuttavia, non c’era alcuna differenza in termini di OS. Pertanto, l’importanza di -PD-L1 continua ad essere controversa. Nello studio Keynote-426 e nello studio CheckMate-9ER, finora non è stata osservata alcuna correlazione tra il livello di espressione di PD-L1 e la risposta alla terapia.
Lo studio IMmotion151 ha confrontato atezolizumab/bevacizumab con sunitinib [25]. Inoltre, sono state effettuate diverse analisi dei biomarcatori, ma non è stato possibile dimostrare alcuna correlazione tra la PFS e il “carico mutazionale del tumore” (TMB). Tuttavia, è stato dimostrato che specifiche firme di espressione genica sono associate agli effetti del trattamento. Per esempio, il rilevamento di una firma di angiogenesi si è correlato con la risposta a sunitinib. Al contrario, una firma T-effector ha mostrato un beneficio dell’immunoterapia con atezolizumab [26]. Nello studio BIONIKK, uno studio prospettico randomizzato di fase II presentato all’ESMO di quest’anno, sono stati analizzati diversi gruppi molecolari in relazione alla risposta terapeutica alle diverse sostanze terapeutiche. Questo ha dimostrato una migliore risposta dei tumori “immuno-alti” all’immunoterapia con nivolumab e dei tumori “angio-alti” alla terapia con TKI. Queste indagini molecolari sembrano promettenti e probabilmente saranno disponibili in futuro per aiutare nella scelta della terapia.
Oltre a questi marcatori molecolari del tumore, attualmente vengono presi in considerazione anche i fattori legati al paziente, come l’età, le comorbidità e le preferenze, nella decisione di trattamento.
Messaggi da portare a casa
- L’attuale standard terapeutico nella terapia di prima linea del carcinoma renale metastatico a cellule chiare è pembrolizumab/auxinib per tutti i gruppi di rischio e ipilimumab/nivolumab per i pazienti con rischio intermedio o sfavorevole (IMDC).
- La sorveglianza attiva può essere eseguita in pazienti selezionati e la monoterapia con un inibitore della tirosin-chinasi può essere presa in considerazione se il rischio è favorevole.
- Ci sono nuovi dati per nivolumab in combinazione con cabozantinib, anche se manca ancora l’approvazione in Svizzera.
- Il profilo degli effetti collaterali dei vari farmaci è diverso e può essere decisivo per la scelta della terapia.
- Gli studi sulle firme di espressione genica mostrano risposte terapeutiche diverse e sono promettenti.
Letteratura:
- Krebsliga Schweiz: Il cancro in Svizzera: figure importanti. Stato marzo 2020. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Linehan WM, et al. Clin Cancer Res. 2007; 13: 671s-679s.
- Gelfond J, et al.: Fattori di rischio modificabili per ridurre l’incidenza del carcinoma a cellule renali: intuizioni dallo studio PLCO. Urol Oncol, 2018. 36(7): 340.e1-340.e6.
- McLaughlin JK, Lipworth L: Aspetti epidemiologici del cancro a cellule renali. Semin Oncol, 2000. 27(2): 115-123.
- Shuch B, Zhang J: Predisposizione genetica al carcinoma a cellule renali: implicazioni per la consulenza, i test, lo screening e la gestione. J Clin Oncol, 2018: Jco2018792523.
- Siegel RL, Miller KD, Jemal A: Statistiche sul cancro, 2020. CA Cancer J Clin, 2020. 70(1): 7-30.
- Motzer RJ, et al: Sunitinib rispetto all’interferone alfa nel carcinoma a cellule renali metastatico. N Engl J Med, 2007. 356(2): 115-124.
- Motzer RJ, et al: Nivolumab più ipilimumab rispetto a sunitinib nel carcinoma a cellule renali avanzato. N Engl J Med, 2018. 378(14): 1277-1290.
- Heng DY, et al: Fattori prognostici per la sopravvivenza globale nei pazienti con carcinoma a cellule renali metastatico trattati con agenti mirati al fattore di crescita endoteliale vascolare: risultati di un ampio studio multicentrico. J Clin Oncol, 2009. 27(34): 5794-5799.
- Méjean A, et al: Sunitinib da solo o dopo la nefrectomia nel carcinoma a cellule renali metastatico. N Engl J Med, 2018. 379(5): 417-427.
- Motzer RJ, et al: Nivolumab più ipilimumab rispetto a sunitinib nel trattamento di prima linea del carcinoma a cellule renali avanzato: follow-up esteso dei risultati di efficacia e sicurezza di uno studio di fase 3 randomizzato e controllato. Lancet Oncol, 2019. 20(10): 1370-1385.
- Rini BI, et al: Pembrolizumab più axitinib rispetto a sunitinib per il carcinoma a cellule renali avanzato. N Engl J Med, 2019. 380(12): 1116-1127.
- Choueiri TK: 696O_PR- Nivolumab + cabozantinib vs sunitinib nel trattamento di prima linea del carcinoma a cellule renali avanzato: primi risultati dello studio randomizzato di fase 3 CheckMate 9ER. 2020: ESMO.
- Motzer RJ, et al: Avelumab più axitinib rispetto a sunitinib per il carcinoma a cellule renali avanzato. N Engl J Med, 2019. 380(12): 1103-1115.
- Rini BI, et al: Sorveglianza attiva nel carcinoma a cellule renali metastatico: studio prospettico di fase 2. Lancet Oncol, 2016. 17(9): 1317-1324.
- Ljungberg, Linee guida EAU sul carcinoma a cellule renali. 2020: https://uroweb.org/guideline/renal-cell-carcinoma.
- Makker V, et al: Lenvatinib più Pembrolizumab nelle pazienti con cancro endometriale avanzato. J Clin Oncol, 2020. 38(26): 2981-2992.
- Motzer RJ, et al: Nivolumab rispetto a everolimus nel carcinoma a cellule renali avanzato. N Engl J Med, 2015. 373(19): 1803-1813.
- Choueiri TK, et al: Cabozantinib rispetto a everolimus nel carcinoma a cellule renali avanzato. N Engl J Med, 2015. 373(19): 1814-1823.
- Chung-Han L: Studio di fase II di lenvatinib (LEN) più pembrolizumab (PEMBRO) per la progressione della malattia dopo l’inibitore del checkpoint immunitario PD-1/PD-L1 (ICI) nel carcinoma a cellule renali chiare metastatico (mccRCC). 2020: Journal of Clinical Oncology.
- Bonaca MP, et al: Miocardite nel contesto di terapie antitumorali: definizioni di casi proposte per sindromi cliniche emergenti in cardio-oncologia. Circolazione, 2019. 140(2): 80-91.
- Astaras C, et al: Eventi avversi neurologici associati agli inibitori del checkpoint immunitario: diagnosi e gestione. Curr Neurol Neurosci Rep, 2018. 18(1): 3.
- Cella D, et al: Esiti riferiti dal paziente dei pazienti con carcinoma a cellule renali avanzato trattati con nivolumab più ipilimumab rispetto a sunitinib (CheckMate 214): uno studio randomizzato, di fase 3. Lancet Oncol, 2019. 20(2): 297-310.
- https://oraletumortherapie.ch.
- Rini BI, et al: Atezolizumab più bevacizumab rispetto a sunitinib in pazienti con carcinoma a cellule renali metastatico non trattato in precedenza (IMmotion151): uno studio multicentrico, in aperto, di fase 3, randomizzato e controllato. Lancet, 2019. 393(10189): 2404-2415.
- McDermott DF, et al: Attività clinica e correlati molecolari della risposta ad atezolizumab da solo o in combinazione con bevacizumab rispetto a sunitinib nel carcinoma a cellule renali. Nat Med, 2018. 24(6): 749-757.
- Heng DY: ASCO 2020.
InFo ONCOLOGIA ED EMATOLOGIA 2020; 8(6): 6-9