Le infezioni acute attivano diversi meccanismi infiammatori e procoagulatori e sono considerate fattori di rischio transitori per il tromboembolismo venoso (TEV). Anche le infezioni non associate alla degenza a letto e all’ospedalizzazione aumentano il rischio di TEV. La struttura di causa-effetto è complessa. Per valutare il rischio di trombosi nei pazienti con infezioni, si possono usare le “bandiere rosse” come guida. Per quanto riguarda i pazienti infetti con fibrillazione atriale, l’anticoagulazione è indicata se non c’è una tendenza specifica al sanguinamento.
In base alle conoscenze attuali, le infezioni sono associate ad un aumento del rischio paragonabile a quello dei fattori di rischio tradizionali, che notoriamente includono operazioni importanti negli ultimi tre mesi, immobilizzazione di almeno tre giorni o una malattia tumorale attiva negli ultimi sei mesi, spiega il Prof. Philip Tarr, MD, Kantonsspital Baselland, Bruderholz [1]. Sebbene le infezioni non siano ancora incluse nei punteggi diagnostici per determinare la probabilità clinica pre-test, la loro associazione con il tromboembolismo venoso (TEV) è ben documentata in letteratura [1].
Aumento del rischio di TEV dopo infezioni respiratorie o delle vie urinarie.
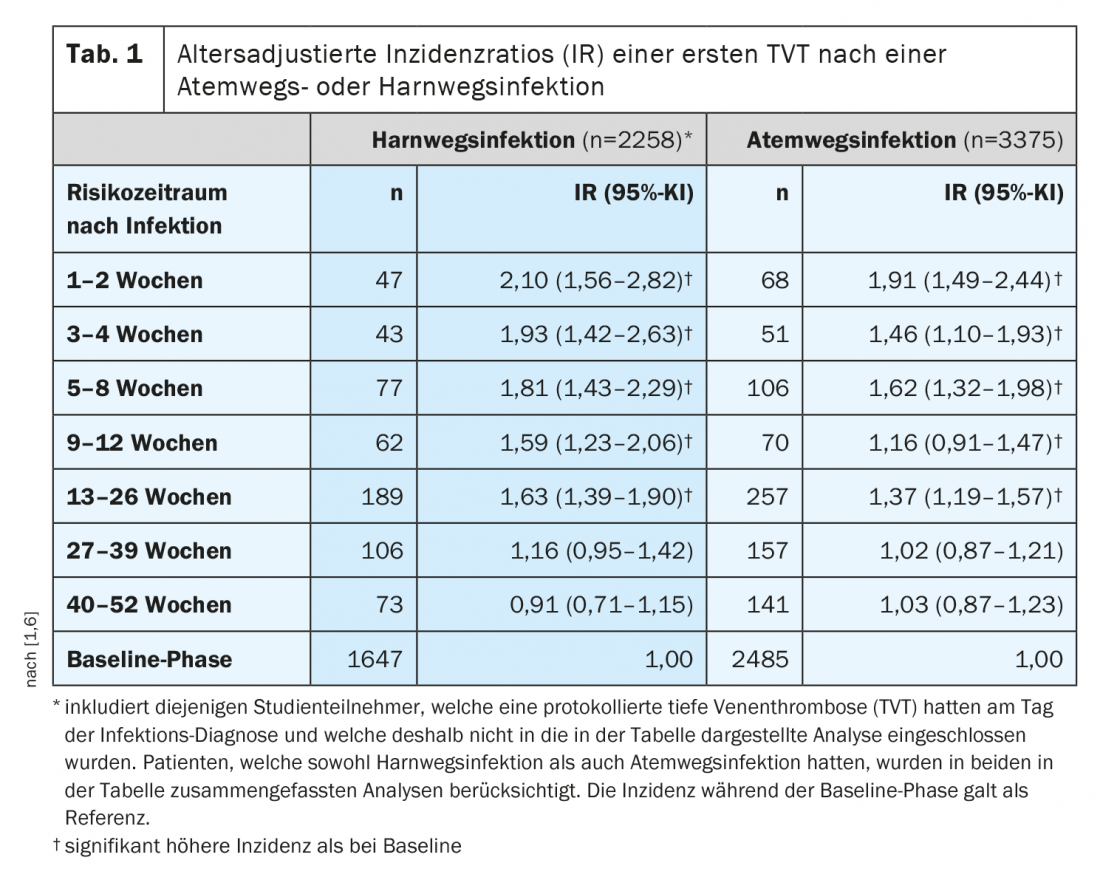
I pazienti ospedalizzati con un’infezione hanno un rischio circa doppio di TEV rispetto ai pazienti ospedalizzati senza infezione [1]. Anche le infezioni banali che non comportano il ricovero a letto e l’ospedalizzazione aumentano il rischio di TEV, ad esempio le infezioni respiratorie e le infezioni del tratto urinario, che colpiscono ogni anno diverse centinaia di migliaia di persone in Svizzera. “Il rischio di tromboembolia è più alto nelle prime 1-2 settimane dopo un’infezione, ma – e questo è entusiasmante – l’aumento del rischio di trombosi persiste per diversi mesi, fino a mezzo anno dopo un’infezione – almeno statisticamente”, ha detto il relatore. Si ritiene che un rischio da 2 a 5 volte maggiore di TEV persista per circa 2-4 settimane dopo una semplice infezione delle vie respiratorie o urinarie [1,6]. Sebbene questo rischio diminuisca nel tempo, rimane elevato per 6-12 mesi dopo l’infezione sia nei pazienti ospedalizzati che in quelli non ospedalizzati, secondo le analisi scientifiche (Tab. 1) [1].
Riconoscere i segnali di allarme: quali pazienti infettivi sono particolarmente a rischio?
Un’associazione tra l’infiammazione e la tendenza alla trombosi sembra plausibile, ma il ruolo della CRP non è ancora stato completamente chiarito (riquadro) [2]. Per quanto riguarda il D-dimero, il Prof. Tarr sconsiglia la determinazione di routine, in quanto spesso si verifica un’elevazione. Tuttavia, un D-dimero normale è un buon argomento contro la TVP/LE [1]. Il relatore ha riassunto le “bandiere rosse” relative alla trombosi venosa profonda/embolia polmonare nei pazienti infettivi come segue [1]:
- Dispnea/dolore toracico
- Differenza circonferenziale dell’estremità (anche braccio con catetere venoso centrale, porta, linea picc)
- Se il decorso clinico è più coerente con la TVP/LE e non con la (sospetta) infezione
- Se la febbre non si attenua, nonostante un’adeguata terapia antibiotica
- In caso di febbre senza una causa identificabile
- Erysipelas: la TVP è presente nel 2-3% dei casi.
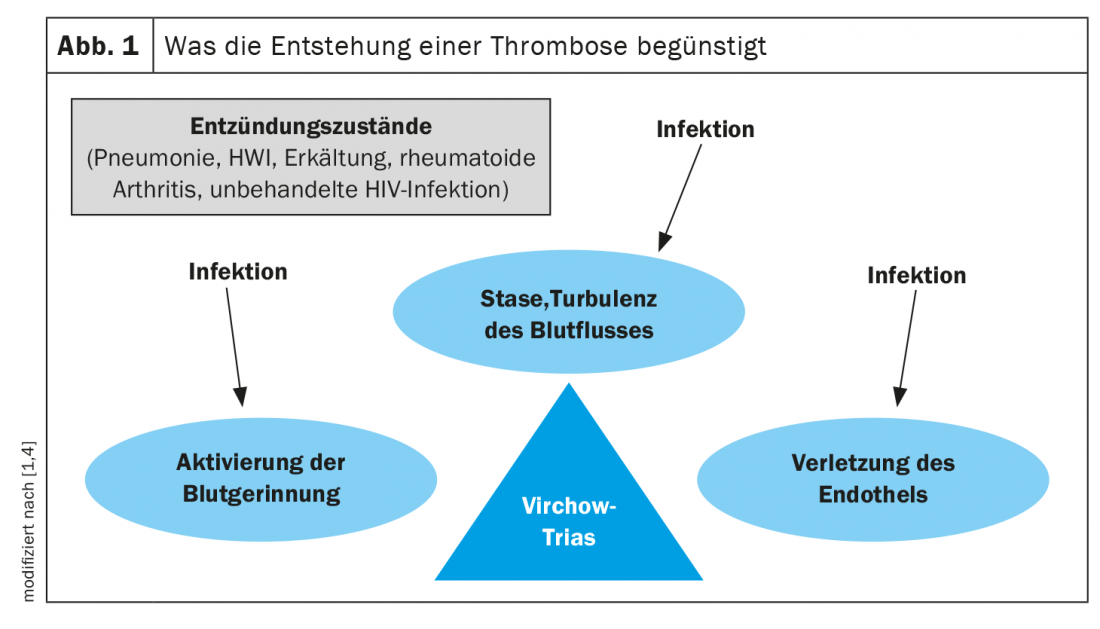
Patomeccanismi: triade di Virchow
Il rapporto causa-effetto tra infezione e trombosi è estremamente complesso. È noto che l’infezione acuta attiva diversi meccanismi infiammatori e procoagulatori [1–3]. La famosa triade di Rudolf Virchow afferma che la trombosi è promossa da tre fattori: Attivazione della coagulazione del sangue (ipercoagulabilità), stasi venosa e lesioni endoteliali (Fig. 1) [1,2,4]. Questi meccanismi sono influenzati dalle infezioni. Così, uno stato infiammatorio attiva diverse proteine di fase acuta della cascata della coagulazione, che hanno un effetto procoagulatorio e quindi aumentano il rischio di trombosi. Questi includono, ad esempio, CRP, fibrinogeno, fattore VIII, interleuchina-6 e fattore von Willebrand (vWF) [1,2]. Non è del tutto chiaro se l’infiammazione locale o sistemica legata all’infezione giochi un ruolo chiave e se batteri specifici (ad esempio S. aureus o bastoncini gram-negativi) aumentino particolarmente il rischio di TEV [2,5]. Gli anticorpi antifosfolipidi (aPL), raramente scatenati da infezioni e più frequentemente da malattie autoimmuni come il lupus eritematoso, sono anche associati al verificarsi di trombosi e sono un fattore scatenante della cosiddetta sindrome antifosfolipidica (APS) [2]. Inoltre, alcune tossine batteriche e infezioni virali come SARS-CoV-2, citomegalovirus o virus di Epstein-Barr possono danneggiare l’endotelio [2]. I fattori di rischio di TEV, come l’immobilizzazione, l’età, la malattia tumorale o l’immunosoppressione, aumentano ulteriormente il rischio di infezione [2].
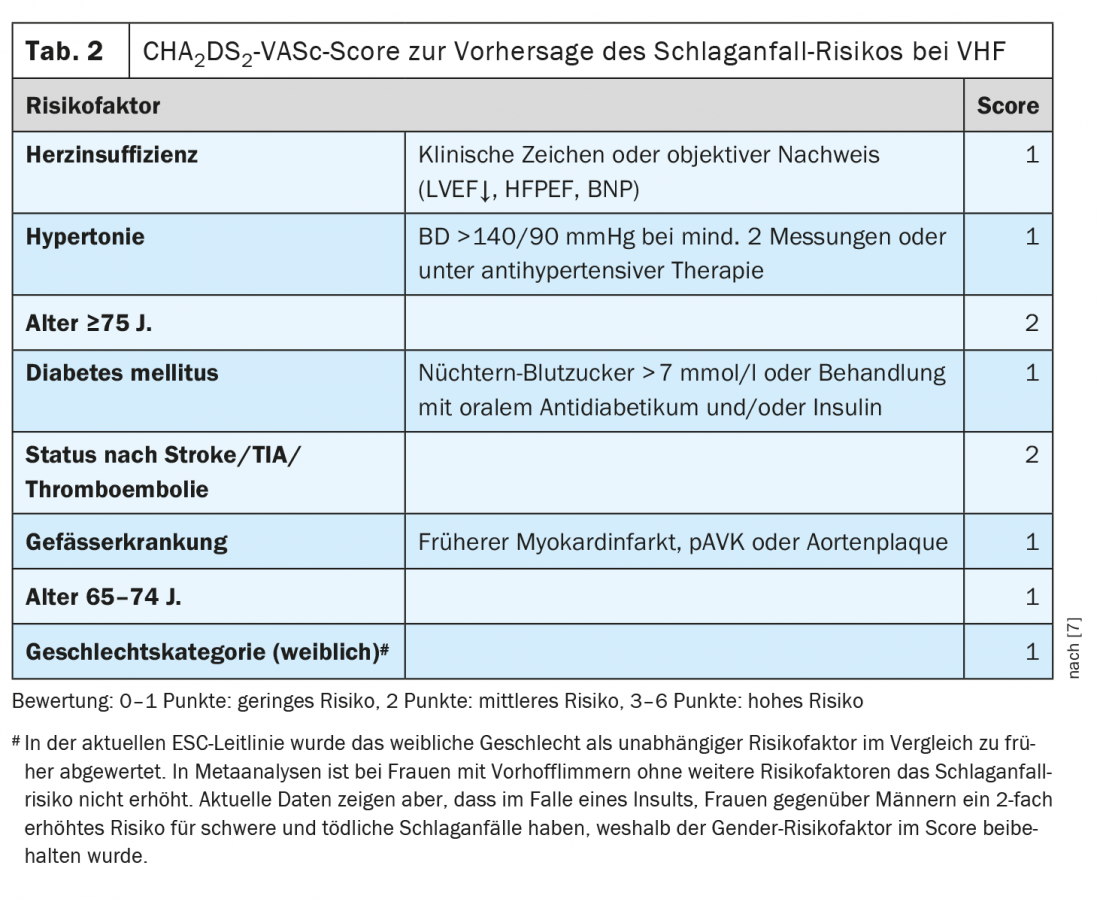
Anticoagulazione nei pazienti infettivi con fibrillazione atriale
“La polmonite è associata a un evento cardiovascolare in circa 1 paziente su 5”, sottolinea il relatore [1]. Può trattarsi di una sindrome coronarica (acuta) o di un attacco cardiaco, ma può anche verificarsi un’aritmia di nuova insorgenza (soprattutto la fibrillazione atriale) o uno scompenso in un’insufficienza cardiaca nota. “La polmonite porta a meccanismi procoagulatori che vengono attivati dall’infiammazione”, spiega il Prof. Tarr [1]. Gli eventi cardiovascolari nella polmonite sono spesso trascurati e sono associati a un aumento della mortalità. Il rischio di sindrome coronarica acuta (SCA) aumenta proporzionalmente all’aumentare della gravità della polmonite, ma aumenta anche con un decorso lieve della polmonite nell’arco di diverse settimane o mesi. L’associazione con l’ACS è documentata non solo per la polmonite, ma anche per l’influenza, le infezioni del tratto urinario e la batteriemia. Anche le infezioni possono scatenare la fibrillazione atriale. Questo aumenta il rischio di ictus embolico. Questo ha implicazioni terapeutiche. “Se un paziente entra in fibrillazione atriale nel contesto di una polmonite: si tratta ora di una fibrillazione atriale provocata che deve essere anticoagulata solo per un breve periodo?”. Dal punto di vista odierno, la risposta è “purtroppo no”, afferma il Prof. Tarr. “Dovremmo ignorare l’infezione come causa scatenante della fibrillazione atriale”, aggiunge il docente e aggiunge: “Il fatto che la fibrillazione atriale si sia verificata a causa di una causa scatenante infettiva indica che l’atrio è malato/dilatato. Nel contesto dell’infezione, dell’infiammazione e degli sbalzi elettrolitici, può verificarsi un’alterazione dell’attività parasimpatica o simpatica, che alla fine scatena la fibrillazione atriale” [1]. A seconda del punteggio CHA2DS2-VASc, le linee guida ESC e AHA raccomandano l’anticoagulazione a vita in caso di fibrillazione atriale (tab. 2) [1,7–9]. A quanto pare, esiste una predisposizione alla fibrillazione atriale e, secondo le conoscenze attuali, il rischio di ictus embolico nella fibrillazione atriale parossistica innescata da infarto è paragonabile a quello della fibrillazione atriale permanente [1].
Fonte: Congresso medico di Davos
Letteratura:
- Tarr P: Infezione e trombosi: Folie à deux. Prof. Philip Tarr, MD. Congresso medico Davos, 10-11.02.2022
- Pfister T, et al.: Infezione e trombosi, parte 1: Contesto. Prim Hosp Care Allg Inn Med 2021; 21(04): 125-130.
- Riva N, Donadini MP, Ageno W: Epidemiologia e fisiopatologia del tromboembolismo venoso: analogie con l’aterotrombosi e ruolo dell’infiammazione. Thromb Haemost 2015; 113(6): 1176-1183.
- Bagot CN, Arya R: Virchow e la sua triade: una questione di attribuzione. British Journal of Haematology 2008; 143(2): 180-190.
- White RH: Identificare i fattori di rischio per il tromboembolismo venoso. Circolazione 2012; 125(17): 2051-2053.
- Smeeth L, et al: Rischio di trombosi venosa profonda ed embolia polmonare dopo un’infezione acuta in un contesto comunitario. Lancet 2006; 367(9516): 1075-1079.
- Rosemann A: Fibrillazione atriale, 11/2018, www.medix.ch/media/gl_vorhofflimmern_2018_31.10.19_mh.pdf, (ultimo accesso 28.03.2022).
- Kirchhof P, et al: European Heart Journal. 2016 Oct 7;37(38): 2893-2962.
- January CT, et al: Circulation 2019 Jul 9; 140(2).
HAUSARZT PRAXIS 2022; 17(4): 36-37 (pubblicato il 6.4.22, prima della stampa).