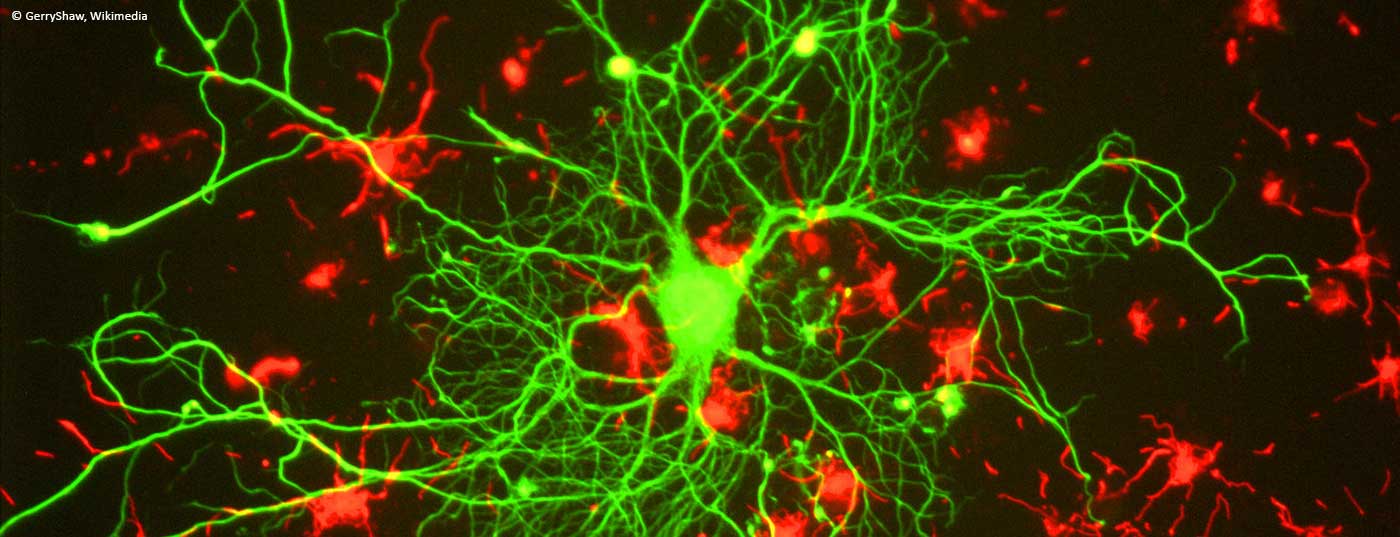
Le paranodopatie sono una nuova forma speciale di polineuropatie infiammatorie mediate da un danno indotto da autoanticorpi all’anello di Ranvier. Quali sono le caratteristiche di questa malattia e come può essere trattata?
Le polineuropatie sono un gruppo eterogeneo di malattie che derivano da un danno all’assone o alla guaina mielinica dei nervi periferici. Anche se la causa rimane poco chiara in circa il 25% di tutte le polineuropatie, la differenziazione eziologica è essenziale nella pratica clinica [1,2]. In questo modo, si possono identificare le cause trattabili e offrire terapie specifiche, soprattutto per le neuropatie immunitarie. Oltre all’anamnesi, all’esame e alla diagnostica di laboratorio, la diagnostica di base comprende l’elettroneurografia, che può distinguere tra un modello assonale e demielinizzante, e l’ecografia nervosa. Negli ultimi anni, è stata descritta la nuova entità delle paranodopatie, che non possono essere assegnate al concetto classico di “assonale” e “demielinizzante” [3–5]: qui, l’anello di Ranvier rappresenta il punto di partenza della malattia. Gli autoanticorpi paranodali sono biomarcatori preziosi nelle neuropatie immunitarie, poiché le paranodopatie si differenziano dalle altre neuropatie immunitarie in termini di risposta alla terapia.
Neuropatie infiammatorie
Le neuropatie infiammatorie comprendono le neuropatie infettive, che sono rare in Europa centrale, e le neuropatie autoimmuno-mediate che, con una prevalenza di circa il 10%, sono la terza causa più comune di tutte le polineuropatie dopo le polineuropatie diabetiche ed etiliche [2,6]. I principali rappresentanti delle forme demielinizzanti sono la sindrome di Guillain-Barré acuta (GBS), la polineuropatia demielinizzante infiammatoria cronica (CIDP) e la neuropatia motoria multifocale (MMN). In queste malattie, la guaina mielinica viene danneggiata dai processi immunitari umorali e cellulari, e la distruzione assonale può avvenire in seconda battuta. Nella neuropatia vasculitica, invece, si verifica un danno assonale ischemico dovuto al coinvolgimento per lo più isolato dei vasa nervorum. Per la diagnosi differenziale delle neuropatie immunitarie, sono determinanti il decorso, il modello di distribuzione, la diagnostica di laboratorio e, soprattutto, l’elettrofisiologia e la biopsia del nervo. L’esatta differenziazione è particolarmente importante per quanto riguarda le diverse opzioni terapeutiche (tab. 1).
Il paranodio come punto di partenza di rare neuropatie immunitarie
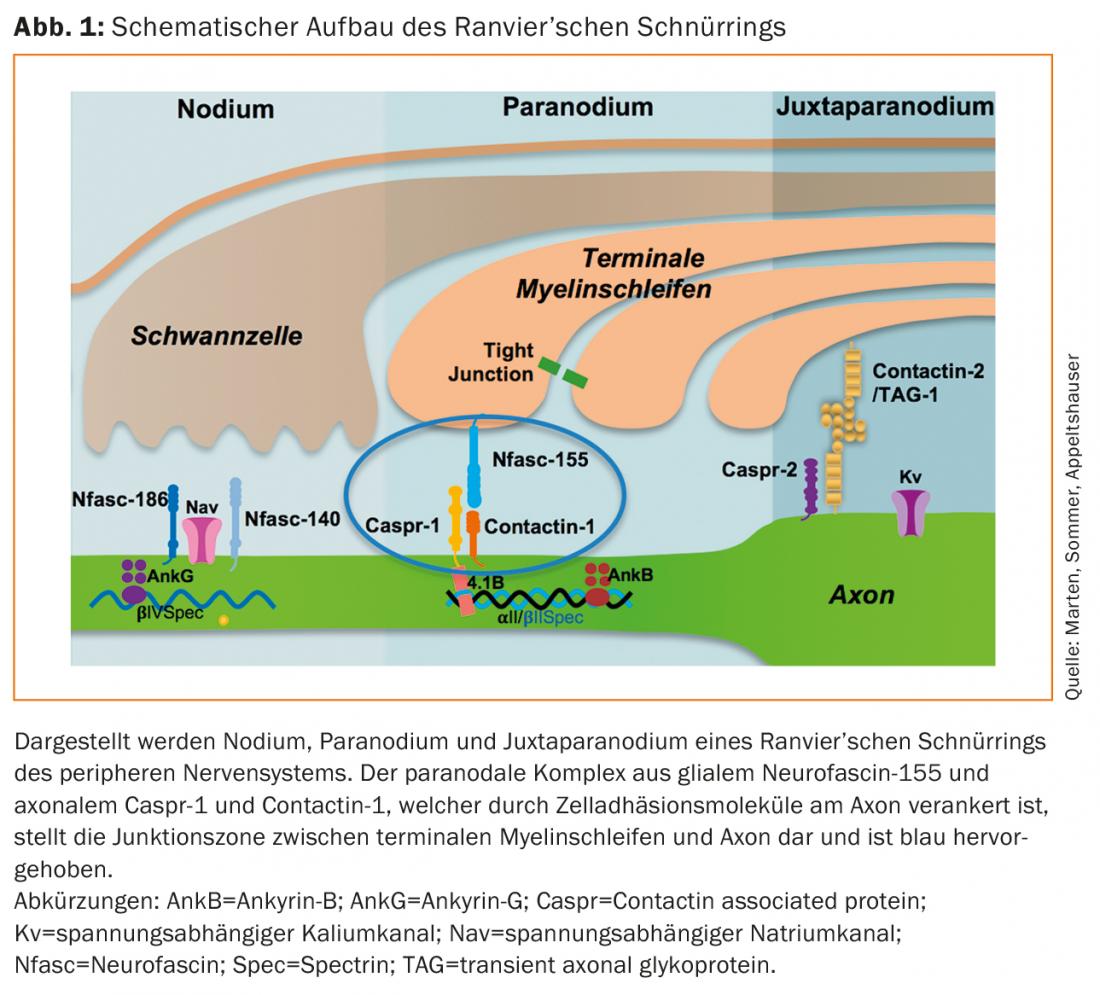
L’anello cordonale di Ranvier dei nervi mielinizzati periferici è suddiviso in tre sezioni (Fig. 1). Nel nodulo, i canali del sodio voltaggio-dipendenti, responsabili della trasmissione dell’eccitazione salina, sono raggruppati dalla neurofascina-186 [7]. Questa regione è fiancheggiata dal paranodio, dove le anse di mielina terminali giacciono liberamente intorno all’assone. Il complesso proteico della neurofascina gliale-155 e della contattina assonale-1 e caspr-1 collega qui la mielina e l’assone ed è fondamentale per mantenere l’architettura nodale e le normali velocità di conduzione nervosa [8,9]. Lateralmente, i canali del potassio voltaggio-gettati sono concentrati nel juxtaparanodium da un complesso proteico di contactin-2 e caspr-2 [10].
Diversi studi istopatologici descrivono un’alterazione dell’architettura dell’anello di allacciatura in varie polineuropatie [11–13]. Negli ultimi anni, nei pazienti con neuropatie immunitarie sono stati descritti autoanticorpi IgG e più recentemente autoanticorpi IgM contro le proteine paranodali neurofascina-155, contactina-1 e caspr-1 [14–20]. La maggior parte sono autoanticorpi della sottoclasse IgG indipendente dal complemento 4, ma nei pazienti in fase acuta della malattia sono stati descritti anche autoanticorpi IgG3, che possono legare e attivare il complemento in vitro [16,21]. Elettrofisiologicamente, queste neuropatie immunitarie mediate da autoanticorpi possono soddisfare i criteri della CIDP o della GBS, ma non istopatologicamente. In questo caso, non c’è una de- e rimielinizzazione macrofago-dipendente, ma un danno assonale (secondario) e il distacco delle anse mieliniche terminali dall’assone paranodale, così come l’allungamento dei noduli e la dispersione delle proteine paranodali e dei canali ionici [14,16,22,23]. Questa interruzione architettonica dell’anello di Ranvier è ritenuta responsabile dei blocchi di conduzione e delle velocità di conduzione nervosa prolungate nelle paranodopatie [5,24]. I modelli di trasferimento passivo confermano la distruzione paranodale e i blocchi di conduzione in vivo dopo l’iniezione di autoanticorpi anti-contattino-1 IgG4 e anti-neurofascina-155 IgG [25,26]. Il punto di partenza della malattia non è quindi la guaina mielinica, ma l’anello midollare, motivo per cui non è possibile assegnare le classiche categorie “assonale” o “demielinizzante”. Pertanto, il termine “paranodopatia”, che originariamente si riferiva alle neuropatie immunitarie associate agli autoanticorpi anti-ganglioside, è stato ora stabilito per riferirsi specificamente alle neuropatie immunitarie con autoanticorpi paranodali [3,4,22,27].
Caratteristiche cliniche, diagnostica e terapia
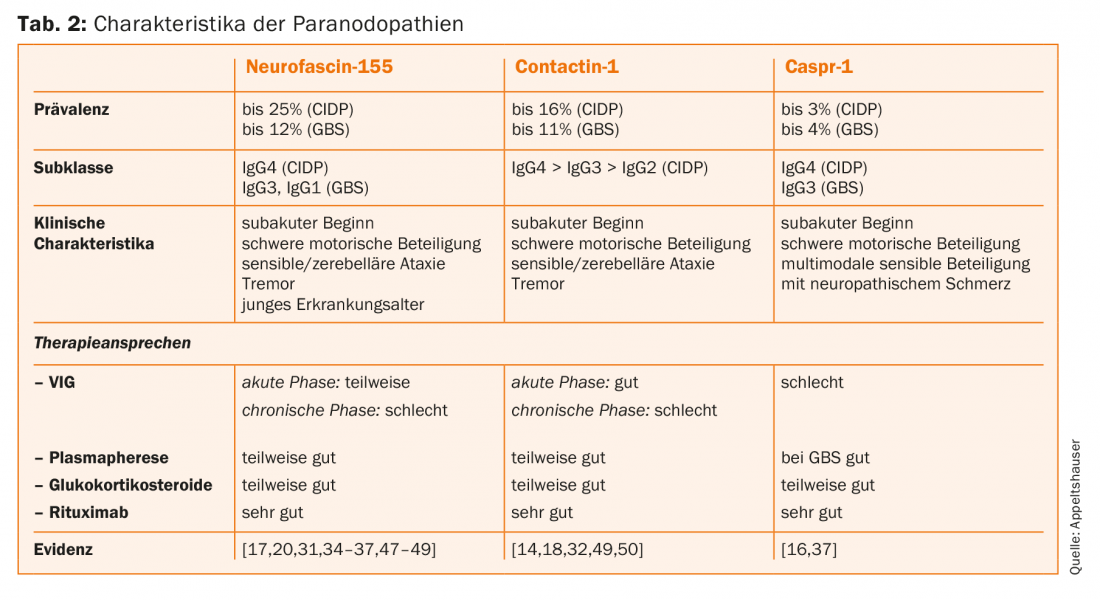
Gli autoanticorpi paranodali sono stati identificati finora quasi esclusivamente nei pazienti con il quadro clinico della CIDP e della GBS. Le prevalenze sono di solito intorno a <10% [28–30]. I pazienti affetti mostrano un esordio acuto o subacuto della malattia e sviluppano un grave coinvolgimento motorio. Inoltre, un tremore pronunciato e un’atassia sensoriale possono aggravare il decorso clinico [31,32]. Gli anticorpi IgG4 contro la neurofascina-155 hanno la più alta prevalenza [33]. In questi pazienti sieropositivi, sono stati descritti anche focolai di demielinizzazione centrale, tremore e atassia cerebellare come possibili segni di danno centrale mediato da autoanticorpi. Il pato-meccanismo e la prevalenza degli autoanticorpi anti-neurofascina-155 IgG nei pazienti con coinvolgimento centrale e periferico clinicamente combinato non sono stati sufficientemente studiati e sono discussi in modo controverso nella letteratura [30,33–36]. Raramente sono stati rilevati autoanticorpi contro Caspr-1, ma sono stati descritti autoanticorpi IgG4 in pazienti con decorso cronico e autoanticorpi IgG3 in un paziente con GBS [16,37]. Il dolore neuropatico è stato proposto come una caratteristica comune con una correlazione istopatologica, ossia il legame degli autoanticorpi ai neuroni dei gangli spinali nocicettivi. Tuttavia, mancano studi clinici e sperimentali più ampi che lo confermino [16]. La Tabella 2 offre una panoramica delle caratteristiche autoanticorpali specifiche delle paranodopatie.
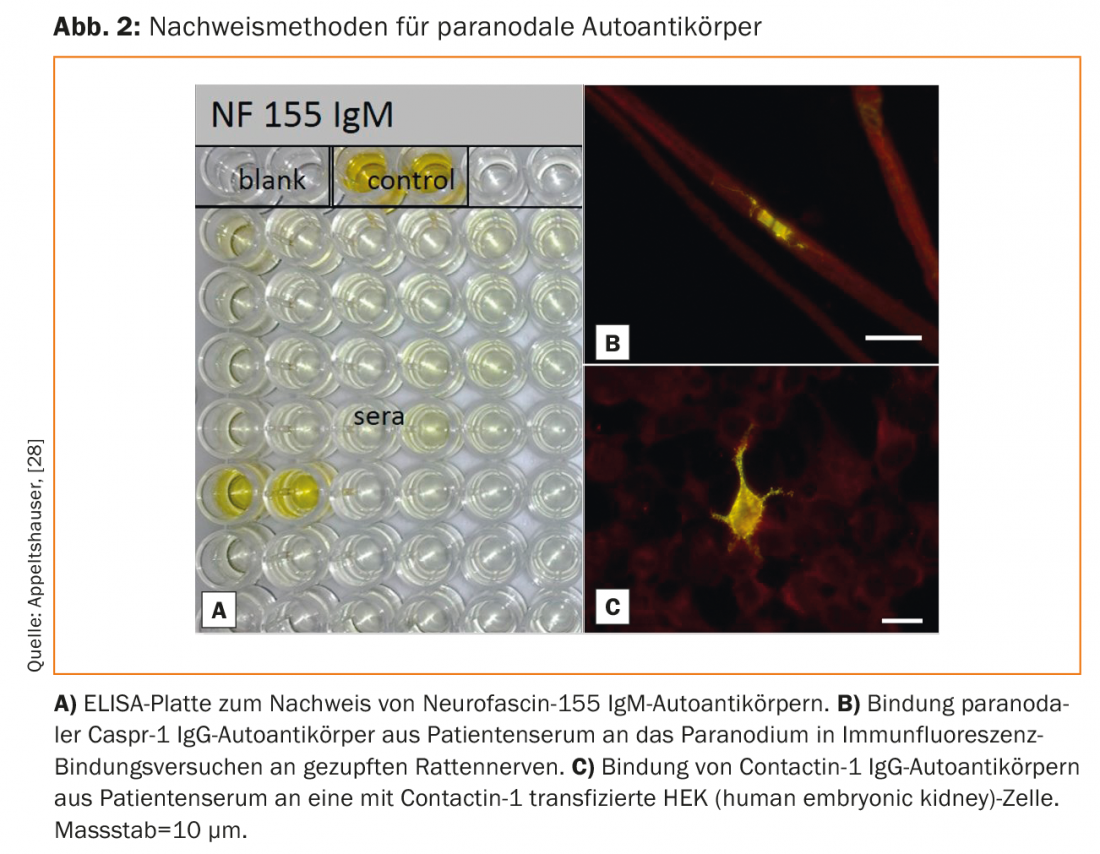
Gli autoanticorpi possono essere rilevati nel siero attraverso l’ELISA, nonché con saggi di legame su nervi spinali di topo o ratto e su cellule trasfettate (Fig. 2) [33]. Non è ancora disponibile un test commerciale convalidato, ma è possibile eseguirlo in laboratori di ricerca specializzati. Lo screening è utile solo nei pazienti con il fenotipo clinico tipico. Nel caso delle neuropatie sensitivo-motorie distali lievi e croniche, invece, è utile chiarire le cause comuni.
A causa del basso numero di casi di pazienti con paranodopatie, finora non esistono studi terapeutici controllati. Serie di casi indicano che, a differenza della CIDP classica, i pazienti con paranodopatia IgG4-mediata rispondono male, mentre i pazienti con paranodopatia IgG3-mediata rispondono abbastanza bene alle IVIG [14,21,30].
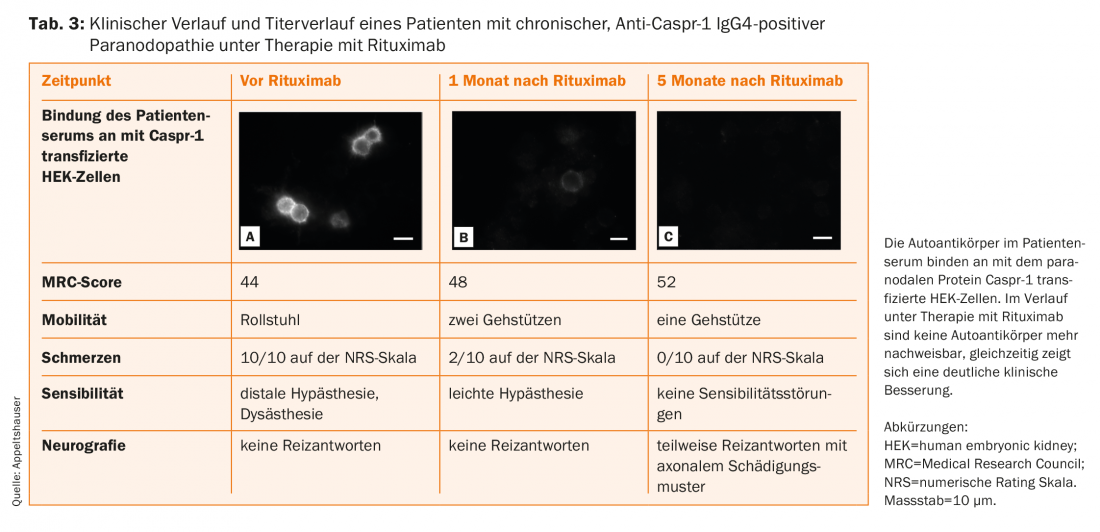
I pazienti con autoanticorpi IgG4 rispondono molto bene al rituximab nella casistica, con una riduzione significativa dei titoli anticorpali come parametro surrogato (Tab. 3) [14,16,20,38]. È possibile che un inizio precoce della terapia prevenga il danno assonale cronico. Pertanto, l’attuale linea guida raccomanda anche uno studio terapeutico individuale con rituximab se vengono rilevati autoanticorpi IgG4 paranodali, che dovrebbe essere effettuato sotto stretto controllo presso centri specializzati [39]. Inoltre, il follow-up dei pazienti con paranodopatie è essenziale per una migliore comprensione di questa nuova entità.
Messaggi da portare a casa
- L’eziologia delle polineuropatie infiammatorie è eterogenea e differisce tra polineuropatie assonali e demielinizzanti.
- Le paranodopatie sono una nuova forma speciale di polineuropatie infiammatorie, mediate dal danno indotto da autoanticorpi all’anello di Ranvier.
- Le caratteristiche cliniche delle paranodopatie sono: esordio subacuto, grave coinvolgimento motorio, scarsa risposta alle terapie standard, tremore e giovane età di insorgenza per gli autoanticorpi contro la neurofascina-155, oltre all’atassia per gli autoanticorpi contro la contactina-1 e al dolore per gli anticorpi contro la caspr-1.
- L’identificazione dei pazienti con autoanticorpi paranodali è importante per una migliore comprensione della malattia e per le decisioni terapeutiche.
Letteratura:
- Pasnoor M, et al: Polineuropatia sensoriale criptogenetica. Neurol Clin 2013; 31(2): 463-476.
- Visser NA, et al: Incidenza della polineuropatia a Utrecht, Paesi Bassi. Neurologia 2015; 84(3): 259-264.
- Uncini A: Un meccanismo comune e una nuova categorizzazione per le neuropatie mediate da anticorpi anti-ganglioside. Exp Neurol 2012; 235(2): 513-516.
- Uncini A, Vallat JM: Nodo-paranodopatie autoimmuni del nervo periferico: il concetto sta prendendo piede. J Neurol Neurosurg Psychiatry 2017; 89(6): 627-635.
- Uncini A, Susuki K, Yuki N: Nodo-paranodopatia: oltre la classificazione demielinizzante e assonale nelle neuropatie mediate da anticorpi anti-ganglioside. Clin Neurophysiol 2013; 124(10): 1928-1934.
- Hanewinckel R, et al: Prevalenza della polineuropatia nella popolazione generale di mezza età e anziana. Neurologia 2016; 87(18): 1892-1898.
- Stathopoulos P, Alexopoulos H, Dalakas MC: Bersagli antigenici autoimmuni nel nodo di Ranvier nelle patologie demielinizzanti. Nat Rev Neurol 2015; 11(3): 143-156.
- Vallat JM, et al: Le mutazioni della Proteina 1 associata alla Contactina (CNTNAP1) inducono lesioni caratteristiche della regione paranodale. J Neuropathol Exp Neurol 2016; 75(12): 1155-1159.
- Sherman DL, et al.: Le neurofascine sono necessarie per stabilire i domini assonali per la conduzione saltatoria. Neuron 2005; 48(5): 737-742.
- Poliak S, et al: Caspr2, un nuovo membro della superfamiglia delle neurexine, è localizzato nei juxtaparanodi degli assoni mielinizzati e si associa ai canali K+. Neuron 1999; 24(4): 1037-1047.
- Doppler K, et al: Interruzione dell’architettura nodale nelle biopsie cutanee di pazienti con neuropatie demielinizzanti. J Peripheral Nerv Syst 2013; 18(2): 168-176.
- Li J, et al.: Biopsie cutanee nelle neuropatie correlate alla mielina: portare la patologia molecolare al letto del malato. Brain 2005; 128(5): 1168-1177.
- Cifuentes-Diaz C, et al.: Nodi di ranvier e paranodi nelle neuropatie croniche acquisite. PloS one 2011; 6(1): e14533.
- Doppler K, et al: Distruzione dell’architettura paranodale nella neuropatia infiammatoria con autoanticorpi anti-contattina-1. J Neurol Neurosurg Psychiatry 2015; 86(7): 720-728.
- Devaux JJ, et al: Gli anticorpi contro la gliomedina causano una neuropatia demielinizzante periferica e lo smantellamento dei nodi di Ranvier. Am J Pathol 2012; 181(4): 1402-1413.
- Doppler K, et al: Auto-anticorpi contro la proteina 1 associata alla contactina (Caspr) in due pazienti con neuropatia infiammatoria dolorosa. Brain 2016; 139(10): 2617-2630.
- Ng JK, et al: La neurofascina come bersaglio degli autoanticorpi nelle neuropatie periferiche. Neurologia 2012; 79(23): 2241-2248.
- Devaux JJ, Odaka M, Yuki N: Le proteine nodali sono antigeni target nella sindrome di Guillain-Barre. J Peripheral Nerve Syst 2012; 17(1): 62-71.
- Doppler K, et al: Autoanticorpi IgM neurofascina-155 in pazienti con neuropatie infiammatorie. J Neurol Neurosurg Psychiatry 2018; 89(11): 1145-1151.
- Burnor E, et al: Anticorpi della neurofascina nelle neuropatie autoimmuni, genetiche e idiopatiche. Neurologia 2018; 90(1): e31-e38.
- Appeltshauser L, et al.: Il deposito del complemento indotto dal legame degli auto-anticorpi anti-contattino-1 è modificato dalle immunoglobuline. Exp Neurol 2017; 287(1): 84-90.
- Koike H, et al: Dissezione paranodale nella polineuropatia demielinizzante infiammatoria cronica con anticorpi anti-neurofascina-155 e anti-contattina-1. J Neurol Neurosurg Psychiatry 2017; 88(6): 465-473.
- Vallat JM, et al: Nodopatia subacuta con blocchi di conduzione e anticorpi anti-neurofascina 140/186: uno studio ultrastrutturale. Brain 2018; 141(7): e56.
- Vallat JM, et al: Lesioni paranodali nella polineuropatia demielinizzante infiammatoria cronica associate agli anticorpi anti-neurofascina 155. Neuromuscul Disord 2017; 27(3): 290-293.
- Manso C, et al: gli anticorpi Contactin-1 IgG4 causano lo smantellamento dei paranodi e i difetti di conduzione. Brain 2016; 139(6): 1700-1712.
- Yan W, et al: Gli anticorpi contro la neurofascina esacerbano la neurite autoimmune sperimentale da trasferimento adottivo. J Neuroimmunol 2014; 277(1-2): 13-17.
- Kuwabara S, Misawa S, Mori M: Nodopatia: polineuropatia demielinizzante infiammatoria cronica con anticorpi anti-neurofascina 155. J Neurol Neurosurg Psychiatry 2017; 88(6): 459.
- Doppler K, et al: la Contactina-1 e la Neurofascina-155/-186 non sono bersagli degli autoanticorpi nella neuropatia motoria multifocale. PloS one 2015; 10(7): e0134274.
- Doppler K, Sommer C: Nuova entità di paranodopatie: una struttura bersaglio con conseguenze terapeutiche. Neurol Akt 2017; 44(3): 194-199.
- Hu W, et al: Associazione tra neurofascina IgG4 e polineuropatia demielinizzante infiammatoria cronica atipica: revisione sistematica e meta-analisi. Brain Behav 2018: 8(10): e1115.
- Querol L, et al: Gli anticorpi Neurofascin IgG4 nella CIDP si associano al tremore invalidante e alla scarsa risposta all’IVIg. Neurologia 2014; 82(10): 879-886.
- Miura Y, et al: La Contactina 1 IgG4 si associa alla polineuropatia demielinizzante infiammatoria cronica con atassia sensoriale. Brain 2015; 138(6): 1484-1491.
- Vural A, Doppler K, Meinl E: Autoanticorpi contro il Nodo di Ranvier nella polineuropatia infiammatoria cronica demielinizzante sieropositiva: rilevanza diagnostica, patogenetica e terapeutica. Front Immunol 2018; 9: 1029.
- Kawamura N, et al: Anticorpo anti-neurofascina nei pazienti con demielinizzazione centrale e periferica combinata. Neurologia 2013; 81(8): 714-722.
- Devaux JJ, et al: Neurofascina-155 IgG4 nella polineuropatia demielinizzante infiammatoria cronica. Neurologia 2016; 86(9): 800-807.
- Ogata H, et al: Caratterizzazione della polineuropatia positiva all’anticorpo IgG4 anti-neurofascina 155. Ann Clin Transl Neurol 2015; 2(10): 960-971.
- Delmont E, et al: Autoanticorpi contro le isoforme nodali della neurofascina nella polineuropatia demielinizzante infiammatoria cronica. Brain 2017; 140(7): 1851-1858.
- Querol L, et al: Rituximab nella CIDP resistente al trattamento con anticorpi contro le proteine paranodali. Neurol Neuroimmunol Neuroinflamm 2015; 2(5): e149.
- Sommer C, et al.: Terapia delle neuropatie e delle neuriti acute e croniche immuno-mediate, linea guida S2e, 2018. In: Commissione sulle linee guida della Società tedesca di neurologia: Linee guida per la diagnosi e la terapia in neurologia.
- Vedeler CA, Farbu E, Mellgren SI: Polineuropatia demielinizzante infiammatoria cronica (CIDP). Acta Neurol Scand Suppl 2013; 196: 48-51.
- Saperstein DS, et al: Spettro clinico delle polineuropatie demielinizzanti croniche acquisite. Muscolo e nervo 2001; 24(3): 311-324.
- Muley SA, Parry GJ: Neuropatia motoria multifocale. J Clin Neurosci 2012; 19(9): 1201-1209.
- Sommer C, et al: Polineuropatie. Dtsch Arztebl Int 2018; 115(6): 83-90.
- Hadden RDM, et al: Neuropatia periferica vasculitica: definizione del caso e linee guida per la raccolta, l’analisi e la presentazione dei dati sulla sicurezza delle vaccinazioni. Vaccino 2017; 35(11): 1567-1578.
- Collins MP, Hadden RD: Le neuropatie vasculitiche non sistemiche. Nat Rev Neurol 2017; 13(5): 302-316.
- Callaghan BC, et al: L’importanza dei sottotipi rari nella diagnosi e nel trattamento della neuropatia periferica: una revisione. JAMA Neurol 2015; 72(12): 1510-1518.
- Kadoya M, et al: Anticorpi IgG4 anti-neurofascina155 nella poliradiculoneuropatia demielinizzante infiammatoria cronica: significato clinico e utilità diagnostica di un test convenzionale. J Neuroimmunol 2016; 301: 16-22.
- Cortese A, et al: Neurofascina-155 come antigene putativo nella demielinizzazione combinata centrale e periferica. Neurol Neuroimmunol Neuroinflamm 2016; 3(4): e238.
- Mathey EK, et al: Risposte autoanticorpali agli antigeni nodali e paranodali nelle neuropatie infiammatorie croniche. J Neuroimmunol 2017; 309: 41-46.
- Querol L, et al: Anticorpi contro la contactina-1 nella polineuropatia demielinizzante infiammatoria cronica. Ann Neurol 2013; 73(3): 370-380.
InFo NEUROLOGIA & PSICHIATRIA 2018; 16(6): 14-18.