Sia i pazienti PAD asintomatici che quelli sintomatici presentano un aumento del rischio cardiovascolare. La diagnosi, la prevenzione e il trattamento precoci sono quindi fondamentali. Le raccomandazioni della Società Europea di Cardiologia (ESC) sono state aggiornate nel 2024. Recentemente, la PAD è diventata un sottocapitolo di un documento guida completo sulla malattia arteriosa e aortica periferica (PAAD).
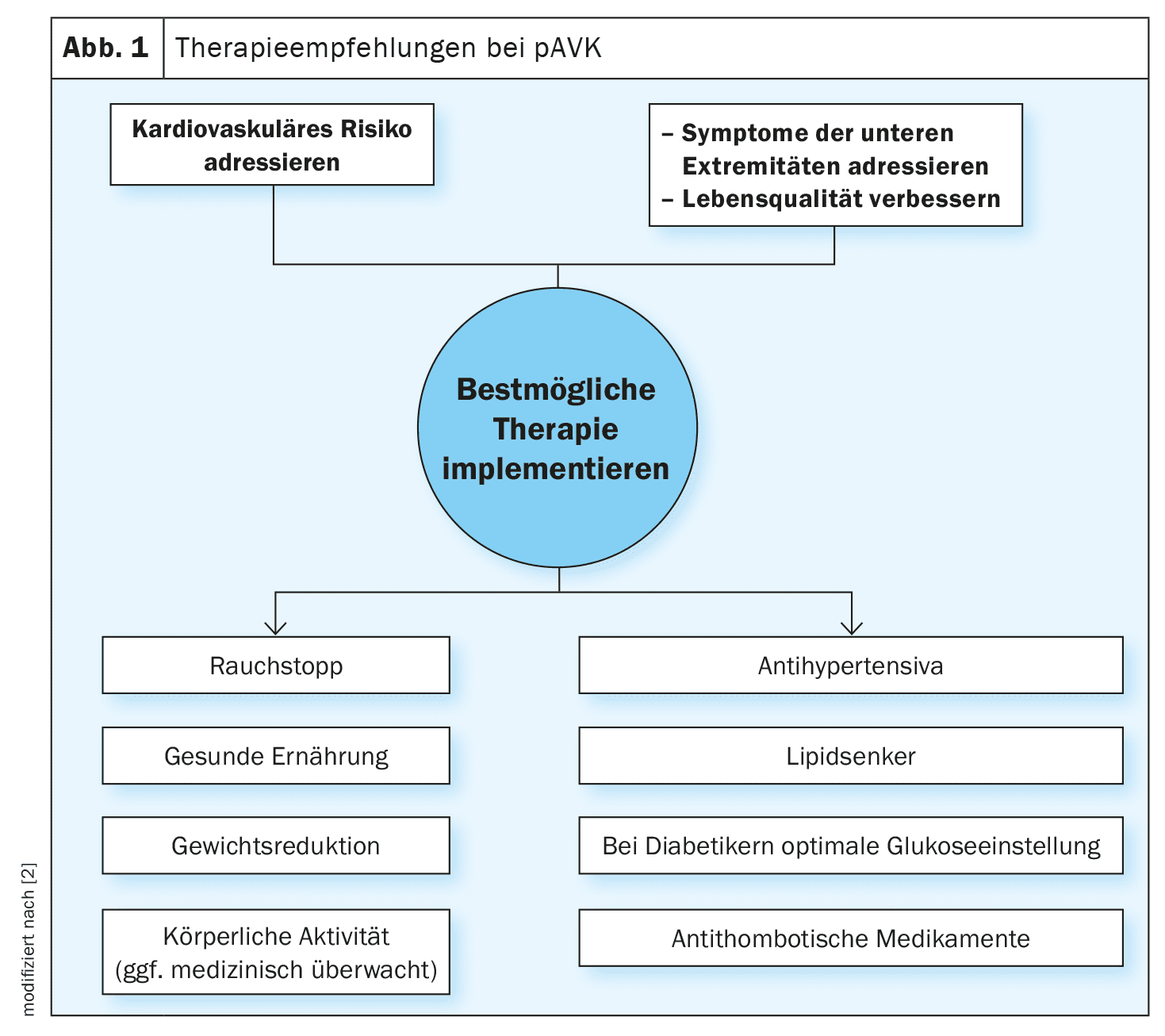
La prevalenza globale della malattia arteriosa e aortica periferica (PAAD) è dell’1,5% e aumenta con l’età, colpendo il 15–20% degli ultrasettantenni e il 20–30% degli ultraottantenni. I pazienti con malattia aortica sono a maggior rischio di malattia vascolare periferica e viceversa [1,2]. Una percentuale significativa di pazienti è asintomatica, motivo per cui lo screening della PAAD basato su fattori di rischio come l’età, l’anamnesi familiare e altri fattori predisponenti è fondamentale. La PAAD può essere diagnosticata utilizzando test vascolari non interventistici o la diagnostica per immagini. Le linee guida (riquadro) sottolineano che la gestione dell’ipertensione, dell’iperlipidemia e del diabete è fondamentale per prevenire gravi complicazioni. Oltre ai fattori legati allo stile di vita, possono essere indicati anche interventi farmacologici (ad esempio, terapia lipidica/ipotassiva/antidiabetica/antitrombotica) per prevenire le complicanze. Il colesterolo LDL-C (colesterolo lipoproteico a bassa densità) è un fattore chiave nell’arteriosclerosi, con il diabete e il consumo di tabacco che aumentano il rischio di PAD di un fattore da 2 a 4. [3,21] Circa il 20-30% dei diabetici ha la PAD.
| La nuova linea guida ESC sulla PAAD enfatizza un approccio olistico L’integrazione delle raccomandazioni per la gestione della malattia arteriosa e aortica periferica (PAAD) in un unico documento di linea guida intende riconoscere che l’aorta e le arterie periferiche sono parti integranti dello stesso sistema arterioso. La Società Europea di Cardiologia (ESC) ha introdotto questo aggiornamento, poiché ci sono stati progressi significativi nella comprensione e nel trattamento della PAAD da quando sono state pubblicate le rispettive linee guida nel 2014 e nel 2017. Le principali raccomandazioni della linea guida 2024 riguardano la natura cronica della PAAD, l’importanza della diagnosi precoce e la necessità di strategie di trattamento complete. L’obiettivo è quello di ottenere un trattamento coerente e coordinato per le diverse malattie vascolari, riducendo così la frammentazione e migliorando i risultati complessivi del trattamento. |
| a [1,2] |
L’indice caviglia-braccio è significativo
La linea guida sottolinea che la “malattia arteriosa periferica” (PAD) o “malattia occlusiva arteriosa periferica” (PAOD) si riferisce solo alla malattia aterosclerotica degli arti inferiori. “I pazienti con PAD hanno il rischio più elevato di subire eventi cardiovascolari”, ha spiegato il Prof. Dr. Thomas Zeller, University Heart Centre, Freiburg-Bad Krozingen (Germania) [3]. La PAD può essere sintomatica o asintomatica e può essere o meno associata a ferite agli arti. Tutti i pazienti con PAD hanno un rischio elevato di eventi cardiaci avversi maggiori (MACE) e di malattie cerebrovascolari. L’incidenza cumulativa di mortalità cardiovascolare a 5 anni è del 9% nella PAD asintomatica e del 13% nei pazienti sintomatici. L’indice caviglia-bracciale (ABI) è il primo test diagnostico non invasivo proposto per confermare lo stato di riduzione del flusso sanguigno degli arti inferiori e deve essere riportato separatamente per ogni gamba. Un ABI ≤0,90 conferma la diagnosi di PAD.
Lo screening per la malattia coronarica è obbligatorio.
Oltre a valutare la perfusione dell’arto, l’ABI funge da marcatore surrogato per la mortalità cardiovascolare e per tutte le cause. Un sintomo tipico della PAD è il dolore durante la deambulazione, che si attenua a riposo. La valutazione della disabilità deambulatoria e dello stato funzionale è obbligatoria. Inoltre, tutti i pazienti con PAD dovrebbero essere sottoposti a screening per la presenza di una malattia coronarica. “Lo screening della malattia coronarica è essenziale in questi pazienti”, ha detto il Prof. Zeller [3]. L’ecografia duplex può essere utilizzata per differenziare le lesioni aterosclerotiche (comprese quelle subcliniche) da quelle non aterosclerotiche. La cardio-TC è considerata la procedura di imaging più importante per la diagnosi, la prognosi e la pianificazione del trattamento delle malattie aortiche (per la sindrome aortica acuta, la sensibilità è del 100% e la specificità del 98%). La risonanza magnetica cardiaca è adatta per una valutazione completa dell’aorta, compresi forma, diametro e caratteristiche del tessuto. Nei pazienti affetti da PAD con diabete e/o infezioni coesistenti, occorre tenere presente che la guarigione delle ferite può essere compromessa, il che è associato a un aumento del rischio di amputazione. Pertanto, il rischio di amputazione in questi pazienti deve essere valutato sistematicamente utilizzando la classificazione per le ferite, l’ischemia e le infezioni del piede.
Si consiglia un allenamento strutturato alla camminata
Un documento di consenso sull’esercizio fisico e la PAD è stato recentemente pubblicato sull’European Heart Journal [15]. L’attività fisica è un importante intervento sullo stile di vita nella PAD per migliorare i sintomi e promuovere la qualità della vita. Nei pazienti con PAD sintomatica, sono stati dimostrati miglioramenti nella distanza di cammino di sei minuti (6MWD), nella qualità di vita correlata alla salute (HRQoL) e nella forma cardiorespiratoria. Secondo il relatore [3], l’allenamento alla camminata regolare, possibilmente in un gruppo sotto la guida di un esperto, è il più adatto. L’allenamento strutturato alla camminata tre volte alla settimana per 30–60 minuti si è dimostrato efficace per la claudicazione intermittente. I pazienti sintomatici devono sottoporsi a una visita medica prima di iniziare l’esercizio fisico e, se possibile, completare le sessioni di allenamento con supervisione medica. Inoltre, si raccomanda ai fumatori di smettere di fumare e ai pazienti ipertesi di abbassare la pressione sanguigna. Per la maggior parte degli adulti, si dovrebbe puntare a un valore target sistolico di 120-129 mm Hg, a condizione che la terapia si dimostri ben tollerata. Se questo valore target non sembra essere raggiungibile, si può applicare il principio ALARA (“As Low As Reasonably Achievable”). Esiste una raccomandazione IIa per l’uso di ACE-inibitori o bloccanti del recettore dell’angiotensina (ARB) in prima linea. <Per quanto riguarda la gestione dei lipidi, la linea guida attuale consiglia di puntare a un valore di colesterolo LDL di 55 mg/dl (1,4 mmol/l), se possibile.
Consideri la terapia antitrombotica per la PAD sintomatica.
Nei pazienti con PAD sintomatica, la terapia antitrombotica migliora la prognosi cardiovascolare [4–8]. Per questi pazienti, esiste una raccomandazione di classe Ia per la terapia antiaggregante con aspirina (75–160 mg, 1× al giorno) o clopidogrel (75 mg, 1× al giorno) per ridurre il rischio di MACE [4–6]. Gli studi suggeriscono che il clopidogrel può avere un vantaggio modesto rispetto all’aspirina [9,10]. Nello studio EUCLID (Examining Use of tiCagreLor In peripheral artery Disease), la monoterapia antitrombotica con ticagrelor non ha mostrato un beneficio superiore nella riduzione degli eventi MACE o di sanguinamento maggiore rispetto al clopidogrel. La terapia antitrombotica doppia con aspirina e rivaroxaban (2,5 mg, 2× al giorno) è più efficace della sola aspirina nei pazienti con PAD, in quanto riduce l’incidenza di ictus (MACE) e di ischemia acuta degli arti; tuttavia, è associata a un aumento del rischio di emorragia maggiore. La terapia antitrombotica non dovrebbe essere somministrata sistematicamente ai pazienti con PAD asintomatica. [11,12] Sebbene i pazienti con PAD abbiano un rischio cardiovascolare molto elevato, uno studio che ha analizzato l’effetto degli agenti antiaggreganti nei pazienti asintomatici con un ABI ≤0,95 non ha mostrato alcun effetto sul MACE o sulla rivascolarizzazione. [13] Anche un altro studio su pazienti con un ABI ≤0,99 e diabete non ha mostrato alcuna differenza in termini di MACE o amputazioni. Tuttavia, questi dati non sono stati progettati per analizzare i sottogruppi e non escludono la possibilità che l’aspirina possa avere un beneficio nei pazienti a maggior rischio di eventi cardiovascolari.
Verificare l’indicazione alla rivascolarizzazione
Nei pazienti con PAD sintomatica e compromissione della qualità di vita correlata alla PAD, la rivascolarizzazione può essere presa in considerazione dopo tre mesi di miglior trattamento farmacologico possibile e terapia di esercizio (raccomandazione IIb). Si raccomanda di adattare la modalità e il tipo di rivascolarizzazione alla posizione anatomica della lesione, alla morfologia della lesione e alle condizioni generali del paziente. Per i pazienti sottoposti a rivascolarizzazione endovascolare, si raccomanda una terapia di esercizio fisico supervisionata come misura di accompagnamento. Esistono prove da studi individuali che la doppia inibizione piastrinica per un periodo di 1–3 mesi è benefica dopo la terapia di rivascolarizzazione endovascolare [16,17]. Una combinazione di aspirina 100 mg e rivaroxaban (2,5 mg, 2× al giorno) dopo la rivascolarizzazione ha mostrato un’incidenza moderata ma significativamente più bassa di MALE e MACE rispetto alla sola aspirina, senza un aumento del sanguinamento maggiore dovuto alla trombolisi nell’infarto miocardico, ma con un aumento del sanguinamento maggiore secondo la Società Internazionale sulla Trombosi e l’Emostasi, soprattutto quando il clopidogrel è stato somministrato per 1 mese [6,18,19]. Si raccomanda che i pazienti con PAD si sottopongano a esami di follow-up regolari, cioè almeno una volta all’anno, per valutare lo stato clinico e funzionale, nonché l’aderenza alla terapia, i sintomi dell’arto e tutti i fattori di rischio cardiovascolare, utilizzando l’ecografia duplex se necessario. La PAD è uno dei fattori di rischio clinico inclusi nel punteggio CHA2DS2-VASc- uno strumento diagnostico per valutare il rischio di ictus nei pazienti con fibrillazione atriale (FA) [20]. La prevalenza della fibrillazione atriale nei pazienti con PAD è di circa il 12%.
Congresso: swissESCupdate.24
Letteratura:
- “Le nuove linee guida ESC combinano per la prima volta le malattie arteriose periferiche e aortiche, sottolineando l’interconnessione dell’intero sistema arterioso”, Società Europea di Cardiologia (ESC), 30 agosto 2024.
- Mazzolai L, et al; Gruppo di Documento Scientifico ESC. Linee guida ESC 2024 per la gestione delle malattie arteriose e aortiche periferiche. Eur Heart J 2024; 45(36): 3538-3700.
- “Linee guida ESC 2024 per la gestione delle malattie arteriose e aortiche periferiche”, Prof. Dr. Thomas Zeller, Swiss ESC Update 2024, Basilea, 05.09.2024
- Collaborazione dei trialisti antitrombotici. Metanalisi collaborativa degli studi randomizzati sulla terapia antiaggregante per la prevenzione di morte, infarto miocardico e ictus nei pazienti ad alto rischio. BMJ 2002; 324: 71-86.
- De Carlo M, et al: Efficacia e sicurezza delle terapie antiaggreganti nella malattia arteriosa periferica sintomatica: una revisione sistematica e una meta-analisi di rete. Curr Vasc Pharmacol 2021; 19: 542-555.
- Willems LH, et al: Terapia antitrombotica per la malattia arteriosa periferica sintomatica: una revisione sistematica e una meta-analisi di rete. Farmaci 2022; 82: 1287-1302.
- Katsanos K, et al: Efficacia e sicurezza comparativa di diversi agenti antiaggreganti per la prevenzione di eventi cardiovascolari maggiori e amputazioni alle gambe nei pazienti con malattia arteriosa periferica: una revisione sistematica e una meta-analisi di rete. PLoS One 2015; 10: e0135692.
- Basili S, et al: Confronto dell’efficacia dei trattamenti antipiastrinici per i pazienti con claudicatio. Una meta-analisi. Thromb Haemost 2010; 103: 766-773.
- Comitato direttivo di CAPRIE. Studio randomizzato, in cieco, di clopidogrel rispetto all’aspirina nei pazienti a rischio di eventi ischemici (CAPRIE). Comitato direttivo di CAPRIE. Lancet 1996; 348: 1329-1339.
- 10. Berger JS, et al: Aspirina per la prevenzione degli eventi cardiovascolari nei pazienti con malattia arteriosa periferica: una meta-analisi di studi randomizzati. JAMA 2009;301: 1909-1919.
- Dorn A, et al: L’indice caviglia-brachiale basso e alto sono entrambi associati alla mortalità nei residenti delle case di cura tedesche – il follow-up di cinque anni della coorte “allo-studio”. J Clin Med 2023; 12: 4411. doi: 10.3390/jcm12134411
- Fowkes FG, et al: Aspirina per la prevenzione degli eventi cardiovascolari in una popolazione generale sottoposta a screening per un basso indice brachiale della caviglia: uno studio randomizzato controllato. JAMA 2010; 303: 841-848.
- Belch J, et al: Studio sulla prevenzione della progressione della malattia arteriosa e del diabete (POPADAD): studio fattoriale randomizzato controllato con placebo sull’aspirina e gli antiossidanti nei pazienti con diabete e malattia arteriosa periferica asintomatica. BMJ 2008; 337: a1840.
- Bowman L, et al: Effetti dell’aspirina per la prevenzione primaria nelle persone con diabete mellito. N Engl J Med 2018; 379: 1529-1539.
- Mazzolai L, et al: Terapia dell’esercizio fisico per la malattia arteriosa periferica cronica sintomatica. Eur Heart J 2024; 45: 1303-1321.
- Strobl FF, et al: Risultati a dodici mesi di uno studio randomizzato che confronta la terapia mono con quella doppia antiaggregante nei pazienti trattati per via endovascolare con malattia arteriosa periferica. J Endovasc Ther 2013; 20: 699-706.
- Tsai SY, et al: Terapia antipiastrinica mono o doppia per il trattamento dei pazienti con malattia arteriosa periferica dopo la rivascolarizzazione degli arti inferiori: una revisione sistematica e una meta-analisi. Pharmaceuticals (Basel) 2022; 15:596. https://doi.org/10.3390/ph15050596.
- Bonaca MP, et al: Rivaroxaban nella malattia arteriosa periferica dopo la rivascolarizzazione. N Engl J Med 2020; 382:1994-2004.
- Hiatt WR, et al: Rivaroxaban e aspirina nella rivascolarizzazione dell’arteria periferica degli arti inferiori: impatto del clopidogrel concomitante sull’efficacia e sulla sicurezza. Circulation 2020; 142: 2219-2230.
- Olesen JB, et al: Am J Med 2012;125: 826.e13-23.
- Criqui MH, Aboyans V: Circ Res 2015;116: 1509-1526.
HAUSARZT PRAXIS 2024; 19(11): 28-29 (pubblicato il 22.11.24, prima della stampa)