I trattamenti per la psoriasi sono stati tramandati fin dall’antica Grecia. I metodi di trattamento ben collaudati includono l’occlusione, le medicazioni con colla di zinco, la balneoterapia e le terapie combinate con le sostanze del tè, il ditranolo, lo psoralene e le terapie della luce.
Difficilmente in qualsiasi altro campo della dermatologia come nell’immunologia cutanea è stato sviluppato così tanto negli ultimi anni. La conoscenza della psoriasi ha portato alla fine a una marea di nuove sostanze terapeutiche. Pertanto, i moderni biologici sono utilizzati per inibire in modo specifico le trasmissioni di segnali attraverso le citochine (IL-12, IL-23, IL-17, TNFalfa, ecc.). Inoltre, sempre più aspetti clinici, fenotipici, epidemiologici, internistici e psicosomatici stanno venendo alla ribalta grazie al grande impegno delle cliniche e delle aziende farmaceutiche. Ma che dire delle opzioni terapeutiche collaudate per la psoriasi? Dopo tutto, questa malattia è stata trattata fin dall’antica Grecia. Nell’antichità veniva erroneamente chiamata lebbra, ma lo stigma è enorme ancora oggi.
Occlusione semplice con o senza principi attivi
Se si occludesse una placca di psoriasi con un foglio di alluminio domestico, la placca scomparirebbe dopo quattro o sei settimane. È noto che la terapia locale con un’ulteriore occlusione ermetica è più efficace, in quanto la penetrazione delle sostanze terapeutiche aumenta di molte volte, ma anche l’occlusione senza sostanze attive è molto efficace e rappresenta un fattore indipendente [1]. Le placche che di solito vengono utilizzate per la terapia delle ulcere, le pellicole di plastica (Fig. 1), persino il Gore-Tex possono essere utilizzate per guarire le lesioni secche della psoriasi, compresa l’ipercheratosi e l’arrossamento. Ci vuole un po’ di ingegno per applicare pellicole durevoli sulle giunture. Se taglia i bordi, questo garantisce una certa mobilità. Certamente, i focolai nelle flessioni, le lesioni che lacrimano e le forme pustolose devono essere trattate apertamente a causa delle possibili superinfezioni e del forte accumulo di essudato; anche le lesioni psoriasiche potrebbero infettarsi sotto occlusione nei diabetici.
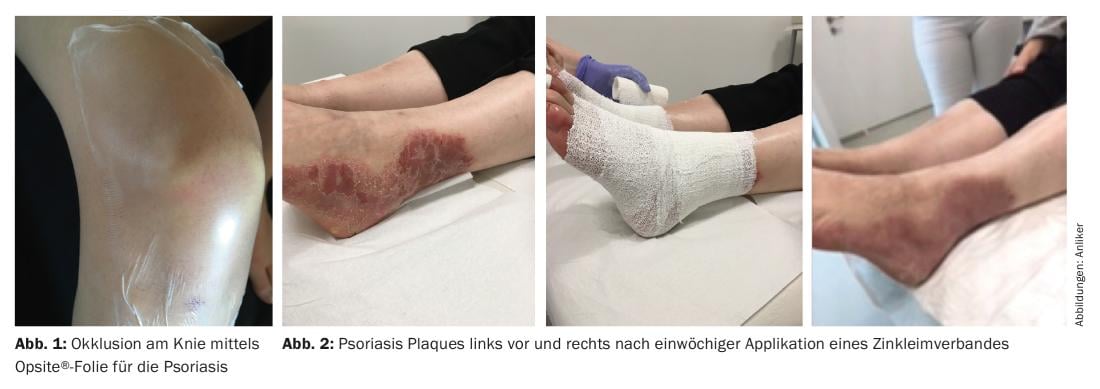
Medicazioni con colla di zinco
Le bende di zinco umide, in particolare, sono facili da applicare alle estremità (Fig. 2), sono flessibili e leggermente pieghevoli come un gesso morbido, raffreddano e sono astringenti. Di solito possono essere cambiati settimanalmente dal paziente; una crema steroidea, ad esempio, può essere facilmente applicata sotto di essi; di solito il risultato desiderato si ottiene dopo quattro settimane. I trattamenti successivi possono essere applicati su base settimanale, se necessario. Il trattamento è semplice, forse non adatto ai mesi più caldi dell’anno, ma può accompagnare bene altre forme di terapia, in quanto i risultati del trattamento sono ritardati, soprattutto nel caso della parte esterna della gamba e del gomito.
Catrame di carbone dal 2% al 20% in gelatina di petrolio
La formulazione Magistral con catrame di carbone è un’alternativa all’uso di sostanze steroidee, molto efficace nel trattamento dell’infiammazione e della tendenza proliferativa della pelle. Il catrame è particolarmente indicato per le mani e i piedi, dove può essere applicato anche in modo occlusivo per dodici ore alla volta (Fig. 3), ad esempio con guanti di cotone. A parte la praticità (la rimozione del catrame è meglio farla con salviette di cellulosa) e l’odore, le preparazioni di catrame in aggiunta agli steroidi topici possono sempre ottenere un miglioramento senza l’uso di retinoidi o immunosoppressori. Per esempio, si dovrebbe iniziare con un trattamento seriale di 4×12 a settimana e poi ridurre a uno o due trattamenti a settimana, man mano che le condizioni della pelle migliorano. La cancerogenicità non è indicata per l’applicazione palmoplantare.

Trattamenti in tessuto
Per intensificare la terapia locale, i pazienti possono avvolgersi in lenzuola per 50-60 minuti dopo l’applicazione abbondante di unguenti. L’effetto delle diverse sostanze viene favorito, la refrattarietà viene migliorata e si può applicare una quantità adeguata di terapia locale.
Terapia UVB a banda stretta con ditranolo: questa antracina, un antracene, viene applicata in concentrazioni dello 0,1-2% in una pasta o crema e utilizzata in combinazione con la terapia UVB a banda stretta. Si dovrebbe iniziare con una concentrazione bassa per allenare lentamente la sensibilità alla luce. Funziona anche con il tempo di esposizione, che inizialmente è solo di un minuto prima di essere cancellato di nuovo. Aumenta enormemente l’efficacia della terapia della luce e in passato è stata molto utilizzata, soprattutto per i trattamenti in regime di ricovero. Non c’è assolutamente nulla che impedisca di utilizzare questa terapia in un contesto ambulatoriale. Tuttavia, non deve essere utilizzato sul viso o sui genitali. In genere, i derivati del catrame sono considerati più lenti nell’efficacia rispetto agli steroidi locali; ciò dipende dagli aumenti di concentrazione. Le caratteristiche più importanti e convincenti sono l’assenza di un fenomeno di rimbalzo, osservato due settimane dopo gli steroidi topici. Gli effetti collaterali del cortisone vengono evitati.
Terapia di Göckermann: questo preparato di catrame locale è stato utilizzato per la prima volta insieme alla terapia della luce nel 1925 [2] e si basa sullo stesso principio delle proprietà antinfiammatorie del catrame e dell’aumento della sensibilità ai raggi UVA e UVB. A causa della concentrazione più elevata, pari al 10-20%, il catrame di carbone è piuttosto untuoso, maleodorante e macchiante (i pazienti vengono avvolti in lenzuola per circa un’ora direttamente prima del trattamento con la luce), motivo per cui sempre più persone sono passate al ditranolo – soprattutto nella terapia della psoriasi in regime di ricovero, che dura ben sei settimane. Ma anche in questo caso, le fasi di guarigione durano molto a lungo, al massimo fino a un anno, soprattutto rispetto alla terapia climatica (quattro settimane) e agli steroidi topici o (in realtà controindicati) interni (rimbalzo dopo due settimane).
Sistema PUVA
La PUVA di sistema è il fulcro della terapia combinata ambulatoriale. Nella terapia PUVA sistemica, il fotosensibilizzatore 8-metossipsoralen (8-MOP) viene somministrato per via orale due ore prima dell’irradiazione. In combinazione con i retinoidi, si tratta della cosiddetta terapia Re-PUVA, che può essere utilizzata con successo soprattutto in caso di focolai gravemente ipercheratotici. Una delle principali difficoltà è la sensibilità degli occhi alla luce durante l’assunzione di psoralene, motivo per cui l’assunzione e le irradiazioni avvengono di sera, poiché il paziente deve indossare occhiali da sole alla luce del giorno, il che limita la qualità della vita.
PUVA locale / PUVA in crema
Preparando la pelle 30 minuti prima dell’irradiazione con lo psoralene, questo agisce come amplificatore della terapia della luce e della sua immunosoppressione della pelle. Il bagno preventivo con psoralene o l’applicazione della crema avviene con una concentrazione di 8-metossi-psoralene 0,009-0,012% [3]. Questi trattamenti sono particolarmente indicati per le infestazioni di mani e piedi o altre aree isolate che possono essere trattate con un radiatore UVA lineare (Fig. 4). Lo svantaggio è il tempo di irradiazione più lungo, di 10-20 minuti. Per contro, è vantaggioso che si tratti di una terapia naturale che può essere combinata anche con retinoidi o catrame di carbone; se la risposta è buona, può essere ridotta a una terapia di mantenimento con una seduta settimanale o la condizione può essere mantenuta con altre terapie semplici.

Balneoterapia
Purtroppo la balneoterapia è stata quasi completamente abbandonata. Nelle degenze ospedaliere, una vasca da bagno non è sempre disponibile, richiede tempo e personale. Mancano anche studi recenti sull’efficacia delle terapie del bagno. Tuttavia, il modo in cui funziona è ovvio. In breve tempo, la pelle può essere decalcificata, l’acqua ha un effetto astringente se non è troppo calda; ha un effetto antisettico e antiprurito. Dopo una settimana di balneoterapia, abbiamo già visto guarigioni miracolose in lesioni psoriasiche altamente superinfette.
Quali fattori giocano un ruolo in questo caso? Il fatto che molti psoriasici abbiano una malattia genetica autostimolata è solo una metà della verità; non bisogna trascurare nemmeno il carico di germi della pelle, che stimolano la malattia come cosiddetti superantigeni [4]. In particolare, gli stafilococchi e la Candida sono stati indicati come germi stimolanti per la pelle. E naturalmente, le infezioni interne da streptococchi sono ben note come causa primaria della psoriasi. Quest’ultima dovrebbe essere ricercata e trattata attivamente in qualsiasi psoriasi estesa. La sensazione di rilassamento, il piacere e talvolta la riduzione del prurito grazie al bagno sono fattori importanti che contribuiscono al miglioramento di questa malattia.
Le aggiunte nella balneoterapia variano molto e dipendono in qualche modo dalle correnti pubbliche. Probabilmente la più conosciuta è la terapia del bagno salino, che simula un bagno in mare [5]. Altri additivi sono tensioattivi che puliscono la pelle, antisettici (ad esempio, saponi contenenti triclosan) che eliminano anche la flora della pelle. La crusca di grano può essere aggiunta al bagno per alleviare il prurito. La terapia del bagno può essere combinata molto bene con la terapia della luce.
Climaterapia
In passato, i soggiorni al mare venivano pagati dalle assicurazioni complementari in determinate circostanze. Non c’è dubbio che una simile sospensione sia efficace. I bagni salini, l’elioterapia, una dieta mediterranea con molto olio di pesce e, se necessario, la possibilità di un trattamento interno con diversi unguenti contenenti polidocanolo (contro il prurito), sostanze catramose (ditranolo, catrame di carbone 2%), steroidi e/o vitamina D contribuiscono efficacemente al processo di guarigione. Tuttavia, la guarigione è spesso caratterizzata da una recidiva dopo quattro settimane – quando il paziente torna a casa e la terapia non viene proseguita.
Questi servizi non sono più coperti dalle casse malattia perché sono troppo poco controllati, standardizzati e troppo costosi. Tuttavia, queste terapie sono raccomandate.
Nutrizione
Le raccomandazioni per una dieta appropriata che presumibilmente supporta il processo di guarigione sono più aneddotiche che scientificamente fondate; per esempio, l’aggiunta di vitamina E o D, che si suppone siano utili, è stata descritta come esemplare piuttosto che statisticamente provata. Si raccomanda l’assunzione di acidi grassi omega 3 (olio di fegato di merluzzo, pesce), una dieta a basso contenuto di carboidrati e di alcol e la riduzione dei grassi animali. Almeno questo ha un senso cardiovascolare.
Messaggi da portare a casa
- Metodi di trattamento ben collaudati, che spesso migliorano la qualità della vita e hanno un effetto favorevole sulle malattie concomitanti, sono in parte caduti nel dimenticatoio.
- Soprattutto i fattori di accompagnamento come il prurito e la colonizzazione batterica possono essere risolti molto bene con la balneoterapia.
- Le terapie di occlusione sono semplici e possono essere eseguite dal paziente.
- Le terapie combinate con sostanze catramose, ditranolo e psoralene con o senza terapia della luce possono essere utilizzate nei pazienti polimorfi. Sono naturali, economici, privi di rischi – anche rispetto alle terapie di sistema.
Letteratura:
- Vleuten CJ, Vlijmen-Willems IM, et al: Lozione di clobetasolo-17-propionato sotto medicazione idrocolloide (Duoderm ET) una volta alla settimana rispetto all’unguento di clobetasolo-17-propionato non incluso due volte al giorno nella psoriasi: uno studio immunoistochimico sulla remissione e sulla ricaduta. Arch Dermatol Res 1999; 291(7-8): 390-395.
- Petrozzi JW: Regime Goeckerman per i pazienti psoriasici refrattari alla terapia biologica. J Am Acad Dermatol 2014; 71(1): 195.
- Steinmeyer K, Grundmann-Kollmann M, et al: Trattamento della psoriasi a placche con la terapia crema-PUVA. Hautarzt 2001; 52(10): 885-887.
- Balci DD, Duran N, et al: Alta prevalenza di coltivazione di Staphylococcus aureus e produzione di superantigeni nei pazienti con psoriasi. Eur J Dermatol 2009; 19(3): 238-242.
- Gambichler T, Demetriou C, et al: L’impatto dei bagni in acqua salata sui parametri biofisici e molecolari degli equivalenti dell’epidermide psoriasica. Dermatologia. 2011; 223(3): 230-238.
PRATICA DERMATOLOGICA 2017; 27(5): 13-17











