Il virus SARS-CoV-2 rappresenta un problema particolare per i pazienti ematologici. pericolo. Da un lato, il loro sistema immunitario è spesso indebolito dalla malattia e, dall’altro, numerose terapie riducono ulteriormente la risposta immunitaria. Cosa fare quando il cancro del sangue e COVID-19 si incontrano? E qual è l’importanza della vaccinazione?
In vista della pandemia, non solo la cura dei pazienti ematologici è a rischio, ma è emersa un’altra minaccia per loro, sotto forma di un virus potenzialmente mortale. Mentre la mortalità legata al COVID-19 nel settore ospedaliero è di circa il 12,1% per i pazienti non oncologici in generale, è del 20,5% per i pazienti oncologici – una differenza statisticamente significativa. Queste cifre sono fornite dal registroeuropeo LEOSS (Lean European Open Survey on SARS-CoV-2 infected patients). Anche dopo un trattamento medico intensivo dell’infezione, secondo il registro, la mortalità dei pazienti affetti da cancro è superiore a quella dei pazienti senza diagnosi oncologica. Le persone affette da una malattia ematologica sono ulteriormente a rischio, come dimostra uno studio pubblicato sulla rivista scientifica Nature nell’agosto 2020 [1]. Questo ha dimostrato ciò che molti sospettavano già all’epoca: La mortalità COVID-19 dei pazienti ematologici è particolarmente elevata. È superiore a quella di tutti gli altri pazienti oncologici e paragonabile a quella dei pazienti immunosoppressi. Nel primo anno di terapia, il rischio di morire a causa del virus SARS-CoV-2 è addirittura aumentato di un fattore 2 rispetto alla popolazione generale. Per quanto riguarda la malattia di base, i linfomi in particolare sembrano essere un prerequisito insufficiente per il decorso dell’infezione da SARS-CoV-2 [2]. Questi risultati degli ultimi due anni giustificano un approccio differenziato alla malattia COVID-19 nei pazienti ematologici e sottolineano l’importanza della migliore profilassi possibile in questa popolazione – una sfida data la situazione dinamica e il giovane panorama di studi.
Quali pazienti sono particolarmente a rischio?
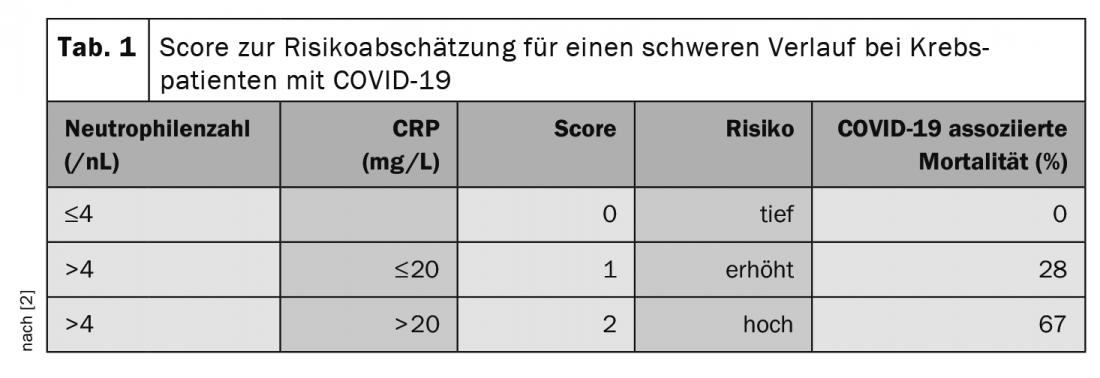
In occasione della riunione annuale delle Società tedesche, austriache e svizzere di ematologia e oncologia medica, tenutasi in ottobre, il Prof. Clemens Wendtner, MD, primario della Clinica Schwabing di Monaco di Baviera e segretario scientifico del Gruppo tedesco di studio CLL (DCLLSG), ha sottolineato l’importanza del trattamento per il rischio associato a COVID-19. In particolare, sono a rischio i pazienti in terapia con anticorpi anti-CD20 come il Rituximab e il trattamento steroideo, per cui già >10 mg/d prednisone equivalente per >5 giorni è da considerarsi critico. Gli inibitori del checkpoint sono anche associati a una maggiore letalità [2]. Uno studio ha anche cercato i fattori che predicono la progressione COVID-19 grave nei pazienti con tumore [2]. In questo caso, la conta dei neutrofili (>4,4/nL) e il valore della CRP (>20 mg/L) prima dell’infezione sembrano avere un valore prognostico. Gli autori hanno sviluppato un punteggio a partire da questo risultato (Tab. 1).
Gestione della SARS-CoV-2 nei pazienti ematologici: Ballare con il diavolo
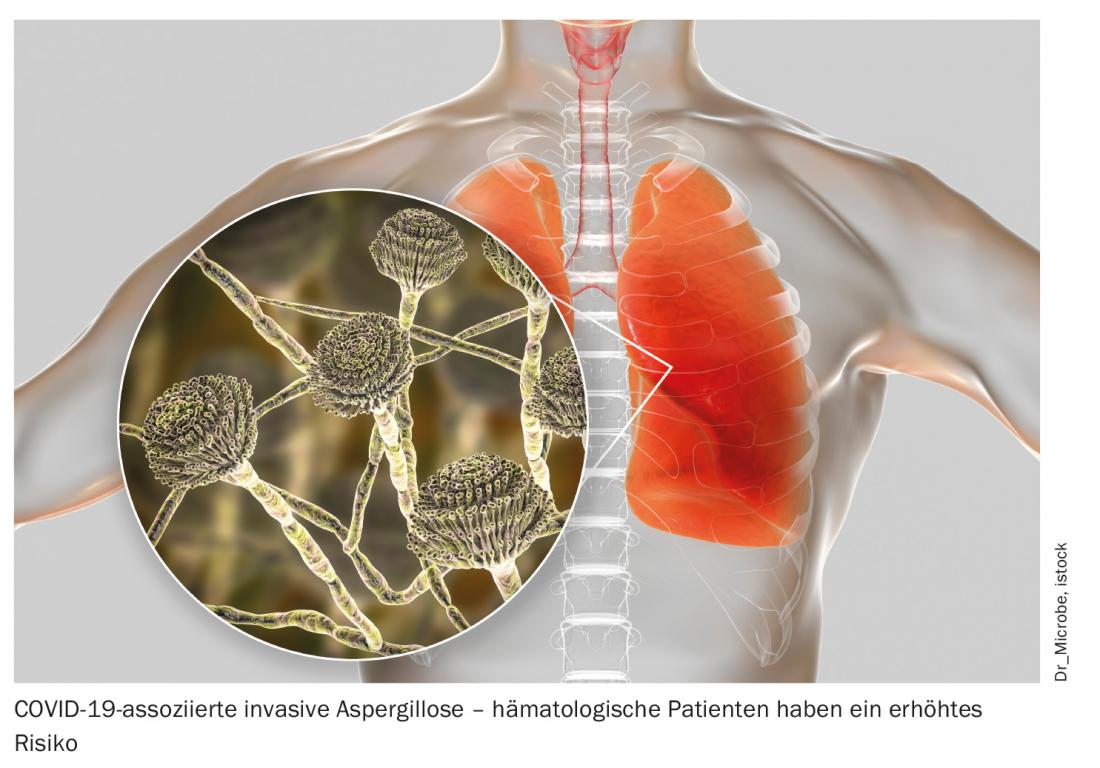
Oltre alla maggiore suscettibilità a decorsi gravi e fatali di COVID-19, lo spargimento virale prologo, fino a 70 giorni dopo la diagnosi, si riscontra anche nelle persone affette da neoplasie ematologiche. Questo comporta un rischio potenziale di infezione per i contatti – anche se il paziente è asintomatico – e non dovrebbe essere trascurato nel trattamento di questi pazienti [3]. Oltre alla stretta osservanza delle misure igieniche per il bene di tutte le persone coinvolte, il trattamento precoce è di particolare importanza. Allo stesso tempo, l’approccio terapeutico migliore non è ancora chiaro. Secondo gli esperti presenti al congresso, l’ottimizzazione delle misure di supporto in particolare è indiscutibilmente in primo piano. Questo include l’anticoagulazione profilattica nei pazienti ospedalizzati, ma anche una buona profilassi antibiotica, antivirale e antimicotica e la terapia delle infezioni secondarie. Per esempio, una schermatura coerente dei farmaci porta a un’incidenza significativamente inferiore di aspergillosi polmonare associata a COVID-19 [4]. Le immunoglobuline per via endovenosa (IVIG) possono e devono essere utilizzate anche nei casi di comprovata carenza secondaria di immunoglobuline. Se l’immunosoppressione debba essere interrotta in presenza della malattia COVID-19 non è attualmente chiaro e deve essere deciso su base individuale. In generale, il trattamento di questo gruppo di pazienti particolarmente vulnerabili deve essere individualizzato e strettamente orientato all’immunosoppressione e al titolo anticorpale.
Per quanto riguarda la terapia specifica di COVID-19, come nei pazienti non ematologici, vengono utilizzati in particolare l’antivirale Remdesivir, il Desametasone e il Tocilizumab. Sempre più spesso, si sta facendo strada anche il trattamento con la terapia anticorpale passiva. Questo gioca un ruolo crescente soprattutto nei pazienti sieronegativi – e i pazienti immunosoppressi e quelli affetti da neoplasie ematologiche appartengono spesso a questo gruppo. Nel frattempo, esistono alcuni studi sulla combinazione dei principi attivi casirivimab e imdevimab, nota anche come REGEN-COV. In alternativa, si può utilizzare il plasma di convalescenza, anche se attualmente non esistono studi positivi su pazienti immunosoppressi. In ogni caso, il trattamento precoce entro 3-5 giorni dalla comparsa dei sintomi è più promettente. L’uso in pazienti ad alto rischio come parte di una profilassi post-esposizione – ad esempio dopo un’epidemia nosocomiale – è concepibile ed è attualmente in fase di studio. In uno studio corrispondente, questa procedura ha mostrato una riduzione del rischio dell’83% se utilizzata in fase precoce, ed è in corso una procedura di approvazione con la Food and Drug Administration statunitense [5]. Soprattutto nei pazienti ad alto rischio, come quelli sottoposti a terapia di deplezione dei linfociti B, il trattamento con anticorpi può essere preso in considerazione più avanti nel decorso della malattia, se si sospetta che la produzione propria del paziente sia insufficiente. Questo è raccomandato dallo STAKOB tedesco (Standing Working Group of Competence and Treatment Centres for Diseases Caused by Highly Pathogenic Pathogens), soprattutto se la carica virale è elevata. Inoltre, secondo STAKOB, è necessario prelevare gli anticorpi anti-spike e non è necessario attendere il risultato. Con la terapia anticorpale, il rischio di reazioni allergiche non deve essere trascurato; è necessario un attento monitoraggio clinico con un periodo di follow-up di almeno un’ora.
Per quanto riguarda l’efficacia di REGEN-COV, sono evidenti alcune lacune sia nella variante sudafricana che in quella brasiliana e scozzese. Il più recente sotrovimab (VIR-7831), invece, sembra essere pienamente efficace anche in questo caso. Con la continua comparsa di ulteriori varianti, è probabile che si presentino alcune sfide per i medici e l’industria farmaceutica. È importante mantenere uno stretto monitoraggio in tutte le fasi della pandemia e aggiornarsi a livello individuale. Questo è l’unico modo per garantire la migliore assistenza possibile.
Vaccinare, vaccinare, vaccinare
Anche nel contesto della vaccinazione, la comparsa di nuove varianti è sempre sotto i riflettori – con preoccupazioni sull’efficacia dell’immunizzazione attiva che non possono essere liquidate a priori. Questo varia tra le diverse varianti del virus. Anche in questo caso, le persone affette da malattie ematologiche sono un caso speciale. Ad esempio, un’analisi di 88 pazienti dopo il trapianto di cellule staminali ematopoietiche che avevano ricevuto la vaccinazione con mRNA ha mostrato che il 41% non ha sviluppato una protezione vaccinale sufficiente [6]. La risposta alla vaccinazione era particolarmente scarsa se l’immunosoppressione era stata effettuata negli ultimi tre mesi, il trapianto era avvenuto meno di un anno prima e la conta linfocitaria era <1 G/L – tutti fattori già noti da altre vaccinazioni.
Ma anche con una risposta vaccinale dimostrata più scarsa, gli esperti presenti alla conferenza annuale concordano: la vaccinazione rimane la misura di prevenzione più importante – e il basso tasso di vaccinazione il problema più grande. Perché anche se la protezione vaccinale è inferiore nei pazienti immunosoppressi, la vaccinazione non nuoce. Si raccomanda anche prima, durante o dopo la terapia ematologica-oncologica – indipendentemente dal tipo di trattamento. Poiché la protezione non è mediata solo dalle cellule B, ma anche dalle cellule T, anche la deplezione delle cellule B e la terapia ad alto dosaggio con trapianto di cellule staminali ematopoietiche non sono controindicazioni assolute secondo le linee guida di Onkopedia attualmente in vigore [7]. Tuttavia, la risposta alla vaccinazione è maggiore con l’aumentare dell’intervallo di tempo dal trapianto di cellule staminali ematopoietiche. Pertanto, tenendo conto della situazione infettiva, potrebbe essere giustificato un approccio attendista.
Grandi speranze sono attualmente riposte nella terza dose di vaccino, che dovrebbe aumentare la risposta e la durata della risposta vaccinale. Per i pazienti sottoposti a trapianto di organi, è già stato dimostrato che questo ha un effetto duraturo sulla risposta immunitaria [8]. Anche il rischio di corsi gravi nella popolazione generale può essere ridotto in modo significativo dalla terza dose, secondo i dati israeliani [9]. Secondo i dati, questo aumento è di 19,5 volte nelle persone di età superiore ai 60 anni senza vaccinazione di richiamo. Il Prof. Wendtner sospetta che questo effetto sarà visibile anche nei pazienti con neoplasie ematologiche. In uno studio condotto su pazienti dopo il trapianto di cellule staminali allogeniche, è stato dimostrato un miglioramento significativo della risposta alla vaccinazione a partire dalla terza vaccinazione. Tuttavia, il 22% dei partecipanti allo studio non ha raggiunto una risposta vaccinale sufficiente [10]. Secondo il Prof. Wendtner, a seconda della situazione, una vaccinazione di richiamo è possibile già dopo 3-4 mesi, una somministrazione simultanea con la vaccinazione antinfluenzale non presenta problemi ed è un’opzione. La terza vaccinazione dovrebbe in ogni caso essere effettuata con un agente basato sull’mRNA, anche se prima è stato utilizzato un vaccino vettoriale. L’esperto consiglia anche un monitoraggio a bassa soglia della risposta vaccinale nei pazienti ematologici e oncologici, per rassicurare i pazienti e i medici.
Fonte: Conferenze “COVID 19 nelle malattie ematologiche” di Clemens-Martin Wendtner e “COVID-19 nei riceventi di cellule staminali allogeniche” di Eduard Schulz al simposio scientifico “COVID 19 – Parte 1”. Riunione annuale delle Società tedesca, austriaca e svizzera di ematologia e oncologia medica, 02.10.2021, Berlino (D).
Letteratura:
- Williamson EJ, et al: Fattori associati al decesso legato al COVID-19 utilizzando OpenSAFELY. Natura 2020; 584(7821): 430-436.
- Kiani A, et al: I parametri di laboratorio pre-infezione possono predire la gravità di COVID-19 nei pazienti con tumore. Cancer Med 2021; 10(13): 4424-4436.
- Avanzato VA, et al.: Caso di studio: Diffusione infettiva prolungata di SARS-CoV-2 da un individuo immunocompromesso asintomatico con cancro. Cell 2020; 183(7): 1901-1912.e9.
- Hatzl S, et al: Profilassi antimicotica per la prevenzione dell’aspergillosi polmonare associata a COVID-19 nei pazienti critici: uno studio osservazionale. Crit Care 2021; 25(1): 335.
- O’Brien MP, et al: Combinazione di anticorpi REGEN-COV sottocutanei per prevenire la Covid-19. N Engl J Med 2021; 385(13): 1184-1195.
- Redjoul R, et al: Risposta anticorpale dopo la seconda dose di BNT162b2 nei riceventi di HSCT allogenico. Lancet 2021; 398(10297): 298-299.
- Lilienfeld-Toal M, et al: Infezione da Coronavirus (COVID-19) nei pazienti con disturbi del sangue e cancro – Linea guida Onkopedia. Stato aprile 2021. www.onkopedia.com/de/onkopedia/guidelines/coronavirus-infektion-covid-19-bei-patient-innen-mit-blut-und-krebserkrankungen/@@guideline/html/index.html.
- Kamar N, et al: Tre dosi di un vaccino mRNA Covid-19 nei riceventi di trapianti di organi solidi. N Engl J Med 2021. 385: 661-662.
- Bar-On YM, et al: Protezione del richiamo del vaccino BNT162b2 contro la Covid-19 in Israele. N Engl J Med 2021; 385(15): 1393-1400.
- Redjoul R, et al: Risposta anticorpale dopo la terza dose di BNT162b2 nei riceventi di HSCT allogenico. Lancet Haematol 2021; 8(10): e681-e683.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(6): 23-24 (pubblicato l’8.12.21, prima della stampa).