Gli inibitori della poli-ADP-ribosio polimerasi (PARP) hanno aggiunto preziose opzioni al panorama terapeutico del carcinoma ovarico avanzato e sono già stati inseriti nelle linee guida ASCO e NCCN. [1–3]. Con l’aggiunta di un altro inibitore PARP all’elenco delle specialità, un maggior numero di pazienti può ora beneficiare della terapia di mantenimento di prima linea. [4].
Dall’ottobre 2021, i costi terapeutici per la terapia di mantenimento di prima linea del carcinoma ovarico avanzato con l’inibitore PARP niraparib (Zejula®) sono coperti dai fondi di assicurazione sanitaria* [4, 5]. L’ampliamento dell’indicazione si basa sui dati positivi dello studio PRIMA di fase III, in doppio cieco, in cui 733 pazienti con carcinoma ovarico avanzato sono state randomizzate al trattamento con niraparib o placebo dopo aver risposto alla chemioterapia a base di platino. Niraparib ha più che raddoppiato la sopravvivenza mediana libera da progressione (PFS) nei pazienti con deficit di ricombinazione omologa (HRD) e ha ridotto il rischio di progressione o morte del 57%. Sia le pazienti con che quelle senza mutazione BRCA hanno beneficiato di questo trattamento(tabella) [6].
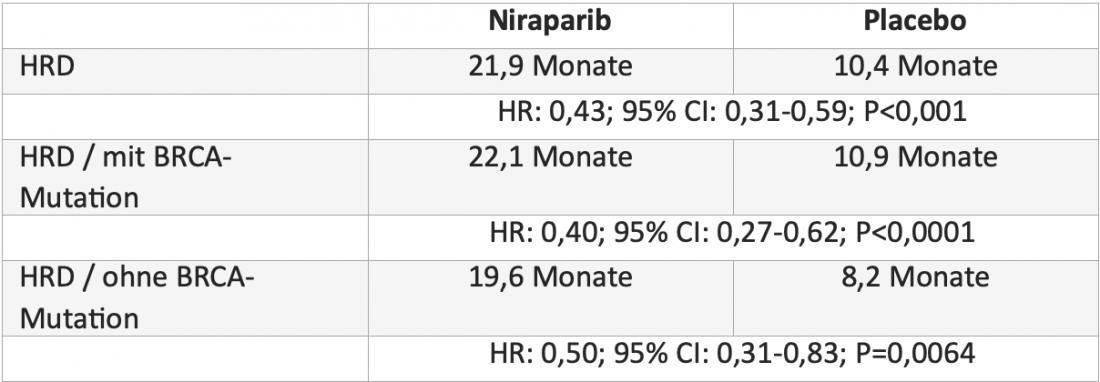 Tabella: Sopravvivenza mediana libera da progressione con niraparib rispetto al placebo nei pazienti con deficit di ricombinazione omologa (HRD) nello studio randomizzato, in doppio cieco di fase III PRIMA [6].
Tabella: Sopravvivenza mediana libera da progressione con niraparib rispetto al placebo nei pazienti con deficit di ricombinazione omologa (HRD) nello studio randomizzato, in doppio cieco di fase III PRIMA [6].
Compatibilità e facilità d’uso consolidate [5, 7].
Gli effetti collaterali di niraparib possono essere ridotti soprattutto interrompendo la terapia o riducendo la dose. In questo contesto, il dosaggio iniziale individualizzato in base al peso corporeo e alla conta piastrinica contribuisce a ridurre gli effetti collaterali senza diminuire l’efficacia [5, 8]. Anche la qualità della vita correlata alla salute non viene compromessa da niraparib [6]. Con l’assunzione orale una volta al giorno, che può essere assunta indipendentemente dai pasti in qualsiasi momento della giornata, il trattamento è anche pratico e non complicato per i pazienti [5].
Niraparib raccomandato dalle linee guida [3].
Secondo le attuali linee guida dell’ASCO sull’uso degli inibitori di PARP, a tutte le pazienti con carcinoma ovarico sieroso di alto grado di nuova diagnosi in stadio III-IV, che hanno avuto una risposta completa o parziale alla chemioterapia di prima linea a base di platino, deve essere offerta una terapia di mantenimento con niraparib, indipendentemente dallo stato BRCA [3]. Il trattamento con niraparib è raccomandato anche dalle linee guida NCCN, indipendentemente dallo stato BRCA [2].
Conclusione
Il niraparib è l’unica monoterapia orale una volta al giorno con PARP inibitore approvata per il trattamento di mantenimento di prima linea delle pazienti con carcinoma ovarico avanzato e HRD, indipendentemente dallo stato BRCA [5, 9]. Con il suo profilo di sicurezza consolidato e la sua pratica maneggevolezza, l’inibitore PARP offre un’opzione di trattamento facile da gestire per il paziente, con un’efficacia comprovata [5, 6].
L’anticorpo anti-PD-1 dostarlimab è ora approvato come opzione terapeutica per il tumore dell’endometrio ricorrente o avanzato (EC) [10]Dostarlimab (Jemperli) è stato approvato in Svizzera dal febbraio 2022 come prima immunoterapia per il trattamento di pazienti con EC recidivato o avanzato con difetto di riparazione del DNA mismatch (dMMR)/alta instabilità dei microsatelliti (MSI-H) che è andato in progressione durante o dopo la terapia a base di platino [10,11]. L’approvazione si basa sui dati dello studio multicentrico di fase I a braccio singolo GARNET, in cui dostarlimab ha portato a una risposta duratura e clinicamente significativa (tasso di risposta obiettiva: 42,3%) in un totale di 104 pazienti con dMMR/ MSI-H studiati. Il profilo degli effetti collaterali era ben gestibile. Le reazioni avverse di terzo grado o superiori più comuni sono state anemia (2,9%), colite (1,9%) e diarrea (1,9%) [12]. |
*con limitazione
Letteratura:
Responsabile del contenuto e finanziato da GlaxoSmithKline AG, Talstr. 3-5, 3053 Münchenbuchsee.
I marchi sono di proprietà dei rispettivi titolari. © 2022 GSK group of companies o il suo licenziatario.
Brevi informazioni tecniche Zejula®
Breve informazione sul soggetto Jemperli