Le malattie mentali hanno un impatto sulla madre e sul feto, nonché sullo sviluppo successivo del bambino. Al contrario, anche la gravidanza può influenzare la malattia. Queste interazioni pongono ai medici curanti una sfida speciale che dovrebbe essere affrontata in modo interdisciplinare.
La depressione durante la gravidanza non è rara. Le cause sono molteplici e vengono modellate in anticipo dal cambiamento ormonale, dai cambiamenti imminenti nelle circostanze di vita e dalla costellazione psicologica, oltre che dalla disposizione genetica. La prevalenza è stimata fino al 10% di tutte le gravidanze. Qualche anno fa, un’ampia statistica dei decessi materni in Inghilterra ha mostrato un aumento dei decessi materni legati al suicidio in gravidanza; dal 2000 al 2002, il suicidio è stato addirittura la causa più frequente di mortalità materna – e quindi più frequente degli eventi cardiaci, del tromboembolismo o dell’emorragia peripartum [1].
Matrice di interazioni
Esistono molteplici interazioni tra la malattia mentale, l’organismo materno e il feto o il suo ambiente intrauterino, che sono in parte dovute a un effetto diretto, in parte mediate indirettamente dalla terapia farmacologica o da un principio attivo nel contesto dell’abuso di sostanze. Queste interazioni strutturate a matrice spesso non sono chiaramente separabili nella pratica clinica quotidiana. Tuttavia, è essenziale considerare i fattori individuali che influenzano sia la donna incinta che il bambino durante l’assistenza prenatale, al fine di ottenere il miglior risultato possibile per la madre e il bambino (Fig. 1). Le malattie mentali (ad esempio, depressione, schizofrenia, dipendenza) possono influenzare la gravidanza in modi diversi.
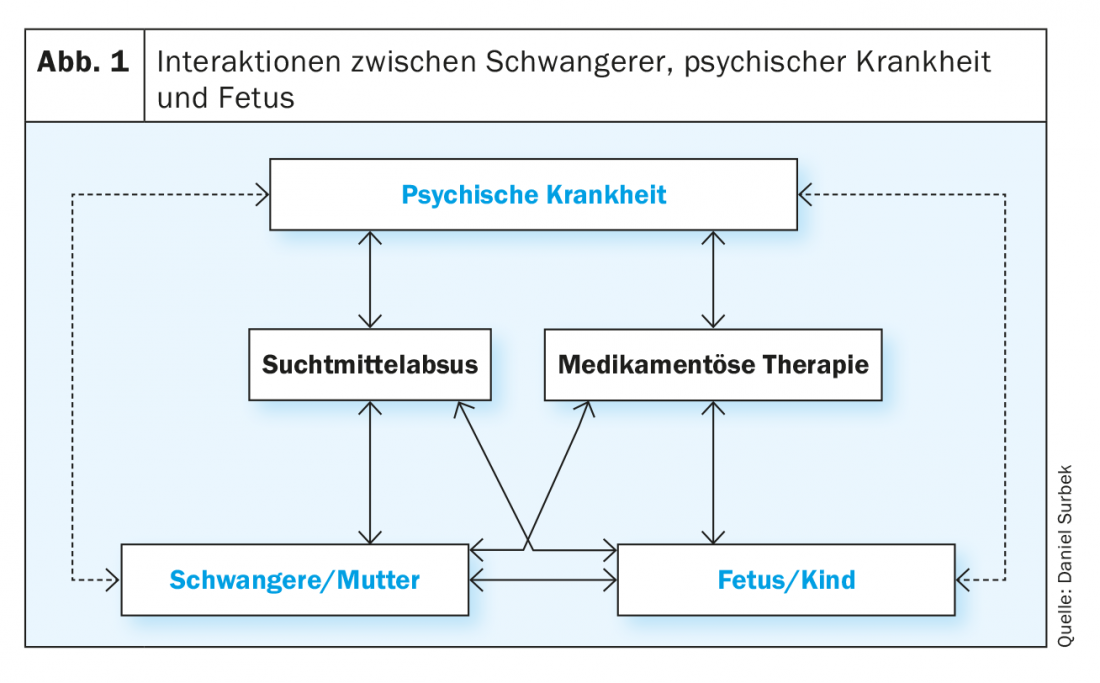
Deterioramento diretto dovuto alla malattia: può essere causato da disturbi del sonno, fattori di stress psicologico e/o sociale, disturbi alimentari, anoressia o mancato aumento di peso, o mancata osservanza delle cure prenatali. Le possibili conseguenze sono:
- restrizione della crescita intrauterina
- Prematurità
- perdita fetale intrauterina
- Complicazioni del parto
Il legame tra stress psicologico e complicazioni della gravidanza è ormai ben studiato. Il mediatore principale è l’ormone di rilascio della corticotropina (CRH), che in questo contesto è chiamato anche “coordinatore della risposta allo stress” [2]. Il CRH svolge un ruolo importante non solo come mediatore del travaglio pretermine e possibilmente della nascita pretermine, ma anche nella riduzione della perfusione placentare, che può portare all’insufficienza placentare con ritardo di crescita intrauterino. Il ritardo di crescita spesso non si manifesta fino al terzo trimestre e a volte è difficile da riconoscere. Bisogna tenere presente che la malattia mentale può portare al suicidio nei casi di depressione grave.
Compromissione indiretta attraverso i farmaci: le malattie mentali influenzano la gravidanza anche attraverso un meccanismo indiretto, mediato dalla terapia farmacologica (vedere sotto). È quindi importante rendersi conto che la malattia mentale in gravidanza ha una notevole prevalenza. Studi recenti dimostrano che la depressione si manifesta fino al 10% durante la gravidanza e la prevalenza tende ad aumentare [3,4]. Gli episodi depressivi, che non soddisfano i criteri di una depressione vera e propria, ma che hanno comunque un effetto invalidante, si verificano addirittura fino al 70% delle donne in gravidanza.
Influenza di una malattia da dipendenza: in questo caso, occorre distinguere tra le diverse classi di sostanze, ciascuna con effetti molto specifici sulla donna incinta o sul feto. Le classi di sostanze e i loro possibili effetti sono discussi di seguito.
Raccomandazioni per l’abuso di sostanze
Abuso di nicotina: ancora molto diffuso, l’abuso di nicotina porta in genere a due importanti patologie della gravidanza: Prematurità e ritardo di crescita intrauterino. È interessante notare che le donne che abusano di nicotina hanno un’incidenza leggermente inferiore di pre-eclampsia. I meccanismi fisiopatologici che portano alla nascita pretermine e al ritardo di crescita intrauterino sono principalmente legati alle sostanze vasoattive presenti nel fumo di sigaretta e agli effetti del monossido di carbonio sull’alimentazione transplacentare del feto. Anche a causa dell’alta prevalenza dell’abuso di nicotina, i programmi di disassuefazione dal fumo per le donne che stanno pianificando una gravidanza o che sono all’inizio di una gravidanza sono tra i metodi più efficaci per ridurre l’alto e ancora crescente tasso di nascite pretermine nella popolazione. L’intervento medico appropriato per le fumatrici è quindi una delle misure preconcettuali più importanti. In linea di principio, la “tolleranza zero” dovrebbe essere applicata alla gravidanza per quanto riguarda l’abuso di nicotina [5].
Abuso di etile: l’ abuso di alcol in quantità significative ha gravi effetti sul feto. A differenza dell’abuso di nicotina, che ha conseguenze sulla gravidanza soprattutto attraverso l’ipofunzione placentare, l’alcol ha un effetto tossico diretto sul feto. Le conseguenze sono circoscritte dalla sindrome alcolica embriofetale. Oltre alle stigmate tipiche del neonato (dismorfia facciale con philtrum alto e piatto, ecc.), questo include microcefalia, malformazioni cardiache e un grave disturbo dello sviluppo psicomotorio e psicosociale, che spesso continua nell’adolescenza. Poiché l’alcol etilico attraversa facilmente la barriera placentare in qualsiasi momento della gravidanza e, in quanto sostanza lipofila, ha un effetto tossico diretto sul cervello fetale in via di sviluppo, esiste una dipendenza diretta dalla dose di alcol in tutti e tre i trimestri per quanto riguarda i disturbi dello sviluppo a lungo termine. Pertanto, in ogni caso, si deve cercare di ridurre la quantità di alcol consumata dagli alcolisti nel corso della gravidanza, quando possibile, se necessario con farmaci psicotropi. È controverso se esista un valore soglia inferiore per la quantità di alcol che può portare alla tossicità fetale. È relativamente ben dimostrato che il consumo di piccole quantità di alcol (un bicchiere di vino a settimana) non ha un effetto negativo sul feto. Tuttavia, il consumo di alcol durante la gravidanza dovrebbe essere completamente sconsigliato [5].
Consumo di oppiacei: il consumo di oppiacei da parte dei tossicodipendenti può avvenire sotto forma di abuso parenterale (morfina, eroina) o come sostituzione enterale (metadone, buprenorfina). Tutte le forme di abuso di oppiacei durante la gravidanza hanno in comune il fatto che il feto si abitua alla sostanza a livello transplacentare, che si manifesta dopo il parto come sindrome di astinenza neonatale da oppiacei. Questo include tremori, pianto stridulo, fasi di sonno solo brevi e persino crampi del neonato. La terapia del neonato di solito include una somministrazione parenterale iniziale di oppiacei, che successivamente deve essere ridotta nel corso di diverse settimane sotto forma di una lenta astinenza. L’uso di oppiacei per via parenterale deve essere evitato in gravidanza, quando possibile. La sostituzione orale con il metadone presenta molti vantaggi, sebbene anch’essa (in modo non lineare e dipendente dalla dose) porti a una sindrome di astinenza neonatale. Se la sostituzione con la buprenorfina invece del metadone comporti un vantaggio per quanto riguarda la sindrome di astinenza neonatale è attualmente oggetto di indagini. In ogni caso, come principio terapeutico, l’obiettivo non deve essere quello di ridurre a zero la sostituzione orale nel corso della gravidanza, poiché l’esperienza ha dimostrato che il rischio di abuso incontrollato di oppiacei parenterali (o di altre sostanze, alcune delle quali sono ancora più pericolose per la gravidanza) aumenta notevolmente.
Cocaina, anfetamine: In questa classe di sostanze, che ha un effetto vasoattivo dose-dipendente, il ritardo di crescita intrauterino, la pre-eclampsia e il parto prematuro sono le principali complicanze della gravidanza. C’è un’alta incidenza di malformazioni fetali (ad esempio, gastroschisi). Il distacco prematuro della placenta è una complicanza acuta tipica e grave, che spesso porta alla morte amniotica intrauterina o a gravi complicazioni materne (shock emorragico, grave disturbo della coagulazione). Per questo motivo, queste sostanze sono talvolta tra le più pericolose in gravidanza, ed è per questo che il loro uso durante la gravidanza dovrebbe essere evitato a tutti i costi.
Tetraidrocannabinolo: l ‘abuso di cannabis durante la gravidanza è molto diffuso. Le possibili conseguenze sono il ritardo di crescita intrauterino e la prematurità. Il tetraidrocannabinolo passa anche la barriera placentare in modo del tutto indisturbato, come l’alcol etilico. I recettori cerebrali dei cannabinoidi sono già presenti nelle prime fasi embrionali. Questo sistema endocannabinoide svolge un ruolo essenziale nella proliferazione, differenziazione e migrazione cellulare. L’esposizione intrauterina ai cannabinoidi esterni può quindi avere un impatto negativo sullo sviluppo neuropsicologico. Inoltre, il metabolismo degli oppioidi endogeni è influenzato dall’abuso di cannabinoidi durante la gravidanza, come è stato dimostrato in modelli animali. Se e da quali dosi si verifica un disturbo dello sviluppo mentale a lungo termine del bambino è discusso in modo diverso. Alcuni studi mostrano un effetto in termini di aumento dell’impulsività nell’infanzia. Sono stati descritti anche sintomi di astinenza neonatale.
Infezioni nei tossicodipendenti: studi clinici confermano che i tossicodipendenti soffrono spesso di infezioni che possono avere conseguenze sulla gravidanza e sul feto. Queste infezioni includono in genere l’epatite B e C, l’HIV, la sifilide, l’infezione genitale da clamidia, l’herpes genitale, la vaginosi batterica e l’infezione genitale da HPV. Le possibili conseguenze di queste infezioni variano a seconda del patogeno. Da un lato, possono portare a un aumento del rischio di parto prematuro (ad esempio, clamidia, vaginosi batterica); dall’altro, può verificarsi una trasmissione verticale intrauterina o subpartum al feto, con conseguenze corrispondenti per il bambino (ad esempio, infezione da HIV, epatite C). Nell’assistenza alle donne in gravidanza con dipendenza, occorre quindi ricercare attivamente le varie infezioni e, se necessario, adottare misure terapeutiche o profilattiche contro la trasmissione verticale.
Effetti della malattia mentale e dei farmaci sul feto
A causa del frequente verificarsi della depressione in gravidanza, l’uso di psicofarmaci è in primo piano. Le statistiche degli Stati Uniti mostrano che l’uso di antidepressivi in gravidanza (soprattutto SSRI) è aumentato dal 2% a circa l’8% negli ultimi dieci anni [4]. È possibile che questo uso diffuso di psicofarmaci non rifletta un aumento generale della depressione in gravidanza, ma piuttosto la consapevolezza che i benefici degli psicofarmaci in gravidanza sono in molti casi superiori ai loro rischi. È ormai assodato che l’interruzione degli antidepressivi durante la gravidanza o addirittura prima del concepimento porta a un alto tasso di recidiva, fino al 75% [6,7]. Inoltre, gli studi hanno dimostrato che la depressione di per sé porta a un esito peggiore della gravidanza, perché causa un frequente ritardo di crescita intrauterino e un aumento della prematurità. A questo si aggiunge l’aumento del rischio di suicidio. In vista di una gravidanza o all’inizio di una gravidanza, quindi, non si dovrebbe forzare in primo luogo l’interruzione del farmaco antidepressivo, ma si dovrebbe esaminare la possibilità di passare a un antidepressivo che sia meglio compatibile con la gravidanza. In questo contesto, ci sono diversi aspetti da considerare per quanto riguarda gli effetti farmacoterapeutici sul feto, che verranno discussi di seguito.
La teratogenicità è caratterizzata dall’induzione esogena di malformazioni degli organi, con un’esposizione che si verifica principalmente durante la fase embrionale (fase delicata dello sviluppo degli organi). La fase embrionale è definita fino alla fine dell’ottava SSW post-concepimento (cioè fino alla decima SSW dopo l’ultima mestruazione). Nelle prime due settimane dopo il concepimento, l’embrione si trova nello stadio di blastocisti. In questo caso, di solito si assume il principio del ‘tutto o niente’: Eventuali influenze tossiche non portano a malformazioni degli organi, ma a un impianto disturbato della blastocisti nell’endometrio e successivamente a un aborto spontaneo.
La fase importante della teratogenicità si estende quindi dalla seconda all’ottava settimana dopo il concepimento. Nella fase fetale successiva, la maggior parte degli organi ha completato le fasi più importanti della differenziazione. C’è soprattutto una crescita e al massimo una maturazione funzionale. Tuttavia, ci sono organi che continuano a differenziarsi durante la fase fetale. Questi includono il cervello fetale e il tratto urogenitale del feto.

I riquadri a pagina 8 spiegano due esempi di interazione tra l’uso di droghe e lo sviluppo embrionale. Mostrano la complessità di questa relazione e la necessità di una valutazione individuale del rischio e di un adeguamento della psicofarmacoterapia. In definitiva, è importante soppesare i possibili effetti collaterali indesiderati rispetto agli effetti benefici (che spesso superano gli effetti avversi della psicofarmacoterapia in gravidanza).

Effetti a lungo termine della malattia mentale sul bambino
Sulla base dell’ipotesi Barker, è stato dimostrato che le influenze prenatali sul feto (ambiente intrauterino) determinano la programmazione di singoli sistemi di organi o processi metabolici, che hanno effetti per tutta la vita sul bambino (“programmazione fetale”). L’esempio più importante è l’associazione tra il basso peso alla nascita nel ritardo di crescita intrauterino e il rischio successivo di malattie cardiovascolari. Oggi ci sono anche prove che l’esposizione prenatale può avere conseguenze sulla salute mentale. In uno studio, ad esempio, è stato riscontrato un aumento del rischio di suicidio nell’adolescenza e nell’età adulta nelle persone con basso peso alla nascita [8]. Ulteriori studi mostrano un rischio significativamente maggiore di depressione in età adulta nei neonati pretermine e di basso peso alla nascita [9,10]. Si ritiene che la chiave del legame fisiopatologico tra l’esposizione intrauterina a determinate condizioni e la successiva malattia psichiatrica sia mediata dall’asse dello stress del cortisolo. Questo è già evidente nell’esposizione allo stress intrauterino a breve termine, come abbiamo dimostrato nel nostro studio pubblicato di recente sulla relazione tra diversi fattori di stress legati alla modalità di nascita, i livelli di cortisolo e la percezione del dolore post-partum [11]. I figli di madri con una malattia psichiatrica hanno un rischio maggiore di ammalarsi in seguito. A differenza di una predisposizione genetica, l’esposizione intrauterina è in linea di principio accessibile terapeuticamente.
I nostri sforzi nell’assistenza alle donne in gravidanza con disturbi mentali devono quindi andare nella direzione non solo di migliorare l’esito a breve termine della gravidanza, ma anche di prendere in considerazione le possibili conseguenze a lungo termine per il bambino e le loro possibilità di prevenzione.
Come prendersene cura?
Quando ci si prende cura della donna incinta con malattia mentale, si devono prendere in considerazione i possibili effetti reciproci. Include quindi 1) la malattia mentale della donna, 2) l’unità utero-placentare e 3) il feto come secondo paziente. In particolare, l’assistenza alle donne in gravidanza con dipendenza richiede un concetto di assistenza globale che includa sempre più l’ambiente sociale della paziente e le risorse esistenti. L’assistenza medica ostetrica o prenatale specifica si concentra sulla prevenzione, sulla diagnosi precoce e sulla terapia dei possibili effetti. Questo include i seguenti aspetti chiave:
Pilastro I: la consulenza preconcezionale deve essere effettuata dal ginecologo/ostetrica insieme o in consultazione con lo psichiatra responsabile. Idealmente, prima di sospendere la contraccezione, si dovrebbe elaborare un piano appropriato per la gravidanza. Si dovrebbe anche cercare di pianificare la gravidanza nel momento più favorevole rispetto alla malattia mentale. Inoltre, devono essere considerati anche gli aspetti terapeutici (scelta dei farmaci) e preventivi (profilassi multivitaminica/acido folico, riduzione o interruzione dell’abuso di sostanze). Se la gravidanza è già in atto, la consulenza deve essere avviata il prima possibile all’inizio della gravidanza.
Pilastro II: L’elemento più importante nella diagnosi di sviluppi intrauterini patologici è l’esame ecografico prenatale specializzato. Ciò significa che le malformazioni fetali possono talvolta essere rilevate precocemente (12a settimana di gravidanza). L’ecografia specializzata è di particolare importanza perché molte malformazioni (ad esempio quelle cardiache) sono difficili da diagnosticare e la diagnosi precoce può migliorare significativamente l’esito successivo del bambino. Una consulenza dettagliata e non direttiva sulle possibilità di diagnosi prenatale deve avvenire in anticipo, compreso il “diritto di non sapere”. Inoltre, alcune malformazioni gravi possono essere trattate intrauterine, mentre la terapia postnatale non è più possibile. In una costellazione corrispondente con grave compromissione psicologica della paziente, può essere necessario prendere in considerazione un aborto. Altri punti focali della diagnostica sono gli esami ecografici longitudinali e ravvicinati della lunghezza del collo dell’utero, della crescita intrauterina e dell’emodinamica fetale e uteroplacentare (esami Doppler). Oggi è possibile prevedere il ritardo di crescita intrauterino o la pre-eclampsia nelle prime fasi della gravidanza, grazie alle misurazioni del flusso sanguigno e a ulteriori test biochimici. Le gravidanze con malattie mentali devono essere considerate come gravidanze ad alto rischio, motivo per cui è necessaria un’assistenza medica prenatale specializzata.
Pilastro III: Gli interventi terapeutici in caso di malformazioni fetali consistono nella prevenzione della prematurità con misure mediche (ad esempio, terapia con progesterone) o chirurgiche (ad esempio, cerchiaggio) appropriate. Soprattutto in caso di aumento del rischio di prematurità, la terapia fetale mediante l’applicazione di glucocorticoidi transplacentari correttamente dosati (“induzione della maturazione polmonare”) è spesso centrale, in quanto può ridurre la morbilità e la mortalità fetale del 50% in caso di parto prematuro. In caso di costellazione ad alto rischio di ritardo di crescita intrauterino e di pre-eclampsia, la profilassi farmacologica (acido acetilsalicilico 100 mg al giorno, integrazione di calcio 1-2 mg al giorno) è efficace, purché sia somministrata in tempo. Se si è già verificato un grave ritardo di crescita intrauterino con le relative alterazioni emodinamiche, o in caso di preeclampsia grave, una gestione ospedaliera appropriata con monitoraggio intensivo del feto e parto tempestivo in caso di esacerbazione è la misura terapeutica più importante. In ogni caso, se la donna incinta è malata di mente e se ci sono complicazioni durante la gravidanza, è imperativo che riceva un’assistenza interdisciplinare in un centro terziario, al fine di ottenere il miglior risultato per la madre e il bambino.
Messaggi da portare a casa
- Le malattie mentali hanno una serie di effetti sul decorso della gravidanza, nonché sul feto e sullo sviluppo del bambino.
- Al contrario, la gravidanza può avere un effetto su una malattia mentale attraverso varie influenze, in parte ormonali, o favorirne la manifestazione clinica iniziale.
- La matrice multistrato di interazioni rappresenta una sfida particolare per l’assistenza interdisciplinare ai pazienti, con psichiatri e ginecologi/ostetrici in prima linea.
- L’assistenza prenatale è spesso complessa e impegnativa e richiede quindi la collaborazione con un centro specializzato per ottenere il miglior risultato per la madre e il bambino.
Letteratura:
- Hobel CJ, Goldstein A, Barrett ES: Stress psicosociale ed esito della gravidanza. Clin Obstet Gynecol 2008; 51(2): 333-348.
- Drife J: Perché le madri muoiono. J R Coll Physicians Edinb 2005; 35: 332-336.
- Bennett HA, et al: Prevalenza della depressione durante la gravidanza: revisione sistematica. Obstet Gynecol 2004; 103(4): 698-709.
- Andrade SE, et al: Uso di farmaci antidepressivi durante la gravidanza: uno studio multisito. Am J Obstet Gynecol 2008; 198(2): 194, e1-5.
- Bürki RE, et al.: Raccomandazioni attuali sulla consulenza preconcezionale. Lettera degli esperti n. 33, Società Svizzera di Ginecologia e Ostetricia, 2010. www.sggg.ch/fileadmin/user_upload/33_Praekonzeptionsberatung_2010.pdf, ultimo accesso 05.03.19.
- Cohen LS, et al: Ricaduta della depressione durante la gravidanza dopo l’interruzione degli antidepressivi: uno studio prospettico preliminare. Arch Womens Ment Health 2004; 7(4): 217-221.
- Cohen LS, et al: Ricaduta della depressione maggiore durante la gravidanza in donne che mantengono o interrompono il trattamento antidepressivo. JAMA 2006; 295(5): 499-507. erratum in: JAMA 2006; 296(2): 170.
- Barker DJ, et al: Basso aumento di peso nell’infanzia e suicidio in età adulta. BMJ 1995; 311(7014): 1203.
- Patton GC, et al: Prematurità alla nascita e disturbo depressivo adolescenziale. Br J Psychiatry 2004; 184(5): 446-447.
- Thompson C, et al: Il peso alla nascita e il rischio di disturbo depressivo in tarda età. Br J Psychiatry 2001; 179: 450-455.
- Schuller C, et al: Risposta allo stress e al dolore dei neonati dopo il parto spontaneo, il parto assistito e il parto cesareo. Am J Obstet Gynecol 2012; 207(5): 416.e1-6.
- Koren G, Nordeng H: Uso di antidepressivi durante la gravidanza: il rapporto beneficio-rischio. Am J Obstet Gynecol 2012; 207(3): 157-163.
- Hviid A, Melbye M, Pasternak B: Uso di inibitori selettivi della ricaptazione della serotonina durante la gravidanza e rischio di autismo. N Engl J Med 2013; 369: 2406-2415.
InFo NEUROLOGIA & PSICHIATRIA 2019; 17(2): 6-12.











