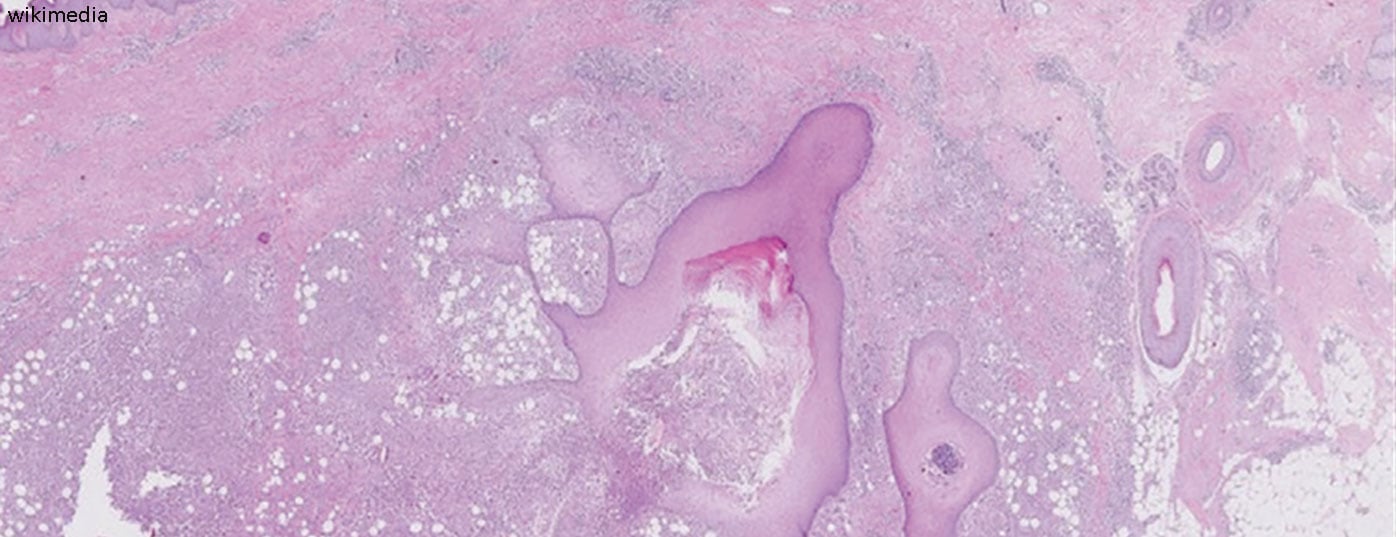
Le alterazioni cutanee che si verificano nell’hidradenitis suppurativa (HS), in particolare nelle aree intertriginose, possono essere molto preoccupanti per le persone colpite. Da alcuni anni, la ricerca sulle complesse interrelazioni è stata intensificata nella speranza di ridurre il numero di casi di HS. La consapevolezza di questa condizione, che spesso è associata a comorbidità/malattie concomitanti, è fondamentale per poter fornire alle persone colpite un trattamento adeguato.
L’idradenite suppurativa – nota anche come acne inversa – è una malattia cronica e ricorrente, caratterizzata da noduli, ascessi e fistole dolorosi e ricorrenti, dovuti all’infiammazione del follicolo pilifero. “Si tratta di un quadro clinico ben noto, ma che ha ricevuto sufficiente attenzione solo negli ultimi due decenni”, ha spiegato la dottoressa Cornelia Erfurt-Berge, medico senior della Clinica Dermatologica dell’Ospedale Universitario di Erlangen [1]. La fisiopatologia è oggi molto meglio compresa rispetto a qualche anno fa, anche se ci sono ancora domande senza risposta. “Quello che sappiamo è che c’è una reazione infiammatoria eccessiva nell’area del follicolo pilifero e che alcune tossine ambientali/fattori esogeni come il fumo o l’obesità giocano un ruolo”, ha detto il relatore. Si presume che l’ipercheratosi alla fine porti all’occlusione follicolare e che l’infiammazione e i focolai di batteri si formino nel tessuto circostante come risultato della chiusura delle ghiandole apocrine e della successiva rottura dei follicoli [1,8].
Vengono attivate le vie di segnalazione pro-infiammatorie.
Il fatto che l’occlusione follicolare si verifichi inizialmente a causa dell’ipercheratosi può essere dedotto dagli esami istologici [2,8]. La chiusura delle ghiandole apocrine e la successiva rottura dei follicoli piliferi inducono una risposta immunitaria infiammatoria associata al reclutamento di neutrofili, macrofagi, cellule B, cellule Th1 e Th17 nella pelle, portando a noduli infiammatori o alla formazione di ascessi [2]. Le vie di segnalazione proinfiammatorie contribuiscono in modo significativo allo sviluppo dell’HS. In relazione allo spostamento delle cellule T, si verifica un aumento della produzione di citochine pro-infiammatorie come il TNF-alfa e l’interleuchina (IL)-17, che contribuiscono al mantenimento dell’infiammazione. Ci sono anche prove che i recettori toll-like sono regolati in modo diverso nell’HS rispetto alla pelle sana e che i peptidi antimicrobici per la difesa batterica hanno un modello di espressione alterato [1]. “Si tratta di interrelazioni complesse che stiamo comprendendo sempre meglio”, ha riassunto il dottor Erfurt-Berge.
Rafforzare la consapevolezza ed evitare la latenza diagnostica
Se l’HS non viene diagnosticata in tempo e trattata adeguatamente, si possono sviluppare complicazioni o cambiamenti secondari, come la formazione di tratti fistolosi e cicatrici nelle aree intertriginose (ascellari, inguinali, genitali). Secondo il relatore [1], questo può portare a notevoli limitazioni nei movimenti. La qualità di vita dei pazienti affetti da HS è spesso gravemente limitata. Le donne e gli uomini sono colpiti in numero approssimativamente uguale; in termini di fascia d’età, la prevalenza è più alta tra i giovani, con un’età media di circa 23 anni [1]. Negli ultimi anni ci sono stati miglioramenti in termini di diagnosi, ma la latenza della diagnosi è ancora un problema, ha sottolineato il relatore [1]. La diagnosi di HS viene fatta principalmente a livello clinico; il criterio temporale è costituito da almeno due ricadute nell’arco di sei mesi. Nelle fasi iniziali, la malattia viene spesso confusa con i comuni ascessi o la follicolite.
Esistono diversi punteggi per classificare l’HS, i più comuni sono il punteggio Sartorius e gli stadi Hurley [3–5]. Con il punteggio Sartorius, il numero di noduli infiammatori, ascessi, fistole e aree interessate viene valutato con punti. La classificazione di Hurley distingue i seguenti tre gradi di gravità a seconda della manifestazione clinica [4,6].
- Fase I: Ascessi dolorosi isolati, singoli o multipli, senza filamenti cicatriziali;
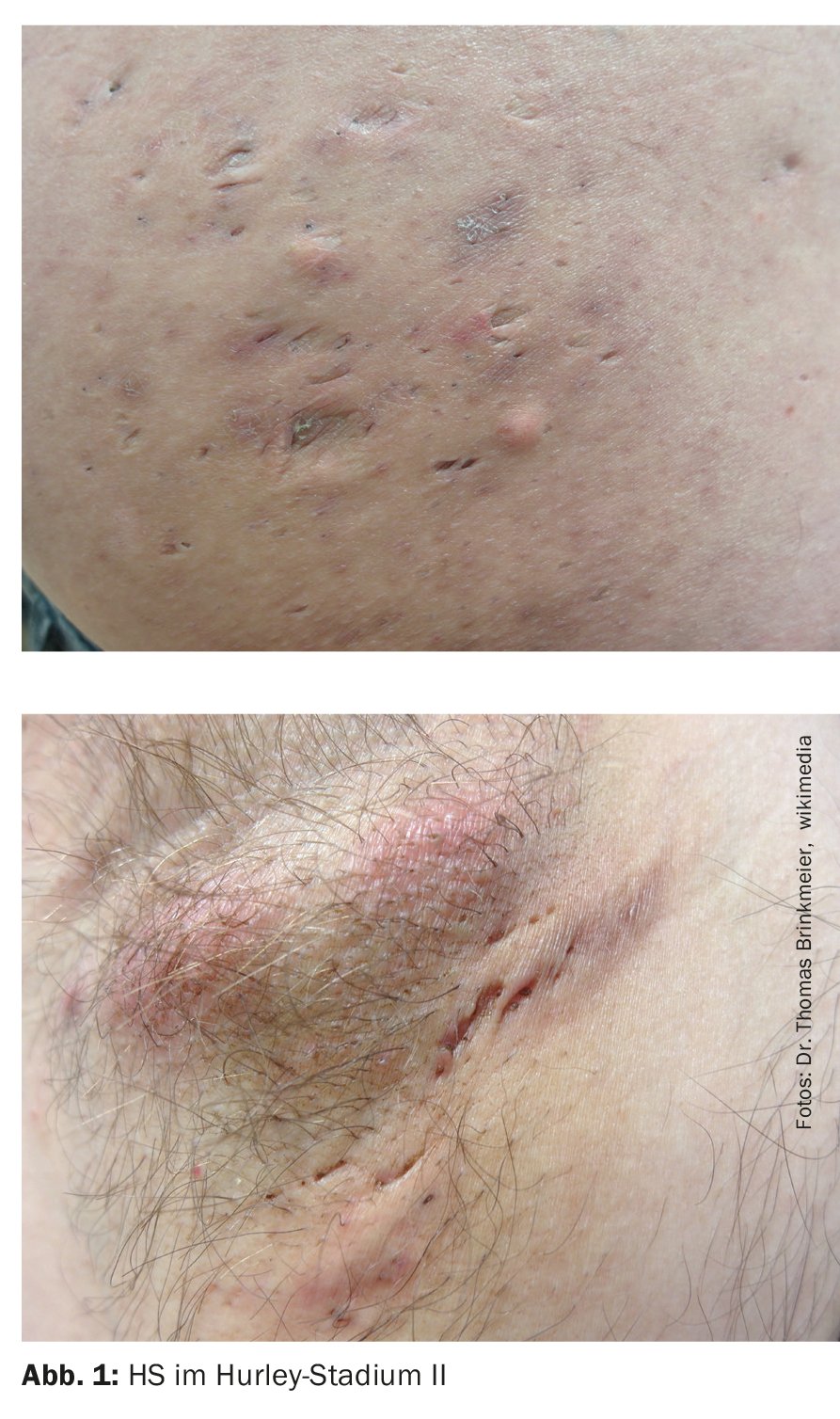
- Stadio II: ascessi dolorosi ricorrenti con formazione di cordoni e cicatrici, singoli o multipli, ma non estesi (Fig. 1);
- Stadio III: infiltrazioni infiammatorie diffuse, a placche, dolorose, o filamenti multipli interconnessi e ascessi. Esiste il rischio di contratture articolari come conseguenza della limitazione del movimento legata al dolore.
Bisogna anche tenere presente che l’HS è spesso associata a comorbidità e malattie concomitanti, la cui eventuale presenza deve essere indagata. Questi includono problemi alle articolazioni, malattie infiammatorie croniche intestinali (IBD), sindrome metabolica, obesità e diabete [2,7]. Questi fattori possono avere un effetto negativo sui sintomi dell’HS. Anche i disturbi psichiatrici sono più frequenti. In generale, la qualità della vita con l’HS è spesso significativamente compromessa.
Quali sono gli approcci terapeutici disponibili oggi?
Se possibile, i pazienti affetti da HS devono ricevere un trattamento adeguato prima che i focolai di ascesso si espandano e si formino dei tratti di fistola. Il trattamento dipende dalla gravità della malattia. Il trattamento chirurgico è ancora considerato il gold standard, soprattutto per le forme gravi di HS, ma il trattamento farmacologico sistemico sta diventando sempre più importante, afferma il dottor Erfurt-Berge. Se necessario, la chirurgia e la terapia sistemica possono essere combinate. L’escissione locale è un’opzione solo per lo stadio I di Hurley. Le incisioni pure portano sempre a recidive. Un’altra tecnica è il deroofing (elettrochirurgico, laser). Nei casi particolarmente gravi (Hurley II o III), è necessaria un’ampia resezione “in blocco” per rimuovere l’intera area interessata [8]. Oltre alla clindamicina/rifampicina come terapie sistemiche convenzionali, due biologici, adalimumab e secukinumab, sono ora disponibili per il trattamento farmacologico e altri sono attualmente in fase di studio clinico [1]. L’indicazione per l’applicazione topica della clindamicina è limitata agli stadi Hurley I e II. Importanti misure di accompagnamento nel trattamento dell’HS sono i fattori legati allo stile di vita, come la riduzione del peso, la cessazione del fumo e gli abiti larghi [1].
Congresso: Congresso sulle ferite di Norimberga
Letteratura:
- “Acne inversa – nuovi approfondimenti su un quadro clinico noto”, PD Dr med C. Erfurt-Berge, Congresso sulle ferite di Norimberga, 23-24 novembre 2023.
- Vossen A, van der Zee HH, Prens EP: Hidradenitis suppurativa: una revisione sistematica che integra i percorsi infiammatori in un modello patogenetico coesivo. Front Immunol 2018; 9: 2965.
- Hunger RE, et al: Raccomandazioni pratiche svizzere per la gestione dell’Hidradenitis Suppurativa/Acne inversa. Dermatologia 2017; 233: 2-3.
- Revuz J: Hidradenitis suppurativa. JEADV 2009; 23: 985-998.
- Hunger RE, et al: Raccomandazioni pratiche svizzere per il trattamento dell’hidradenitis suppurativa (acne inversa). Compass Dermatol 2019; 7 (1): 8-13.
- Hurley HJ: Iperidrosi ascellare, bromidrosi apocrina, hidradenitis suppurativa e pemfigo benigno familiare: approccio chirurgico. In: Roenigk RK, Roenigk HH, Jr. [Eds]. Chirurgia dermatologica: principi e pratica.2ª ed. New York: Marcel Dekker 1996: 623-645.
- Molinelli E, et al: Nuove conoscenze sul meccanismo molecolare della patologia e sui trattamenti immunomodulatori dell’Hidradenitis Suppurativa. Int J Mol Sci 2023; 24(9): 8428.
- Zouboulis CC, et al. Linea guida europea S1 per il trattamento dell’hidradenitis suppurativa/acne inversa. JEADV 2015; 29(4): 619-644.
DERMATOLOGIE PRAXIS 2024; 34(1): 38-39 (pubblicato il 19.2.24, prima della stampa)