La modulazione dei recettori S1P è un obiettivo terapeutico importante e interessante nella gestione del trattamento della sclerosi multipla, a causa della loro diversità funzionale. Attualmente sono disponibili tre modulatori del recettore S1P per i pazienti affetti da SMRR e uno per i pazienti affetti da SPMS. Nessuno dei modulatori del recettore S1P ha mostrato un effetto negativo sulla cognizione e sulla fatica.
La sclerosi multipla (SM) è una malattia neurologica comune che porta alla demielinizzazione e al danno assonale attraverso l’infiammazione cronica immuno-mediata del sistema nervoso centrale (SNC) [1]. La maggior parte delle persone colpite (circa l’85%) ha inizialmente un decorso recidivante-remittente (SMRR), che nel corso della malattia si trasforma in una fase secondaria cronica progressiva [2]. La SMRR è definita da ricadute con sintomi clinici nuovi o in aumento. Seguono fasi di remissione parziale o completa. Durante le fasi di remissione, la progressione della malattia non è evidente [1,2].
La diagnosi di SM richiede l’evidenza oggettiva di un evento infiammatorio nel sistema nervoso centrale e l’ulteriore evidenza di una diffusione spaziale e temporale del processo patologico (disseminazione nello spazio e nel tempo). Gli esami paraclinici più importanti per confermare la diagnosi sono la risonanza magnetica (RM) e l’esame del liquido cerebrospinale (CSF) [3].
Oggi c’è un consenso sul fatto che le ricadute da sole non sono significative in termini di processo della malattia e del suo sviluppo. Pertanto, il numero di ricadute fornisce poche informazioni sull’entità del danno strutturale e funzionale effettivamente presente. Inoltre, la perdita di volume cerebrale, che può verificarsi molto presto nel corso della malattia, non è necessariamente associata all’attività di spinta. Da una prospettiva patologica, il danno tissutale attivo nella SM è associato all’infiammazione. Inoltre, è probabile che altri meccanismi, come lo stress ossidativo che porta al danno mitocondriale, siano coinvolti nell’induzione della demielinizzazione e della neurodegenerazione sia nella fase recidivante che in quella progressiva della SM [4]. Poiché né la fase RR né la fase progressiva della SM hanno caratteristiche patologiche o meccanicistiche distintive, le differenze quantitative piuttosto che qualitative tra queste fasi sembrano essere responsabili del fenotipo predominante che ne deriva [4,5]. La moderna terapia della SM oggi mira alla diagnosi precoce e all’uso precoce di farmaci modificanti la progressione, al fine di influenzare il più favorevolmente possibile la progressione della disabilità in una fase iniziale [1,2,6].
Stanchezza e problemi cognitivi
Tuttavia, non è solo la progressione fisica della disabilità a rappresentare una sfida importante per i pazienti affetti e i medici curanti. Nella vita di tutti i giorni, si tratta soprattutto di sintomi come la stanchezza e i problemi cognitivi. Si stima che il 75-95% di tutti i pazienti con SM soffra di affaticamento e il 40-50% di deterioramento cognitivo [7]. Entrambi i sintomi hanno gravi effetti sulla partecipazione sociale, sulla capacità lavorativa e sulla qualità di vita complessiva [7,8]. È importante includere i suddetti sintomi nella valutazione della progressione e registrarli regolarmente, una volta all’anno, con strumenti sensibili, indipendentemente dall’EDSS [9]. Questo permette di valutare il rispettivo individuo nel corso longitudinale. Per quanto riguarda la cognizione, è dimostrato che i pazienti che presentano già anomalie cognitive al momento della diagnosi sono a maggior rischio di patologia aggressiva con grave progressione della disabilità [10]. Da questo, si potrebbe ricavare un algoritmo terapeutico più adatto al caso individuale fin dall’inizio.
Poiché la stanchezza è il sintomo che, insieme ai disturbi cognitivi, è responsabile del pensionamento anticipato e dell’invalidità, nella scelta dell’immunoterapia bisogna fare attenzione a non utilizzare farmaci che si prevede possano intensificare i sintomi.
Terapie che modificano il decorso
Le opzioni di trattamento che modificano la malattia sono note come terapie che modificano la malattia (DMT) e possono essere somministrate sotto forma di compresse, capsule, iniezioni o infusioni. L’obiettivo è ridurre sia il tasso di ricaduta annuale che la progressione. Sono disponibili preparati con diverse modalità d’azione. In questo articolo, ci concentriamo sui modulatori del recettore S1P. In Svizzera, sono attualmente approvati quattro preparati di questa classe di farmaci: fingolimod, ozanimod e ponesimod per la SMRR, siponimod come unico modulatore del recettore S1P per i pazienti affetti da SPMS [11–14].
Recettori della sfingosina-1-fosfato
Le sfingosine sono componenti strutturali della membrana cellulare da cui si formano molti lipidi bioattivi, come S1P. Si tratta di un metabolita lipidico bioattivo multifunzionale che agisce come molecola di segnalazione solubile e circola nel sangue e nel sistema linfatico [15]. S1P è coinvolta in una serie di processi fisiologici e fisiopatologici attraverso la sua interazione con i recettori S1P, che sono recettori di superficie cellulare accoppiati a proteine G ad alta affinità che si trovano in tutto il corpo [16].
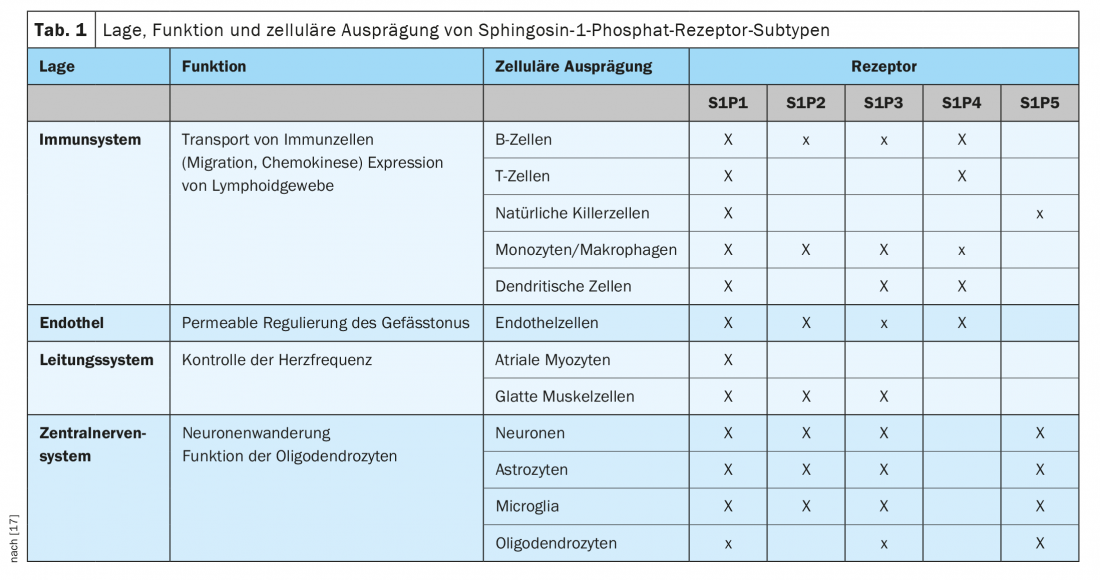
S1P ha un’affinità di legame per cinque diversi sottotipi di recettori S1P, attraverso i quali vengono trasdotti i segnali cellulari. I recettori S1P1, S1P2 e S1P3 sono espressi in modo ubiquitario, e ogni sottotipo ha una diversa specificità cellulare. Al contrario, l’espressione dei recettori S1P4 e S1P5 è meno diffusa. I recettori S1P4 sono limitati al tessuto linfoide ed ematopoietico, mentre i recettori S1P5 si trovano nella milza e nella materia bianca del SNC, soprattutto negli oligodendrociti (Tab. 1) [17].
Di conseguenza, i recettori S1P sono coinvolti in molte funzioni biologiche, tra cui la proliferazione cellulare, l’angiogenesi, l’organizzazione citoscheletrica, la chemiotassi delle cellule endoteliali, il trasporto delle cellule immunitarie e la mitogenesi. Svolgono anche un ruolo nello sviluppo del cervello e del cuore, nella proliferazione delle cellule della pelle, nella permeabilità vascolare e nella regolazione del tono vascolare e bronchiale [18]. Questa diversità funzionale rende la modulazione dei recettori S1P un bersaglio terapeutico interessante e importante.
Lo sviluppo dei modulatori S1PR
I modulatori del recettore S1P possono agire sia come antagonisti funzionali che come agonisti tradizionali, a seconda del sottotipo o dei sottotipi del recettore S1P presi di mira, e possono avere diverse specificità [19]. Si tratta di piccole molecole da somministrare per via orale. Il principale meccanismo immunologico dei modulatori del recettore S1P si basa sulla regolazione della migrazione dei linfociti attraverso l’interazione con il recettore S1P1. Questo meccanismo si basa su un gradiente di concentrazione di S1P, che è fisiologicamente più alto nel sangue che nei tessuti linfatici. Quando il ligando lega il recettore sulle cellule che esprimono il recettore 7 delle chemochine con motivo C-C (CCR7), il recettore S1P1 viene internalizzato e degradato, con conseguente perdita di reattività al gradiente S1P. Di conseguenza, i linfociti vengono trattenuti nel timo e negli organi linfoidi secondari, determinando un numero inferiore di linfociti nel sangue periferico e limitando la migrazione delle cellule infiammatorie [20].
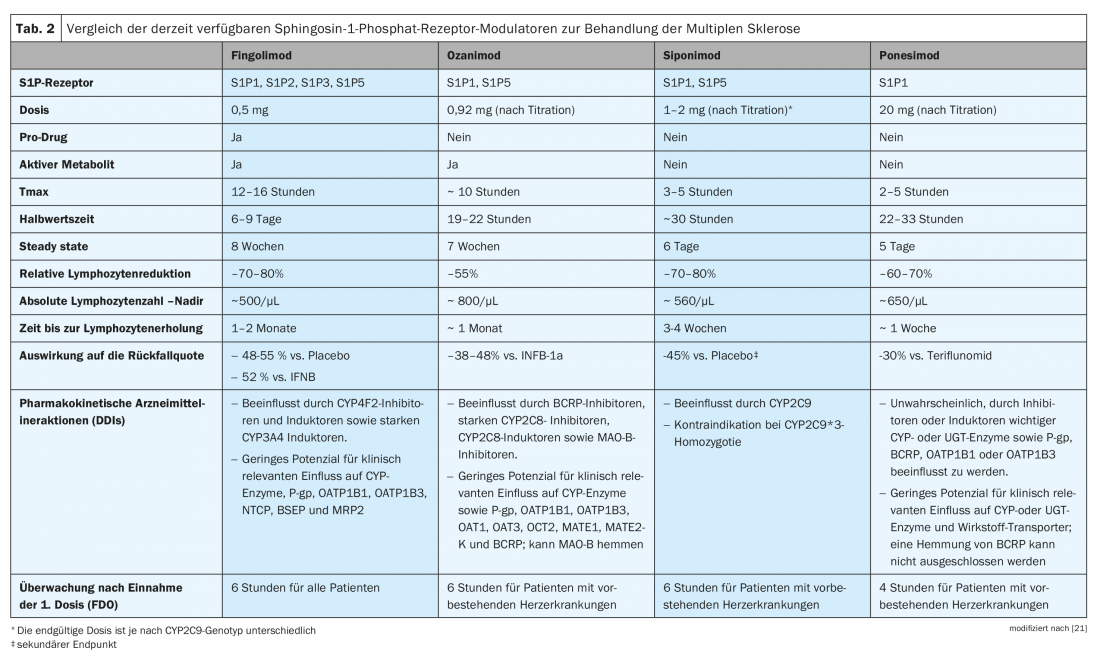
Alcuni dei modulatori del recettore S1P agiscono come prodromi (fingolimod) che richiedono la fosforilazione o altre fasi metaboliche per essere convertiti nel composto farmacologicamente attivo, mentre altri sono farmaci direttamente attivi (siponimod, ozanimod, ponesimod). Pertanto, nonostante un meccanismo d’azione comparabile, i modulatori S1PR hanno proprietà farmacocinetiche diverse (Tab. 2) [21]. Per prendere una decisione terapeutica su misura, è quindi essenziale considerare i preparati della classe di principi attivi in modo differenziato.
I modulatori S1PR in sintesi
Fingolimod (FTY) è stato il primo modulatore S1PR approvato per la terapia della SMRR. Il fingolimod cloridrato è stereoselettivamente fosforilato nel metabolita attivo (S)-fingolimod fosfato, principalmente nel fegato, dalla sfingosina chinasi-2 (SphK-2). Si tratta di un analogo di S1P. La modulazione del recettore porta a una downregulation dei recettori sulla superficie cellulare e riduce la sensibilità al ligando endogeno. Blocca quindi l’uscita dei linfociti dai linfonodi nel flusso sanguigno periferico e riduce il numero di linfociti nel sangue al 20-30% del valore iniziale. Poiché l’attivazione di S1PR3 può portare a un effetto agonistico iniziale sulle cellule cardiache, causando blocchi atrioventricolari (AV), è necessario effettuare una valutazione completa prima di iniziare la terapia. Il paziente deve essere valutato per bradicardia, long-QT, blocco AV e altri fattori di rischio di aritmia e monitorato per sei ore dopo la prima somministrazione. -Inoltre, le condizioni preesistenti dovrebbero essere escluse. Gli enzimi epatici, l’emocromo e la pressione sanguigna devono essere monitorati costantemente. Se i linfociti scendono sotto i 200/ml, è indicata un’interruzione del trattamento. I livelli elevati di enzimi epatici potrebbero essere affrontati con una riduzione della dose di fingolimod ogni due giorni. Tuttavia, questo può comportare una riduzione dell’efficacia. Soprattutto nei pazienti più giovani e in quelli passati da natalizumab, esiste il rischio di effetti di rimbalzo con un aumento del rischio di ricadute e di attività radiologica [22,23].
I dati degli studi che confrontano fingolimod con placebo o interferone beta 1a hanno mostrato una riduzione delle ricadute di circa il 50% e una riduzione dello sviluppo di lesioni cerebrali nuove o ingravescenti del 74% all’indirizzo [24–26]. Inoltre, è stata dimostrata un’influenza favorevole sulle prestazioni cognitive, misurate con il PASAT-3, con fingolimod rispetto al placebo [27]. Tuttavia, è stato riscontrato che il modulatore S1PR aumenta il rischio di infezioni da virus dell’herpes e da criptococco, con un rischio che aumenta con la durata del trattamento e con l’età avanzata [28]. Altre complicazioni potenzialmente gravi possono includere danni epatici con innalzamento delle transaminasi, cancro della pelle come il carcinoma basocellulare e complicazioni oculari (ad esempio edema maculare, emorragia retinica e occlusione della vena retinica).
Siponimod è stato approvato in Svizzera nel 2020 per il trattamento della sindrome clinicamente isolata, della sclerosi multipla recidivante-remittente e della sclerosi multipla secondaria progressiva attiva [29,30]. Questo inibitore S1PR si lega selettivamente ai sottotipi S1PR1 e S1PR5. Il farmaco impedisce quindi la migrazione dei linfociti dai linfonodi e riduce il ricircolo delle cellule T nel sistema nervoso centrale (SNC) per limitare l’infiammazione nel SNC. L’ipotesi alla base di questo presuppone un minor numero di effetti fuori bersaglio rispetto al fingolimod [30]. Analogamente a fingolimod, è necessario controllare le condizioni preesistenti, come le malattie degli occhi, del ritmo cardiaco e del fegato gravi, e aggiornare lo stato di vaccinazione (ad esempio, la varicella). Altre possibili complicazioni associate all’immunosoppressione indotta includono un aumento del rischio di infezioni e di cancro della pelle. I possibili effetti collaterali all’inizio della terapia (ad esempio, bradicardia, blocco AV) possono essere ridotti con l’aiuto di uno schema di titolazione. Questo prevede la somministrazione di 0,25 mg al giorno nei giorni 1 e 2, seguiti da 0,5 mg il giorno 3, 0,75 mg il giorno 4, 1,25 mg il giorno 5, seguiti da una dose di mantenimento di 2 mg al giorno. Si noti che siponimod viene metabolizzato principalmente dal CYP2C9. Una variante meno comune di questo enzima (CYP2C9*3) ha un’attività metabolizzante ridotta. Per questo motivo, gli eterozigoti per il CYP2C9*3 devono ricevere metà della dose di mantenimento, mentre l’omozigosi è una controindicazione al trattamento con siponimod [32].
Rispetto al placebo, a 6 mesi è stata osservata una riduzione del numero di lesioni che aumentano il contrasto nella ponderazione T1 e di lesioni T2 nuove o appena ingrandite (84% per siponimod 10 mg, 80% per siponimod 2 mg e 58% per siponimod 0,5 mg) [30]. Inoltre, è stata dimostrata anche una riduzione significativa della progressione della disabilità nei pazienti affetti da SPMS [29]. In particolare, i pazienti più giovani, quelli con un EDSS più basso al basale, una durata della malattia più breve al basale e segni di attività infiammatoria acuta rispondono bene al trattamento [31].
Vale anche la pena di notare che i pazienti in terapia con siponimod hanno mostrato un beneficio nella velocità di elaborazione delle informazioni, misurata dalla SDMT. Questo ha dimostrato non solo un ritardo del deterioramento cognitivo, ma anche un miglioramento cognitivo clinicamente rilevante entro 6 mesi [33].
Anche Ozanimod è stato approvato per il trattamento della SMRR e, come siponimod, si lega selettivamente ai sottotipi S1PR1 e S1PR5, impedendo la fuoriuscita dei linfociti dagli organi linfoidi secondari [34]. Nei pazienti senza sintomi cardiaci attuali/preesistenti, non è richiesta l’osservazione della dose iniziale quando il farmaco viene aumentato (0,23 mg nei giorni 1-4, 0,46 mg nei giorni 5-7, poi 0,92 mg una volta al giorno).
I risultati dello studio mostrano un tasso di ricaduta annualizzato più basso, un numero inferiore di lesioni al gadolinio annualizzate, lesioni T2 nuove o in aumento e un tasso inferiore di atrofia cerebrale con un profilo di sicurezza favorevole rispetto all’interferone beta-1a [35]. Tuttavia, la progressione della disabilità era paragonabile tra i gruppi. Analogamente a siponimod, sono stati riscontrati effetti positivi sulla velocità cognitiva (SDMT) anche con ozanimod [36].
Ponesimod è stato approvato per gli adulti con sclerosi multipla recidivante-remittente attiva dal novembre 2020, diventando così l’ultima novità di questa classe di farmaci. Il modulatore S1PR con elevata affinità per S1PR1 ha una breve emivita di 32 ore [37]. Dopo l’interruzione del trattamento, la conta dei linfociti si normalizza entro sette giorni. Il monitoraggio iniziale della dose è necessario nei pazienti con malattie/condizioni cardiache attuali o preesistenti, in quanto l’inizio del trattamento con Ponvory comporta una riduzione transitoria della frequenza cardiaca e anomalie della conduzione atrioventricolare (AV).
L’efficacia di ponesimod è già stata stabilita in uno studio di fase II di ricerca della dose e successivamente confermata in un RCT di fase III più ampio. Rispetto al placebo, il trattamento con ponesimod (10 mg, 20 mg e 40 mg) ha raggiunto l’endpoint primario di ridurre il numero cumulativo di nuove lesioni che potenziano il gadolinio in uno studio di fase II su pazienti affetti da SMRR [38]. La bradicardia transitoria e il blocco atrioventricolare si sono verificati nel 2% dei partecipanti ciascuno. La dispnea o gli effetti collaterali respiratori sono stati registrati in modo dose-dipendente [38]. Ponesimod si è dimostrato anche superiore a un comparatore attivo (teriflunomide) in termini di affaticamento [39].
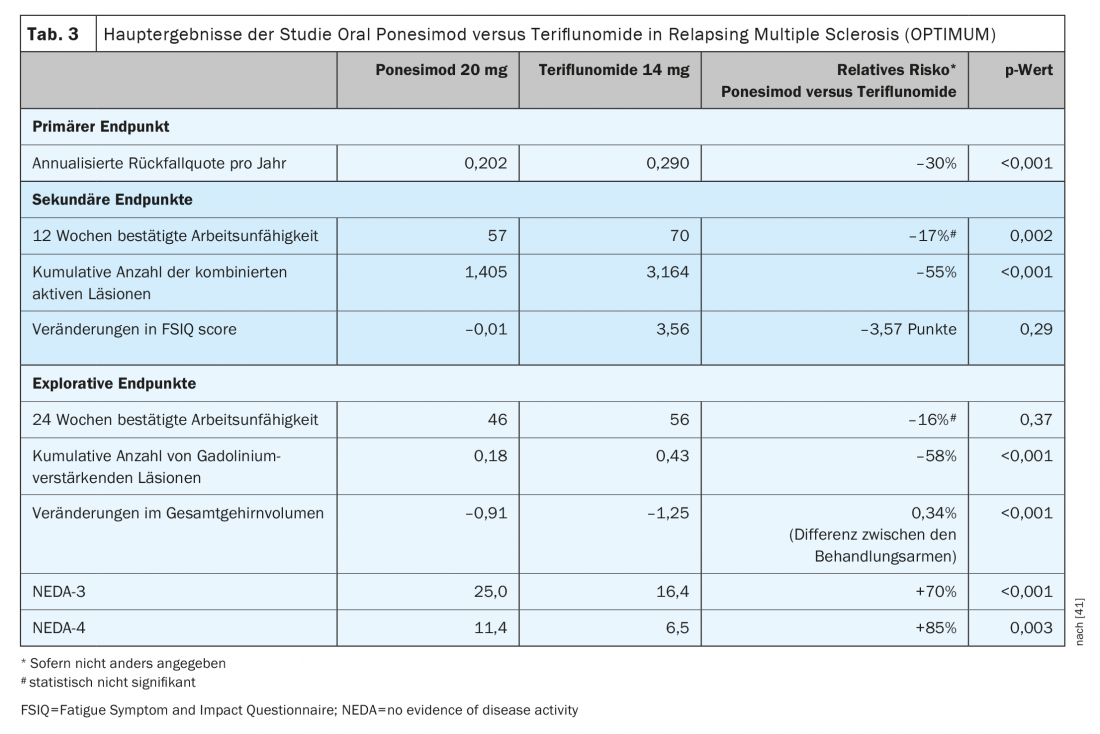
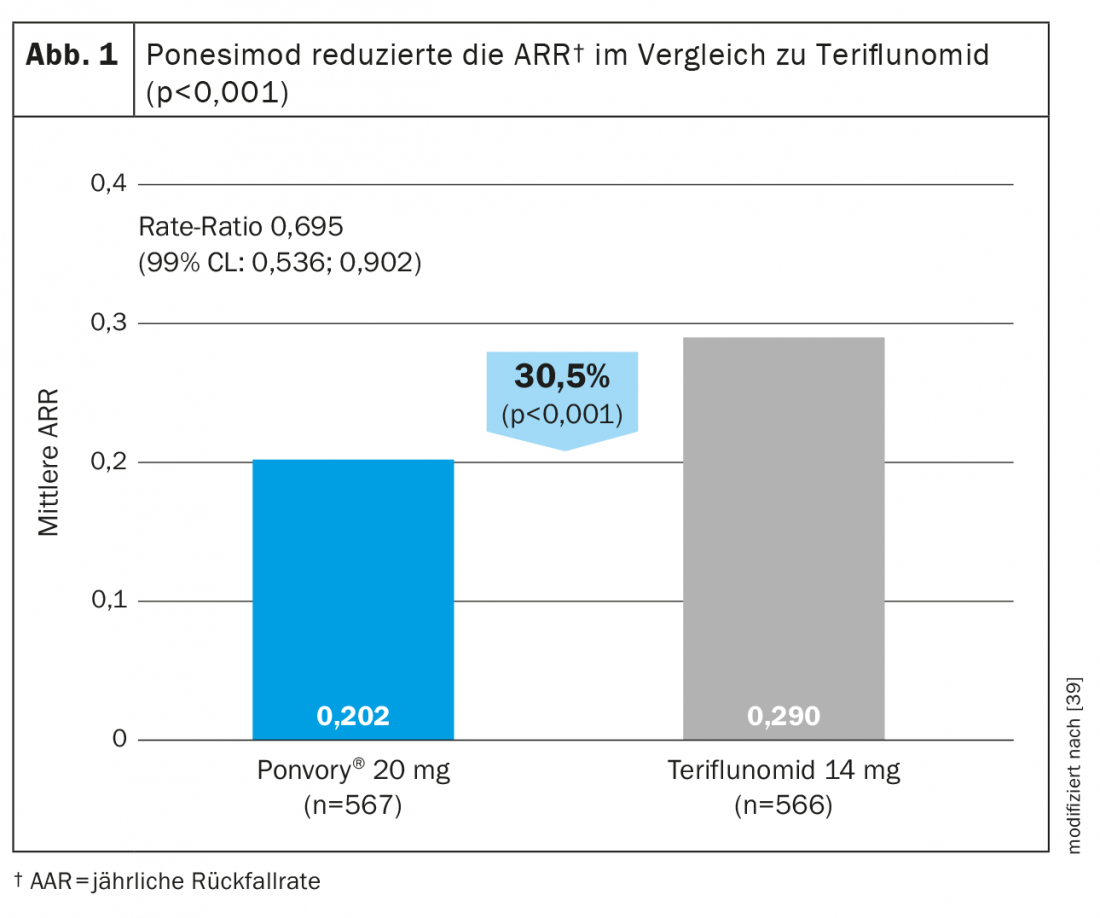
Ponesimod è il primo DTM orale approvato ad essere valutato rispetto ad un altro agente orale consolidato per il trattamento della sclerosi multipla recidivante-remittente. Ponesimod 20 mg è stato confrontato con teriflunomide in uno studio di fase III (OPTIMUM) in pazienti con sclerosi multipla recidivante-remittente (Tabella 3) [39]. L’endpoint primario era il tasso di ricaduta annullato nel corso del periodo di studio. Gli endpoint secondari includevano il numero di nuove lesioni T1 che aumentano il gadolinio e il numero di lesioni T2 iperintense nuove o in aumento dal basale alla settimana 108 e il tempo alla progressione della disabilità confermata a 3 mesi. Gli endpoint esplorativi presi in considerazione sono stati i pazienti senza ricadute e la variazione percentuale media del volume cerebrale dal basale alla settimana 108.
Lo studio ha dimostrato che ponesimod ha ottenuto una riduzione dell’ARR superiore del 30,5% rispetto a teriflunomide (Fig. 1) . Oltre all’attività di risonanza magnetica e alla perdita di volume cerebrale, anche la fatica è stata ridotta meglio con ponesimod rispetto al comparatore attivo teriflunomide [38]. In termini di riduzione della progressione della disabilità confermata, l’efficacia era paragonabile in entrambi i gruppi di test [39].
Anche la proporzione di pazienti con almeno un evento avverso emergente dal trattamento (TEAE) o un evento avverso grave (SAE) è stata paragonabile in entrambi i gruppi di trattamento. La maggior parte dei TEAE sono stati da lievi a moderati e non hanno portato all’interruzione del trattamento. Gli effetti collaterali più comuni nel gruppo ponesimod sono stati: L’effetto benefico di ponesimod 20 mg sulla malattia della SM è stato mantenuto per circa otto anni senza che venissero rilevati nuovi effetti collaterali [40].
Nel complesso, gli effetti terapeutici di ponesimod sembrano essere coerenti con quelli di altri modulatori del recettore S1P, senza problemi di sicurezza inaspettati, ma questo deve essere interpretato con cautela in assenza di studi comparativi testa a testa.
A differenza di fingolimod, ma simile a ozanimod e siponimod, il regime di up-titration di ponesimod minimizza l’effetto sulla frequenza cardiaca e sul ritmo AES alla prima dose, quindi non è necessario un monitoraggio cardiovascolare prolungato all’inizio del trattamento. Inoltre, la caratteristica di un’emivita più breve di ponesimod rispetto a fingolimod può essere un vantaggio in caso di vaccinazione o gravidanza e nel trattamento degli effetti collaterali [41].
Conclusione
La classe dei modulatori S1PR offre una nuova opzione efficace ed entusiasmante per la gestione del trattamento della SM. Anche se i preparati attualmente approvati si basano sullo stesso meccanismo d’azione, si differenziano per la gestione e il profilo. Per prendere una decisione terapeutica personalizzata, si devono quindi prendere in considerazione informazioni come la farmacodinamica, la farmacocinetica, le misure necessarie prima e all’inizio della terapia, nonché durante la terapia e le possibili interazioni farmacologiche.
Messaggi da portare a casa
- La modulazione dei recettori S1P è un bersaglio terapeutico importante e interessante a causa della loro diversità funzionale.
- Attualmente sono disponibili tre modulatori del recettore S1P per i pazienti affetti da SMRR e uno per i pazienti affetti da SPMS.
- Fingolimod agisce su S1P1, S1P2, S1P3 e S1P5.
- Siponimod, ozanimod e ponesimod agiscono specificamente su S1PR1 e S1PR5.
- Nei pazienti con SM senza sintomi cardiaci attuali/preesistenti, non è richiesta alcuna osservazione con la somministrazione iniziale di ozanimod e ponesimod.
- L’emivita più breve di siponimod, ozanimod e ponesimod aiuta i linfociti a recuperare più rapidamente dopo l’interruzione del trattamento.
- I modulatori del recettore S1P menzionati sopra non hanno dimostrato di influenzare negativamente la cognizione e la fatica.
Letteratura:
- Aktas O, et al: Diagnosi di sclerosi multipla: revisione dei criteri McDonald 2017. Neurologist 2018; 89: 1344-1354.
- www.nationalmssociety.org/What-is-MS/Types-of-MS/Relapsing-remitting-MS (ultimo accesso 01.09.2022)
- Thompson AJ, Banwell BL, Barkhof F, et al: Diagnosi di sclerosi multipla: revisioni 2017 dei criteri McDonald. Lancet Neurol 2018;1 7(2): 162-173.
- Lassmann H: Lesioni corticali nella sclerosi multipla: infiammazione contro neurodegenerazione. Cervello. 2012; 135(Pt 10):2904-2905.
- Tobin WO, Kalinowska-Lyszczarz A, Weigand SD, et al: Correlazione clinica dei sottotipi immunopatologici della sclerosi multipla. Neurologia. 2021; 97(19): e1906-e1913.
- Baecher-Allan C, et al: Sclerosi multipla: meccanismi e immunoterapia. Neuron 2018; 97(4): 742-768.
- Penner IK: Valutazione della cognizione e della fatica nella sclerosi multipla: pratica quotidiana e direzioni future. Acta Neurologica Scandinavica 2016; 134 (Suppl. 200): 19-23.
- Kobelt, et al: Nuovi approfondimenti sull’onere e sui costi della sclerosi multipla in Europa. Mult Scler. 2017; 23(8): 1123-1136.
- Penner IK, Warnke C: Disturbi cognitivi nella sclerosi multipla. DGNeurologia 2021; 3: 184-186.
- Pitteri et al: Il deterioramento cognitivo predice la progressione della disabilità e l’assottigliamento corticale nella SM: uno studio di 8 anni. Mult Scler. 2017; 23(6):848-854.
- Gilenya® SmPC, a partire da: novembre 2020. www.swissmedicinfo.ch
- Zeposia® SmPC, al: luglio 2020. www.swissmedicinfo.ch
- Informazioni sul prodotto Ponvory®, al novembre 2021. www.swissmedicinfo.ch
- Informazioni sul prodotto Mayzent®, a partire da: ottobre 2020. www.swissmedicinfo.ch
- Rosen H, Germana Sanna M, Gonzalez-Cabrera PJ, Roberts E: L’organizzazione del sistema di segnalazione della sfingosina 1-fosfato. Curr Top Microbiol Immunol 2014; 378: 1-21.
- Kunkel GT, Maceyka M, Milstien S, Spiegel S: Prendere di mira l’asse sfingosina-1-fosfato nel cancro, nell’infiammazione e oltre. Nat Rev Drug Discov 2013; 12(9): 688-702.
- Cartier A, Hla T: Sfingosina 1-fosfato: segnalazione lipidica nella patologia e nella terapia. Scienza. 2019;366(6463):eaar5551.
- Maceyka M, Harikumar KB, Milstien S, Spiegel S. La segnalazione della sfingosina-1-fosfato e il suo ruolo nelle malattie. Trends Cell Biol 2012; 22(1): 50-60.
- Subei AM, Cohen JA: Modulatori del recettore della sfingosina 1-fosfato nella sclerosi multipla. Farmaci CNS 2015; 29(7): 565-575.
- Chaudhry BZ, Cohen JA, Conway DS: Modulatori del recettore della sfingosina 1-fosfato per il trattamento della sclerosi multipla. Neurother J Am Soc Exp Neurother 2017; 14(4): 859-873.
- Pérez-Jeldres T, Alvarez-Lobos M, Rivera-Nieves J: Prendere di mira la segnalazione della sfingosina-1-fosfato nelle malattie immuno-mediate: oltre la sclerosi multipla. Farmaci. 2021; 81(9):985-1002.
- Zecca C, et al: Fingolimod a metà dose per il trattamento della sclerosi multipla recidivante-remittente: studio osservazionale. Mult Scler 201; 24: 167-174.
- Yamout BI, Zeineddine MM, Sawaya RA, Khoury SJ: Sicurezza ed efficacia del trattamento a dosaggio ridotto di fingolimod. J Neuroimmunol 2015; 285: 13-15.
- Kappos L, et al: Uno studio controllato con placebo di fingolimod orale nella sclerosi multipla recidivante. N Engl J Med 2010; 362: 387-401.
- Calabresi PA, et al: Sicurezza ed efficacia di fingolimod nei pazienti con sclerosi multipla recidivante-remittente (FREEDOMS II): uno studio di fase 3 in doppio cieco, randomizzato, controllato con placebo. Lancet Neurol 2014; 13: 545-556.
- Cohen JA, et al: Fingolimod orale o interferone intramuscolare per la sclerosi multipla recidivante. N Engl J Med 2010; 362: 402-415.
- Langdon DW et al: Caratteristiche di base ed effetti di fingolimod sulle prestazioni cognitive nei pazienti con sclerosi multipla recidivante-remittente. Eur J Neurol 2021; 28(12):4135-4145.
- Fischer-Barnicol B, et al.: Combinazione di teriflunomide e interferone come terapia di follow-up dopo la PML associata a fingolimod. Neurol Neuroimmunol Neuroinflamm 2021; 8. doi: 10.1212/NXI.0000000000000927
- Kappos L, et al: Siponimod versus placebo nella sclerosi multipla secondaria progressiva (EXPAND): uno studio di fase 3, randomizzato, in doppio cieco. Lancet 2018; 391: 1263-1273.
- Selmaj K, et al: Siponimod per i pazienti con sclerosi multipla recidivante-remittente (BOLD): uno studio di fase 2 randomizzato, adattativo, con variazione della dose. Lancet Neurol 2013; 12: 756-767.
- Gajofatto A: Riflettori puntati su siponimod e sul suo potenziale nel trattamento della sclerosi multipla secondaria progressiva: le prove ad oggi. Drug Des Devel Ther 2017; 11: 3153-3157.
- Huth F, Gardin A, Umehara K, He H: Previsione dell’impatto dei genotipi del citocromo P450 2C9 sul potenziale di interazione farmaco-farmaco di Siponimod con la modellazione farmacocinetica basata sulla fisiologia: un approccio completo per le raccomandazioni sull’etichetta del farmaco. Clin Pharmacol Ther 2019; 106:1113-1124.
- Gold, et al: Siponimod vs placebo nella sclerosi multipla secondaria attiva progressiva: un’analisi post hoc dello studio EXPAND di fase 3. J Neurol 2022; 269(9): 5093-5104.
- Lamb YN: Ozanimod: prima approvazione. Farmaci 2020; 80:841-848.
- Comi G, et al: Sicurezza ed efficacia dell’ozanimod rispetto all’interferone beta-1a nella sclerosi multipla recidivante (SUNBEAM): uno studio multicentrico, randomizzato, di fase 3 della durata minima di 12 mesi. Lancet Neurol 2019; 18: 1009-1020.
- De Luca J et al: Effetto di Ozanimod sulle prestazioni del test delle modalità delle cifre simboliche nella SM recidivante. Mult Scler Relat Disord. 2021; 48:102673.
- D’Ambrosio D, Freedman MS, Prinz J: Ponesimod, un modulatore selettivo del recettore S1P1: un potenziale trattamento per la sclerosi multipla e altre malattie immunomediate. Ther Adv Chronic Dis 2016; 7: 18-33.
- Olsson T, et al: Ponesimod orale nella sclerosi multipla recidivante-remittente: uno studio randomizzato di fase II. J Neurol Neurosurg Psychiatry 2014; 85: 1198-1208.
- Kappos L, Fox RJ, Burcklen M, et al: Ponesimod rispetto a Teriflunomide nei pazienti con sclerosi multipla recidivante nello studio OPTIMUM di fase 3 con comparatore attivo: uno studio clinico randomizzato. JAMA Neurol 2021; 78(5): 558-567.
- Freedman MS, Pozzilli C, Havrdova EK, et al: Trattamento a lungo termine con Ponesimod nella sclerosi multipla recidivante-remittente: risultati di studi randomizzati di fase 2b di base e di estensione. Neurology 2022 Jun 6;10.1212/WNL.0000000000200606.
- Ruggieri S, Quartuccio ME, Prosperini L: Ponesimod nel trattamento delle forme recidivanti di sclerosi multipla: un aggiornamento sui dati clinici emergenti. Degener Neurol Neuromuscul Dis 2022; 12: 61-73.
InFo NEUROLOGIA & PSICHIATRIA 2022; 20(5): 12-18.