La modulation des récepteurs S1P est une cible thérapeutique importante et intéressante dans la gestion du traitement de la sclérose en plaques en raison de leur diversité fonctionnelle. Actuellement, trois modulateurs du récepteur S1P sont disponibles pour les patients atteints de RRMS et un pour les patients atteints de SPMS. Aucun des modulateurs du récepteur S1P n’a montré d’effet négatif sur la cognition et la fatigue.
La sclérose en plaques (SEP) est une maladie neurologique courante qui entraîne une démyélinisation et des lésions axonales dues à une inflammation chronique à médiation immunitaire du système nerveux central (SNC) [1]. Chez une grande partie des personnes atteintes (environ 85%), la maladie évolue d’abord sous forme de poussées-rémissions (RRMS) qui, au fur et à mesure de l’évolution de la maladie, se transforme en une phase secondairement chronique et progressive [2]. La SEPR est définie par des poussées avec des symptômes cliniques nouveaux ou croissants. Elles sont suivies de périodes de rémission partielle ou complète. Pendant les phases de rémission, il n’y a pas de progression de la maladie [1,2].
Le diagnostic de SEP nécessite la preuve objective d’un événement inflammatoire dans le SNC et la preuve supplémentaire d’une propagation du processus pathologique dans l’espace et le temps (dissémination dans l’espace et le temps). Les principaux tests paracliniques utilisés pour confirmer le diagnostic sont l’imagerie par résonance magnétique (IRM) et l’analyse du LCR [3].
Il existe aujourd’hui un consensus sur le fait que les poussées seules ne sont pas significatives de l’évolution de la maladie et de son développement. Ainsi, le nombre de poussées ne donne que peu d’informations sur l’étendue réelle des dommages structurels et fonctionnels. De plus, la perte de volume cérébral, qui peut survenir très tôt dans l’évolution de la maladie, n’est pas nécessairement associée à une activité en poussée. D’un point de vue pathologique, les lésions actives des tissus dans la SEP sont associées à une inflammation. En outre, d’autres mécanismes, tels que le stress oxydatif entraînant des dommages mitochondriaux, sont probablement impliqués dans l’induction de la démyélinisation et de la neurodégénérescence, tant dans la phase rémittente que dans la phase progressive de la SEP [4]. Comme ni la phase RR ni la phase progressive de la SEP ne présentent de caractéristiques pathologiques ou mécanistiques distinctes, les différences quantitatives plutôt que qualitatives entre ces phases semblent être responsables du phénotype prédominant qui en résulte [4,5]. Le traitement moderne de la SEP vise aujourd’hui un diagnostic précoce ainsi qu’une utilisation précoce de médicaments modifiant l’évolution de la maladie, afin d’influencer le plus tôt possible la progression du handicap de manière favorable [1,2,6].
Fatigue et problèmes cognitifs
Mais la progression physique du handicap n’est pas le seul défi auquel sont confrontés les patients concernés et les médecins traitants. Dans la gestion quotidienne, il s’agit surtout de symptômes tels que la fatigue et les problèmes cognitifs. On estime que 75 à 95 % des patients atteints de SEP souffrent de fatigue et que 40 à 50 % d’entre eux ont des performances cognitives réduites [7]. Ces deux symptômes ont de graves conséquences sur la participation sociale, la capacité professionnelle et la qualité de vie en général [7,8]. Il est important de prendre en compte les symptômes mentionnés lors de l’évaluation d’une progression et de les enregistrer régulièrement, une fois par an, à l’aide d’instruments sensibles, indépendamment de l’EDSS [9]. Cela permet d’évaluer l’individu en question dans le cadre d’une évolution longitudinale. En ce qui concerne la cognition, il existe des preuves que les patients qui présentent des anomalies cognitives dès le diagnostic ont un risque accru de développer une pathologie agressive avec une progression très marquée du handicap [10]. Cela permettrait de définir d’emblée un algorithme thérapeutique mieux adapté à chaque cas.
La fatigue étant le symptôme responsable, avec les troubles cognitifs, de la mise à la retraite anticipée et de l’invalidité, le choix de l’immunothérapie doit se faire en évitant les médicaments susceptibles d’aggraver les symptômes.
Thérapies de modification de l’évolution
Les options de traitement modifiant la maladie sont connues sous le nom de disease modifying therapies (DMTs) et peuvent être administrées sous forme de comprimés, de capsules, d’injections ou de perfusions. L’objectif est de réduire à la fois le taux annuel de poussées et la progression. Il existe des préparations avec différents principes d’action. Dans ce travail, nous nous concentrons sur les modulateurs du récepteur S1P. Quatre préparations de cette classe de substances sont actuellement autorisées en Suisse – le fingolimod, l’ozanimod et le ponesimod pour le RRMS, le siponimod étant le seul modulateur du récepteur S1P pour les patients SPMS [11–14].
Récepteurs de la sphingosine-1-phosphate
Les sphingosines sont des composants structurels de la membrane cellulaire qui donnent naissance à de nombreux lipides bioactifs, tels que le S1P. Il s’agit d’un métabolite lipidique bioactif multifonctionnel qui agit comme une molécule de signalisation soluble et circule dans le sang et le système lymphatique [15]. La S1P est impliquée dans un grand nombre de processus physiologiques et physiopathologiques grâce à son interaction avec les récepteurs S1P, qui sont des récepteurs de surface cellulaire couplés à des protéines G et dotés d’une grande affinité, présents partout dans l’organisme [16].
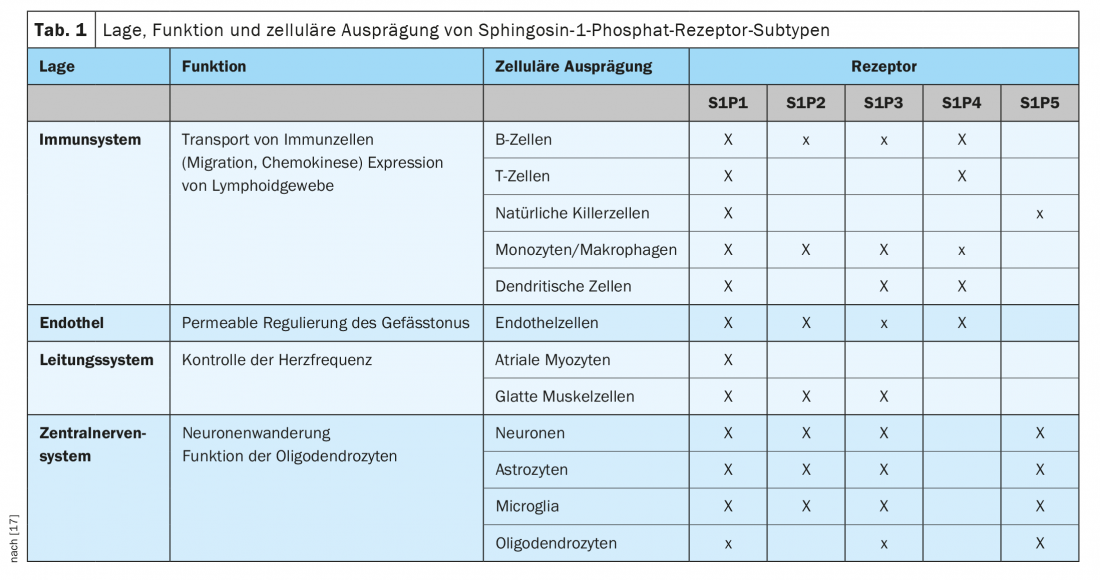
La S1P a une affinité de liaison pour cinq sous-types de récepteurs S1P différents, par lesquels les signaux cellulaires sont transmis. Les récepteurs S1P1, S1P2 et S1P3 sont exprimés de manière ubiquitaire, chaque sous-type ayant une spécificité cellulaire différente. En revanche, l’expression des récepteurs S1P4 et S1P5 est moins répandue. Les récepteurs S1P4 sont limités aux tissus lymphatiques et hématopoïétiques et les récepteurs S1P5 sont présents dans la rate et dans la substance blanche du SNC, principalement dans les oligodendrocytes (tableau 1) [17].
En conséquence, les récepteurs S1P sont impliqués dans de nombreuses fonctions biologiques, notamment la prolifération cellulaire, l’angiogenèse, l’organisation du cytosquelette, la chimiotaxie des cellules endothéliales, le transport des cellules immunitaires et la mitogenèse. Ils jouent également un rôle dans le développement du cerveau et du cœur, la prolifération des cellules de la peau, la perméabilité vasculaire et la régulation du tonus vasculaire et bronchique [18]. Cette diversité fonctionnelle fait de la modulation des récepteurs S1P une cible thérapeutique intéressante et importante.
Le développement de modulateurs S1PR
Les modulateurs du récepteur S1P peuvent agir à la fois comme des antagonistes fonctionnels et comme des agonistes traditionnels, avec une spécificité différente, selon le ou les sous-types de récepteurs S1P ciblés [19]. Il s’agit de petites molécules destinées à être administrées par voie orale. Le principal mécanisme immunologique des modulateurs du récepteur S1P repose sur la régulation de la migration des lymphocytes par interaction avec le récepteur S1P1. Ce mécanisme repose sur un gradient de concentration de S1P, qui est physiologiquement plus élevé dans le sang que dans les tissus lymphatiques. Lorsque le ligand se lie au récepteur sur des cellules exprimant le récepteur 7 de la chimiokine C-C-Motiv (CCR7), le récepteur S1P1 est internalisé et dégradé, ce qui entraîne une perte de réactivité au gradient S1P. Par conséquent, les lymphocytes sont retenus dans le thymus et les organes lymphatiques secondaires, ce qui entraîne une diminution du nombre de lymphocytes dans le sang périphérique et limite la migration des cellules inflammatoires [20].
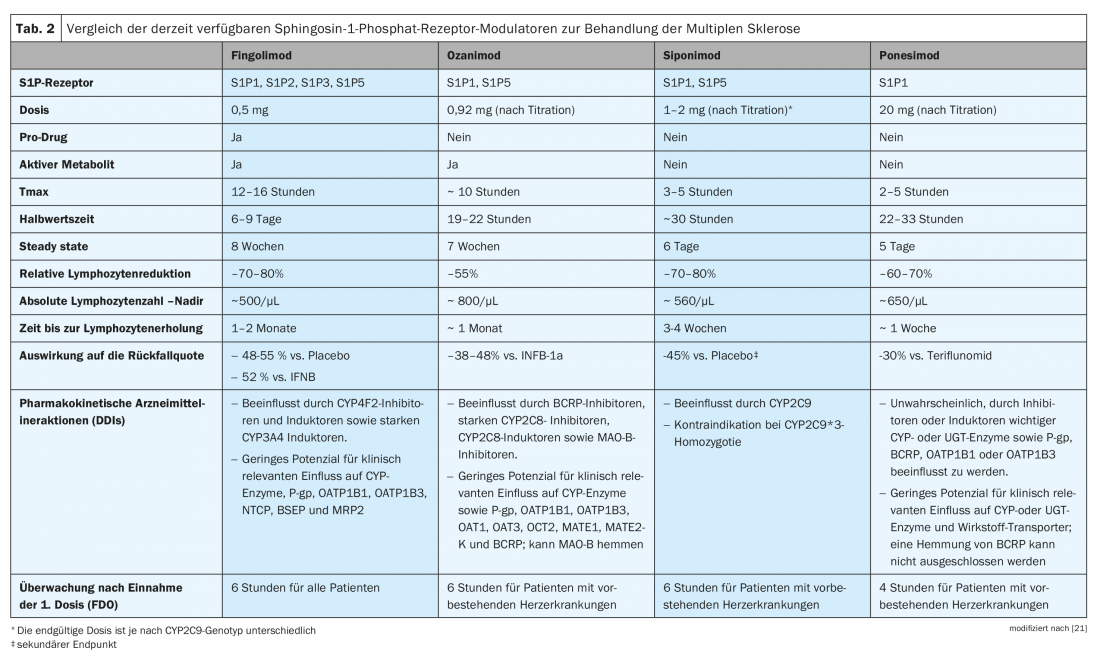
Certains des modulateurs du récepteur S1P agissent comme des promédicaments (fingolimod) qui nécessitent une phosphorylation ou d’autres étapes métaboliques pour être convertis en composé pharmacologiquement actif, tandis que d’autres sont des médicaments directement actifs (siponimod, ozanimod, ponesimod). C’est pourquoi, bien que leur mécanisme d’action soit comparable, les modulateurs S1PR présentent des propriétés pharmacocinétiques différentes (tableau 2) [21]. Pour prendre une décision thérapeutique sur mesure, il est donc indispensable de considérer les préparations de la classe de substances actives de manière différenciée.
Aperçu des modulateurs S1PR
Le fingolimod (FTY) a été le premier modulateur S1PR à être approuvé pour le traitement du SMRR. La prodrogue chlorhydrate de fingolimod est phosphorylée de manière stéréosélective, principalement dans le foie, par la sphingosine kinase-2 (SphK-2) en métabolite actif, le (S)-fingolimodphosphate. Celui-ci est un analogue de S1P. La modulation des récepteurs entraîne une dérégulation des récepteurs à la surface des cellules et réduit la sensibilité au ligand endogène. Il bloque ainsi la sortie des lymphocytes des ganglions lymphatiques vers la circulation sanguine périphérique et réduit le nombre de lymphocytes dans le sang à 20-30% de la valeur initiale. Étant donné que l’activation de S1PR3 peut entraîner un effet agoniste initial sur les cellules cardiaques, ce qui peut provoquer des blocs auriculo-ventriculaires (AV), une évaluation complète doit être effectuée avant le début du traitement. Le patient doit être examiné pour détecter une bradycardie, un QT long, un bloc AV et d’autres facteurs de risque d’arythmie et doit être surveillé pendant six heures après la première administration. -En outre, les maladies préexistantes doivent être exclues. Les enzymes hépatiques, la formule sanguine et la pression artérielle doivent être surveillées en permanence. Si le taux de lymphocytes tombe en dessous de 200/ml, une pause dans le traitement est indiquée. Des taux élevés d’enzymes hépatiques pourraient être contrés par une réduction de la dose de fingolimod tous les deux jours. Toutefois, cela peut entraîner une efficacité réduite. En particulier chez les patients plus jeunes et chez ceux qui sont passés du natalizumab, il y a un risque d’effets de rebond avec un risque accru de poussées et d’activité radiologique [22,23].
Les données des études comparant le fingolimod au placebo ou à l’interféron bêta 1a ont montré une réduction des poussées d’environ 50% et une réduction de 74% du développement de nouvelles lésions cérébrales ou de lésions d’agrandissement sur [24–26]. De plus, une influence favorable sur les performances cognitives, mesurées par le PASAT-3, a été démontrée sous fingolimod par rapport au placebo [27]. Cependant, il a également été détecté que le modulateur S1PR augmente le risque d’infection par le virus de l’herpès et le cryptocoque, le risque augmentant avec la durée du traitement et l’âge [28]. D’autres complications potentiellement graves peuvent inclure des lésions hépatiques avec augmentation des transaminases, des cancers de la peau comme le carcinome basocellulaire et des complications oculaires (par exemple œdème maculaire, hémorragie rétinienne et occlusion veineuse rétinienne).
Le siponimod a été approuvé en Suisse en 2020 pour le traitement du syndrome cliniquement isolé, de la sclérose en plaques rémittente et de la sclérose en plaques active secondairement progressive [29,30]. Cet inhibiteur de S1PR se lie sélectivement aux sous-types S1PR1 et S1PR5. La molécule empêche ainsi la migration des lymphocytes hors des ganglions lymphatiques et réduit la recirculation des lymphocytes T vers le système nerveux central (SNC) afin de limiter l’inflammation dans le SNC. L’hypothèse sous-jacente suggère moins d’effets hors cible qu’avec le fingolimod [30]. Comme pour le fingolimod, il convient de vérifier les antécédents médicaux tels que les maladies oculaires, les troubles du rythme cardiaque et les maladies graves du foie, et de mettre à jour le statut vaccinal (par exemple, varicelle). Les autres complications possibles liées à l’immunosuppression induite sont un risque accru d’infections et de cancer de la peau. Les effets secondaires possibles au début du traitement (par ex. bradycardie, bloc AV) peuvent être réduits à l’aide d’un schéma de titration. Cela prévoit l’administration de 0,25 mg/jour les jours 1 et 2, suivie de 0,5 mg le jour 3, 0,75 mg le jour 4, 1,25 mg le jour 5, suivie d’une dose d’entretien de 2 mg par jour. Il convient de noter que le siponimod est principalement métabolisé par le CYP2C9. Une variante moins fréquente de cette enzyme (CYP2C9*3) a une activité métabolique réduite. Pour cette raison, les hétérozygotes pour le CYP2C9*3 doivent recevoir la moitié de la dose d’entretien, tandis que l’homozygotie constitue une contre-indication au traitement par siponimod [32].
Par rapport au placebo, une réduction du nombre de lésions prenant le contraste en pondération T1 et de lésions T2 nouvelles ou nouvellement agrandies a été observée à 6 mois (84% pour le siponimod 10 mg, 80% pour le siponimod 2 mg et 58% pour le siponimod 0,5 mg) [30]. En outre, une réduction significative de la progression du handicap a également été démontrée chez les patients SPMS [29]. Ce sont surtout les jeunes malades, ceux qui ont un EDSS plus faible au début de l’étude, une durée de maladie plus courte au début de l’étude et des signes d’activité inflammatoire aiguë qui répondent bien au traitement [31].
Il convient également de noter que les patients sous traitement par siponimod ont montré un bénéfice sur la vitesse de traitement de l’information mesurée par le SDMT. Dans ce cas, en 6 mois, on a constaté non seulement un retard du déclin cognitif mais aussi une amélioration cognitive cliniquement significative [33].
L‘ozanimod a également été approuvé pour le traitement du SMRR et, comme le siponimod, se lie sélectivement aux sous-types S1PR1 et S1PR5, empêchant ainsi la sortie des lymphocytes des organes lymphatiques secondaires [34]. Chez les patients sans troubles cardiaques actuels/précédents, il n’est pas nécessaire de surveiller la dose initiale lorsque le médicament est fortement titré (0,23 mg les jours 1-4, 0,46 mg les jours 5-7, puis 0,92 mg une fois par jour).
Les résultats des études montrent, par rapport à l’interféron bêta-1a, un taux annualisé de poussées plus faible, un nombre annualisé de lésions de gadolinium plus faible, des lésions T2 nouvelles ou en augmentation et un taux d’atrophie cérébrale plus faible, le tout avec un profil de sécurité favorable [35]. Cependant, la progression du handicap était comparable entre les groupes. Comme pour le siponimod, des effets positifs sur la vitesse cognitive (SDMT) ont été observés sous ozanimod [36].
Le ponesimod a été approuvé en novembre 2020 pour les adultes atteints de sclérose en plaques active récurrente, ce qui en fait la dernière entrée dans cette classe de médicaments. Le modulateur S1PR à haute affinité pour S1PR1 a une demi-vie courte de 32 heures [37]. Après l’arrêt du traitement, le nombre de lymphocytes se normalise en sept jours. Chez les patients présentant une maladie/un trouble cardiaque actuel(le) ou préexistant(e), il est nécessaire de surveiller la dose initiale, car l’instauration d’un traitement par Ponvory entraîne une diminution temporaire de la fréquence cardiaque et des troubles de la conduction auriculo-ventriculaire (AV).
L’efficacité du ponesimod a déjà été constatée lors d’une étude de phase II à dose fixe et a été confirmée ultérieurement lors d’un ECR de phase III plus important. Comparé au placebo, le traitement par le ponesimod (10 mg, 20 mg et 40 mg) a atteint le critère d’évaluation principal de réduction du nombre cumulé de nouvelles lésions renforçant le gadolinium dans une étude de phase II chez des patients atteints de SMRR [38]. Une bradycardie et un bloc auriculo-ventriculaire transitoires ont été observés chez 2% des participants. Une dyspnée ou des effets secondaires respiratoires ont été enregistrés en fonction de la dose [38]. Le ponesimod s’est également montré supérieur à un comparateur actif (tériflunomide) en termes de fatigue [39].
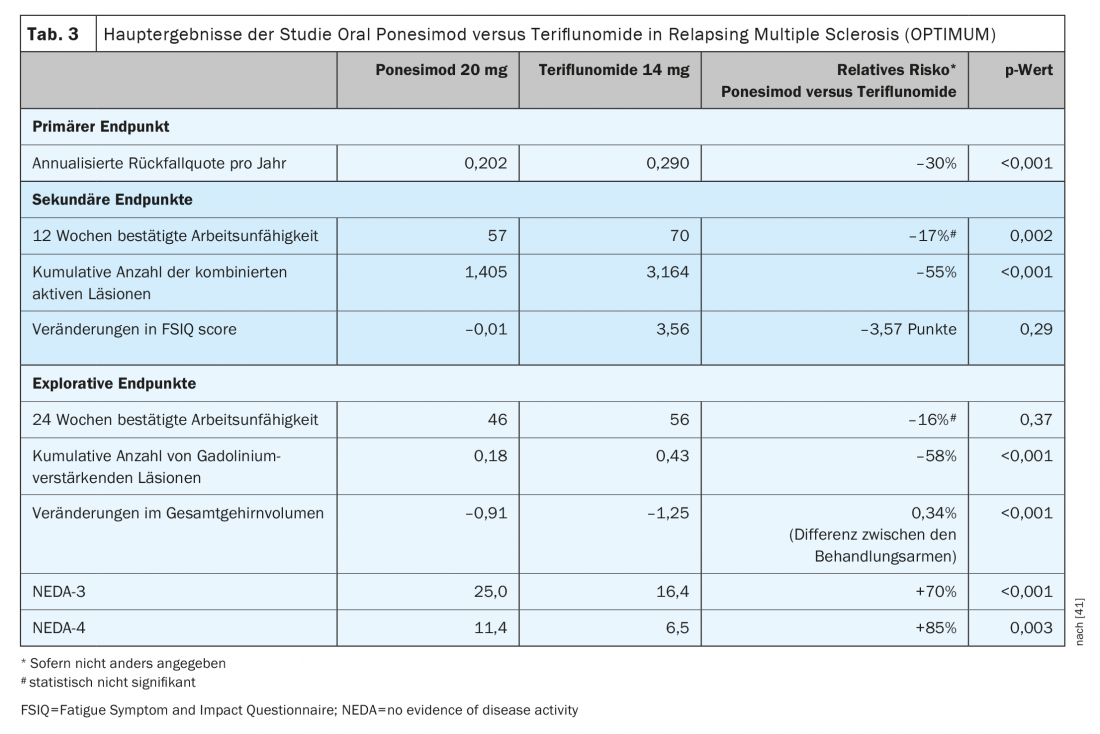
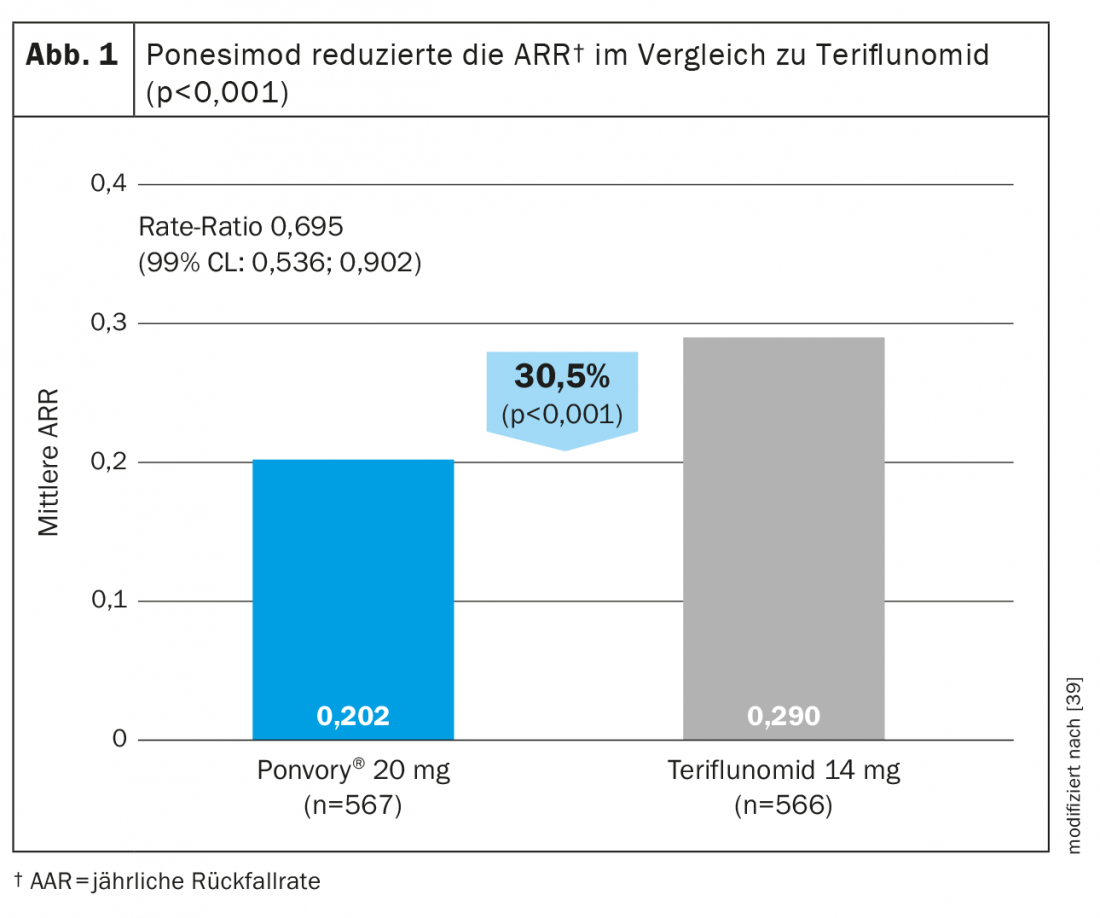
Le ponesimod est le premier DTM oral autorisé à être étudié contre un autre agent oral établi dans le traitement de la sclérose en plaques récurrente. Le ponesimod 20 mg a été comparé au tériflunomide dans une étude de phase III (OPTIMUM) chez des patients atteints de sclérose en plaques récidivante (tableau 3) [39]. Le critère d’évaluation principal était le taux de poussées annulées au cours de la période d’étude. Les critères d’évaluation secondaires comprenaient le nombre de nouvelles lésions T1 enrichies en gadolinium et le nombre de nouvelles lésions T2 hyperintenses ou de lésions T2 hyperintenses qui s’agrandissaient à partir de la valeur initiale jusqu’à la semaine 108, ainsi que le temps nécessaire pour obtenir une progression confirmée du handicap à 3 mois. Les critères d’évaluation exploratoires étaient les patients sans rechute et le pourcentage moyen de changement de volume cérébral entre la valeur initiale et la semaine 108.
L’étude a montré que le ponesimod a permis une réduction de 30,5% de l’ARR par rapport au tériflunomide (Fig. 1). En plus de l’activité de l’imagerie par résonance magnétique et de la perte de volume cérébral, le ponesimod a également permis une meilleure réduction de la fatigue par rapport au comparateur actif, le tériflunomide [38]. En ce qui concerne la réduction de la progression de l’invalidité confirmée, l’efficacité était comparable dans les deux groupes de test [39].
La proportion de patients présentant au moins un effet indésirable lié au traitement (TEAE) ou un effet indésirable grave (SAE) était également comparable dans les deux groupes de traitement. La majorité des TEAE étaient légers à modérés et n’ont pas entraîné l’arrêt du traitement. Les effets secondaires les plus fréquents dans le groupe ponesimod étaient : L’effet positif du ponesimod 20 mg sur la sclérose en plaques s’est maintenu pendant environ huit ans sans que de nouveaux effets secondaires ne soient détectés [40].
Dans l’ensemble, les effets du traitement par le ponesimod semblent correspondre à ceux d’autres modulateurs du récepteur S1P, sans problème de sécurité inattendu, mais cela doit néanmoins être interprété avec prudence en l’absence d’études comparatives tête-bêche.
Contrairement au fingolimod, mais de manière similaire à l’ozanimod et au siponimod, le schéma de titration du ponesimod minimise l’effet sur la fréquence cardiaque et l’AES du rythme lors de la première dose, de sorte qu’une surveillance cardiovasculaire prolongée n’est pas nécessaire au début du traitement. De plus, la particularité d’une demi-vie plus courte du ponesimod par rapport au fingolimod peut constituer un avantage en cas de vaccination ou de grossesse et dans la gestion des effets secondaires [41].
Conclusion
La classe des modulateurs S1PR offre une nouvelle possibilité efficace et passionnante de gestion du traitement de la SEP. Même si le mécanisme d’action des produits actuellement autorisés est le même, ils diffèrent par leur mode d’utilisation et leur profil. Pour prendre une décision thérapeutique sur mesure, il convient donc de tenir compte d’informations telles que la pharmacodynamie, la pharmacocinétique, les mesures nécessaires avant et au moment de l’initiation du traitement ainsi que pendant le traitement et les interactions médicamenteuses possibles.
Messages Take-Home
- La modulation des récepteurs S1P est une cible thérapeutique importante et intéressante en raison de leur diversité fonctionnelle.
- Actuellement, trois modulateurs du récepteur S1P sont disponibles pour les patients atteints de RRMS et un pour les patients atteints de SPMS.
- Le fingolimod agit sur S1P1, S1P2, S1P3 et S1P5.
- Le siponimod, l’ozanimod et le ponesimod agissent de manière ciblée sur S1PR1 et S1PR5.
- Chez les patients atteints de SEP sans troubles cardiaques actuels/précédents, aucune observation n’est nécessaire avec la première administration d’ozanimod et de ponesimod.
- La demi-vie plus courte du siponimod, de l’ozanimod et du ponesimod contribue à une récupération plus rapide des lymphocytes après l’arrêt du traitement.
- Les modulateurs du récepteur S1P mentionnés n’ont pas montré d’influence négative sur la cognition et la fatigue.
Littérature :
- Aktas O, et al. : Diagnostic de la sclérose en plaques : révision des critères de McDonald 2017. neurologue 2018 ; 89 : 1344-1354.
- www.nationalmssociety.org/What-is-MS/Types-of-MS/Relapsing-remitting-MS (dernier accès le 01.09.2022)
- Thompson AJ, Banwell BL, Barkhof F, et al : Diagnostic de la sclérose en plaques : 2017 revisions of the McDonald criteria. Lancet Neurol 2018;1 7(2) : 162-173.
- Lassmann H : Lesions corticales dans la sclérose en plaques : inflammation versus neurodégénérescence. Brain. 2012 ; 135(Pt 10):2904-2905.
- Tobin WO, Kalinowska-Lyszczarz A, Weigand SD, et al : Clinical correlation of multiple sclerosis immunopathologic subtypes. Neurologie. 2021 ; 97(19) : e1906-e1913.
- Baecher-Allan C, et al : Sclérose en plaques : Mécanismes et immunothérapie. Neuron 2018 ; 97(4) : 742-768.
- Penner IK : Evaluation de la cognition et de la fatigue dans la sclérose en plaques : pratique quotidienne et orientations futures. Acta Neurologica Scandinavica 2016 ; 134 (Suppl. 200) : 19-23.
- Kobelt, et al. : New insights into the burden and costs of multiple sclerosis in Europe. Mult Scler. 2017 ; 23(8) : 1123-1136.
- Penner IK, Warnke C : Troubles cognitifs dans la sclérose en plaques. DGNeurologie 2021 ; 3 : 184-186.
- Pitteri et al : Cognitive impairment predicts disability progression and cortical thinning in MS : An 8-year study. Mult Scler. 2017 ; 23(6):848-854.
- Information professionnelle Gilenya®, mise à jour : novembre 2020. www.swissmedicinfo.ch
- Information professionnelle Zeposia®, mise à jour : juillet 2020. www.swissmedicinfo.ch
- Information professionnelle Ponvory®, mise à jour : novembre 2021. www.swissmedicinfo.ch
- Mayzent® Information professionnelle, mise à jour : octobre 2020. www.swissmedicinfo.ch
- Rosen H, Germana Sanna M, Gonzalez-Cabrera PJ, Roberts E : The organization of the sphingosine 1-phosphate signaling system. Curr Top Microbiol Immunol 2014 ; 378 : 1-21.
- Kunkel GT, Maceyka M, Milstien S, Spiegel S : Targeting the sphingosine-1-phosphate axis in cancer, inflammation and beyond. Nat Rev Drug Discov 2013 ; 12(9) : 688-702.
- Cartier A, Hla T : Sphingosine 1-phosphate : signalisation lipidique en pathologie et en thérapie. Science. 2019;366(6463):eaar5551.
- Maceyka M, Harikumar KB, Milstien S, Spiegel S. Sphingosine-1-phosphate signaling and its role in disease. Trends Cell Biol 2012 ; 22(1) : 50-60.
- Subei AM, Cohen JA : Modulateurs du récepteur de la sphingosine 1-phosphate dans la sclérose en plaques. CNS Drugs 2015 ; 29(7) : 565-575.
- Chaudhry BZ, Cohen JA, Conway DS : Modulateurs du récepteur de la sphingosine 1-phosphate pour le traitement de la sclérose en plaques. Neurother J Am Soc Exp Neurother 2017 ; 14(4) : 859-873.
- Pérez-Jeldres T, Alvarez-Lobos M, Rivera-Nieves J : Targeting sphingosine-1-phosphate signaling in immunity-mediated diseases : beyond multiple sclerosis. Drogues. 2021 ; 81(9):985-1002.
- Zecca C, et al : Half-dose fingolimod for treating relapsing-remitting multiple sclerosis : Observational study. Mult Scler 201; 24 : 167-174.
- Yamout BI, Zeineddine MM, Sawaya RA, Khoury SJ : Sécurité et efficacité du traitement à dose réduite de fingolimod. J Neuroimmunol 2015 ; 285 : 13-15.
- Kappos L, et al : A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010 ; 362 : 387-401.
- Calabresi PA, et al : Safety and efficacy of fingolimod in patients with relapsing-remitting multiple sclerosis (FREEDOMS II) : a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Neurol 2014 ; 13 : 545-556.
- Cohen JA, et al : fingolimod oral ou interféron intramusculaire pour la sclérose en plaques en rechute. N Engl J Med 2010 ; 362 : 402-415.
- Langdon DW et al : Caractéristiques de base et effets du fingolimod sur les performances cognitives chez les patients atteints de sclérose en plaques en phase de rémission. Eur J Neurol 2021 ; 28(12):4135-4145.
- Fischer-Barnicol B, et al : Combination of teriflunomide and interferon as follow-up therapy after fingolimod-associated PML. Neurol Neuroimmunol Neuroinflamm 2021 ; 8. doi : 10.1212/NXI.0000000000000927
- Kappos L, et al : Siponimod versus placebo dans la sclérose en plaques progressive secondaire (EXPAND) : une étude de phase 3, randomisée, en double aveugle. Lancet 2018 ; 391 : 1263-1273.
- Selmaj K, et al : Siponimod for patients with relapsing-remitting multiple sclerosis (BOLD) : an adaptive, dose-ranging, randomised, phase 2 study. Lancet Neurol 2013 ; 12 : 756-767.
- Gajofatto A : Coup de projecteur sur le siponimod et son potentiel dans le traitement de la sclérose en plaques progressive secondaire : les preuves à ce jour. Drug Des Devel Ther 2017 ; 11 : 3153-3157.
- Huth F, Gardin A, Umehara K, He H : Prediction of the Impact of Cytochrome P450 2C9 Genotypes on the Drug-Drug Interaction Potential of Siponimod With Physiologically-Based Pharmacokinetic Modeling : A Comprehensive Approach for Drug Label Recommendations. Clin Pharmacol Ther 2019 ; 106:1113-1124.
- Gold, et al : Siponimod vs placebo dans la sclérose en plaques progressive secondaire active : une analyse post hoc de la phase 3 EXPAND study.J Neurol 2022 ; 269(9) : 5093-5104.
- Lamb YN : Ozanimod : Première approbation. Drugs 2020 ; 80:841-848.
- Comi G, et al : Sécurité et efficacité de l’ozanimod versus interféron bêta-1a dans la sclérose en plaques en rechute (SUNBEAM) : un essai de phase 3, multicentrique, randomisé, d’une durée minimale de 12 mois. Lancet Neurol 2019 ; 18 : 1009-1020.
- De Luca J et al. : Effet de l’ozanimod sur les performances du test de Symbol Digitalities dans la SEP en rémission. Mult Scler Relat Disord. 2021 ; 48:102673.
- D’Ambrosio D, Freedman MS, Prinz J : Ponesimod, un modulateur sélectif du récepteur S1P1 : un traitement potentiel pour la sclérose en plaques et d’autres maladies à médiation immunitaire. Ther Adv Chronic Dis 2016 ; 7 : 18-33.
- Olsson T, et al : Oral ponesimod in relapsing-remitting multiple sclerosis : a randomised phase II trial. J Neurol Neurosurg Psychiatry 2014 ; 85 : 1198-1208.
- Kappos L, Fox RJ, Burcklen M, et al. : Ponesimod Comparé au Teriflunomide chez les patients atteints de sclérose en plaques en phase de rémission dans l’étude OPTIMUM de phase 3 sur comparateur actif : un essai clinique randomisé. JAMA Neurol 2021 ; 78(5) : 558-567.
- Freedman MS, Pozzilli C, Havrdova EK, et al. : Long-term Treatment With Ponesimod in Relapsing-Remitting Multiple Sclerosis : Results from Randomized Phase 2b Core and Extension Studies. Neurology 2022 Jun 6;10.1212/WNL.0000000000200606.
- Ruggieri S, Quartuccio ME, Prosperini L : Ponesimod in the Treatment of Relapsing Forms of Multiple Sclerosis : An Update on the Emerging Clinical Data. Degener Neurol Neuromuscul Dis 2022 ; 12 : 61-73.
InFo NEUROLOGIE & PSYCHIATRIE 2022 ; 20(5) : 12-18