Il cancro ai polmoni è il tumore mortale più comune in tutto il mondo e la sua incidenza è ancora in aumento nei tempi moderni. Nonostante i progressi nella diagnostica e nella terapia, la letalità del tumore al polmone è in testa in entrambi i sessi rispetto a tutti gli altri tumori. Fondamentalmente, i carcinomi polmonari a piccole cellule si distinguono dai carcinomi polmonari non a piccole cellule, il che è di importanza centrale per il regime terapeutico e la prognosi. Mentre il tumore polmonare a piccole cellule è dominio della chemioterapia e della radioterapia, il tumore polmonare non a piccole cellule (NSCLC) viene operato in fase localizzata e si può ottenere una cura. In questo articolo di revisione, vengono discussi solo il follow-up e la prognosi del NSCLC operato con intento curativo.
Poiché il cancro al polmone viene spesso diagnosticato solo in uno stadio avanzato e spesso già metastatizzato, solo circa il 25-30% di tutti i “carcinomi polmonari non a piccole cellule” (NSCLC) può essere trattato con la chirurgia [1]. Il prerequisito per un concetto di terapia chirurgica è la possibilità di una resezione radicale, a condizione che il paziente sia operabile [2]. Di norma, negli stadi da I a IIIA si dovrebbe puntare a un intervento chirurgico, se necessario con chemioterapia (neo)adiuvante. Il tasso di sopravvivenza a 5 anni corrispondente agli stadi tumorali è compreso tra il 24 e il 73% in questo gruppo di pazienti (Fig. 1) [2].

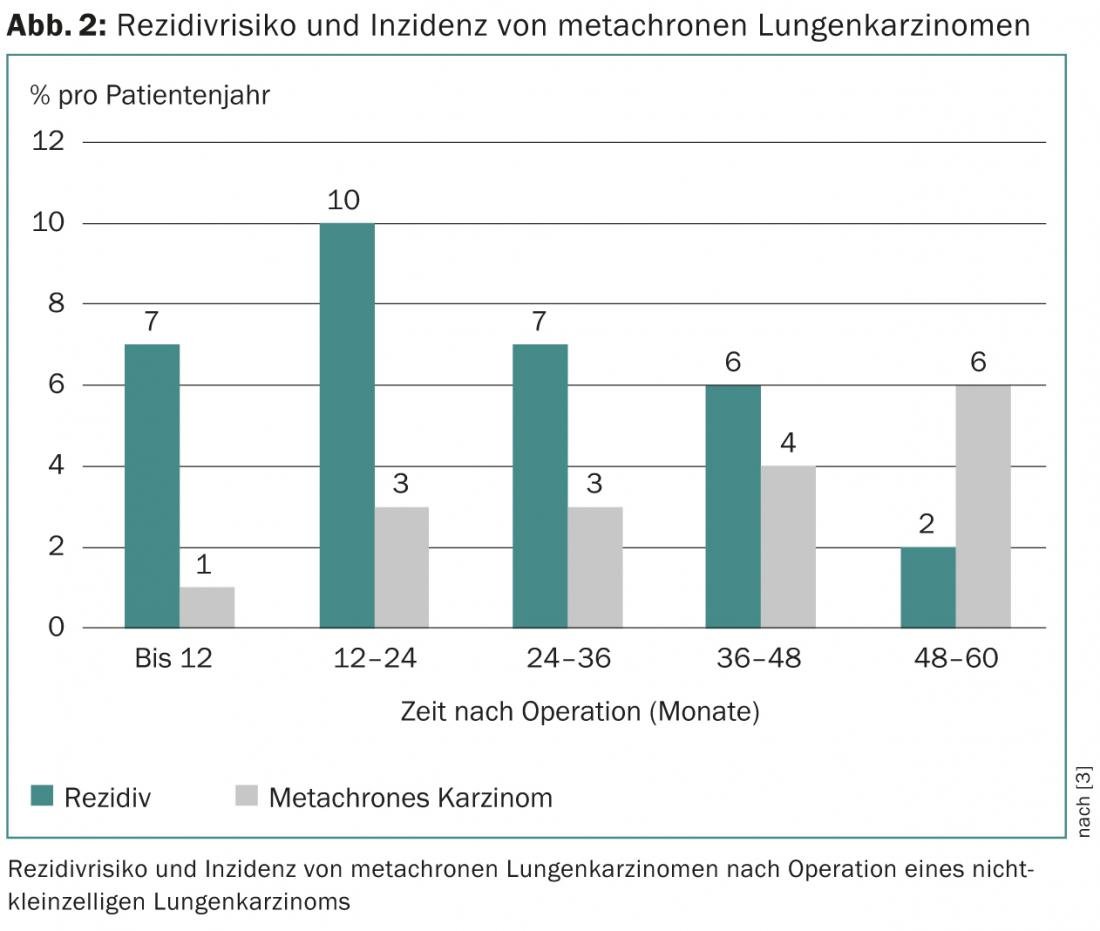
Recidiva e carcinoma metacrono
La probabilità di sopravvivenza del paziente dipende dallo stadio del tumore e dal corrispondente rischio di recidiva. Quest’ultimo aumenta fino a un massimo del 10% all’anno nei primi due anni dopo l’intervento, per poi ridursi lentamente [3]. In totale, il 5-71% di tutti i pazienti – a seconda dello stadio iniziale del tumore – subisce una recidiva, che nella metà dei casi si verifica nei primi due anni post-operatori [4–7]. Anche la recidiva di un carcinoma metacrono (“secondo carcinoma primario”), il cui rischio aumenta costantemente con il passare del tempo dopo l’intervento, deve essere distinta dalla recidiva (Fig. 2).
Pro e contro del follow-up post-operatorio
In considerazione del tasso di recidiva e del rischio di carcinoma metacrono, sembra ragionevole che queste neoplasie possano essere individuate precocemente, cioè in una fase asintomatica, attraverso una sorveglianza strutturata post-terapia – a condizione che un nuovo intervento terapeutico migliori le possibilità di sopravvivenza e la qualità di vita.
Purtroppo, i dati relativi al valore del follow-up post-operatorio dopo l’intervento chirurgico per il cancro al polmone sono piuttosto scarsi e talvolta addirittura contraddittori. Poiché il tasso di intervento chirurgico per le recidive locoregionali è relativamente basso, pari all’1-4%, non si possono fare affermazioni affidabili sul beneficio del follow-up del tumore [7]. Mancano completamente studi controllati randomizzati che abbiano affrontato questa domanda. In uno studio prospettico non randomizzato, è stato dimostrato che il tempo di sopravvivenza mediano per le recidive asintomatiche è significativamente più lungo rispetto alle recidive sintomatiche [6]. Al contrario, altri autori non sono riusciti a trovare alcuna influenza del follow-up strutturato sul tempo di sopravvivenza o sulla qualità della vita [8–10]. Tuttavia, in una recente meta-analisi, nonostante i programmi di follow-up eterogenei utilizzati negli studi inclusi, il follow-up strutturato ha mostrato che le recidive avevano una maggiore probabilità di essere diagnosticate in uno studio asintomatico, migliorando significativamente la probabilità di sopravvivenza (hazard ratio 0,61, intervallo di confidenza al 95% 0,50-0,74, p<0,01) [11]. Tuttavia, occorre considerare il rapporto costo-efficacia dei regolari controlli post-operatori, pari a circa 90.000 franchi svizzeri all’anno per paziente [12, 13].
Purtroppo, negli studi precedenti che hanno affrontato questa domanda, non sono stati presi in considerazione né lo stadio iniziale del tumore né la resecabilità di una recidiva locoregionale. Per questo motivo, diverse parti chiedono un programma di follow-up “individualizzato”, cioè adattato allo stadio del tumore e allo stato di salute [7].
Metodi di assistenza post-operatoria di follow-up
In linea di principio, nel follow-up post-operatorio possono essere utilizzate diverse modalità, singolarmente o in combinazione (radiografia, tomografia computerizzata, tomografia a emissione di positroni [PET], broncoscopia, esami di laboratorio e clinici).
Tuttavia, i programmi di follow-up eterogenei rendono difficile una valutazione conclusiva dei loro benefici e del rapporto costo-efficacia. Come già detto, mancano studi randomizzati che abbiano confrontato le diverse strategie nei pazienti con NSCLC sottoposti a intervento chirurgico. Attualmente non è chiaro quale metodo di follow-up debba essere utilizzato e a quali intervalli. A questo proposito, anche le raccomandazioni e le opinioni degli esperti delle varie società professionali sono incoerenti. D’altra parte, c’è accordo sull’utilità di esami di follow-up regolari (Tab. 1). Per quanto riguarda il metodo, la tomografia computerizzata sembra essere il metodo di scelta grazie alla sua economicità, all’esposizione relativamente bassa alle radiazioni e alla sensibilità relativamente buona (62-100%), sebbene la PET/CT sia superiore in termini di sensibilità (97-100%) [7].
Un’altra questione irrisolta: chi dovrebbe effettuare i controlli di follow-up post-operatori? Tuttavia, in uno studio retrospettivo su 245 pazienti, è stato dimostrato che non c’è una differenza significativa nella mortalità quando il follow-up viene effettuato dal team chirurgico curante o da un medico generico [14]. Sembra persino ragionevole, secondo uno studio britannico, che gli infermieri specificamente formati possano fornire un follow-up paragonabile a quello dei medici in termini di soddisfazione del paziente e di costi [15]. Tuttavia, l’influenza sui tassi di mortalità non è stata considerata in questo studio.

Conclusione
Sebbene manchino dati chiari sul beneficio di un follow-up strutturato post-operatorio nel NSCLC, un programma di follow-up sembra essere raccomandabile se si può offrire un approccio terapeutico curativo. Poiché la frequenza delle recidive è significativamente più alta nei primi due anni post-operatori rispetto agli anni successivi, le visite di follow-up devono essere più frequenti (ad esempio, ogni 3-6 mesi), soprattutto in questo periodo. Allo stesso tempo, però, bisogna sottolineare che il numero di tomografie computerizzate, soprattutto nei pazienti più giovani, deve essere preso in considerazione a causa dell’esposizione alle radiazioni. Tuttavia, la tomografia computerizzata sembra essere il metodo di scelta nel follow-up del tumore, grazie alla sua elevata sensibilità e all’esposizione relativamente bassa alle radiazioni.
Conclusione per la pratica
- Il rischio di recidiva dopo un intervento chirurgico curativo per il tumore al polmone non a piccole cellule è più alto nei primi due anni post-operatori (7-10%/anno).
- Se una recidiva viene individuata precocemente in una fase asintomatica, la mortalità può probabilmente essere ridotta, a condizione che si possa offrire un approccio terapeutico curativo. Tuttavia, la situazione dei dati a questo proposito è insufficiente.
- Non ci sono studi randomizzati che abbiano confrontato diversi programmi di follow-up (modalità, tempi e intervalli) in termini di benefici e di rapporto costo-efficacia. Pertanto, le raccomandazioni delle diverse società professionali sono eterogenee a questo riguardo.
- Grazie alla sua elevata sensibilità e all’esposizione relativamente bassa alle radiazioni, la TAC è attualmente il metodo di scelta per rilevare le recidive precoci.
Daniel Franzen, MD
Letteratura:
- Eur Respir Rev 2013; 22: 382-404.
- Chest 2009; 136: 260-271.
- J Thorac Cardiovasc Surg 2013; 145: 75-81; discussione 81-72.
- Cancer Res 1995; 55: 51-56.
- Ann Thorac Surg 1984; 38: 331-338.
- Ann Thorac Surg 2000; 70: 1185-1190.
- Ann Thorac Surg 2013; 95: 1112-1121.
- Chest 1999; 115: 1494-1499.
- J Thorac Cardiovasc Surg 1996; 112: 356-363.
- Ann Surg 1995; 222: 700-710.
- J Thorac Oncol 2011; 6: 1993-2004.
- Ann Thorac Surg 1995; 60: 1563-1570; discussione 1570-1562.
- Eur Respir J 2002; 19: 464-468.
- Ann Thorac Surg 2000; 69: 1696-1700.
- BMJ 2002; 325: 1145.
- J Clin Oncol 2004; 22: 330-353.
- Ann Oncol 2010; 21 Suppl 5: v103-115.
- Chest 2007; 132: 355S-367S.
- Radiologia 2000; 215 Suppl: 1363-1372.
- Linee guida del National Comprehensive Cancer Network (NCCN) in oncologia: Carcinoma non a piccole cellule. Disponibile su: www.nccn.org/professionals/physician_gls/PDF/nscl.pdf
InFo Oncologia & Ematologia 2013; 1(1): 22-24