Nel trattamento del tumore al polmone non a piccole cellule, sono stati raggiunti molti risultati in breve tempo. Tenere traccia di così tante e rapide innovazioni può essere piuttosto difficile, ma ne vale la pena. Perché i pazienti possono già trarre enormi benefici dai nuovi approcci terapeutici.
Classicamente, esistevano chiare linee guida per la terapia del carcinoma polmonare non a piccole cellule, in base allo stadio TNM. Attualmente sono sempre più messi in discussione dallo sviluppo di nuove terapie mirate , come gli inibitori della tirosin-chinasi di terza generazione o gli immunoterapici. Un esempio è la nuova raccomandazione di eseguire una terapia di mantenimento con un inibitore del checkpoint per un anno dopo la radiochemioterapia, in caso di espressione di PD-L1 nello stadio III [1].
Novità nella terapia neoadiuvante
Non solo ci sono nuovi approcci terapeutici per la terapia di mantenimento nello stadio III, ma ci sono anche nuove opzioni interessanti in cantiere per la terapia neoadiuvante. Ad esempio, è stato recentemente scoperto che dopo solo due dosi neoadiuvanti di un inibitore di PD-L1, molti pazienti mostrano una percentuale considerevole di cellule tumorali morte nella resezione, anche se una risposta non è necessariamente rilevabile radiologicamente [2]. Poiché il rischio di recidiva aumenta in modo significativo con la proporzione di cellule tumorali vive nel tessuto rimosso [3], questa scoperta è di grande importanza per la terapia e dimostra che il blocco del checkpoint potrebbe essere una valida alternativa alla chemioterapia anche nella terapia neoadiuvante. Attualmente si stanno sperimentando diversi farmaci per questa area di applicazione, con risultati finora promettenti. Anche nello stadio IIIA, è stato possibile dimostrare gli effetti positivi dell’immunoterapia perioperatoria in aggiunta alla chemioterapia neoadiuvante [4].
Diagnostica molecolare
Considerando il potenziale beneficio dell’inibitore della tirosin-chinasi o dell’immunoterapia anche negli stadi precoci del tumore, le attuali linee guida per la diagnostica molecolare appaiono piuttosto caute. L’analisi dell’espressione di PD-L1 è raccomandata negli stadi III e IV, mentre il test delle mutazioni comuni per le quali esistono terapie mirate approvate, solo nello stadio IV. (Tab. 1). Questo concetto deve essere certamente messo in discussione nella situazione attuale dei dati, in cui, ad esempio, l’uso di inibitori della tirosin-chinasi come osimertinib come terapia adiuvante per i tumori mutati EGFR di stadio inferiore suscita speranze giustificate [5, 6].
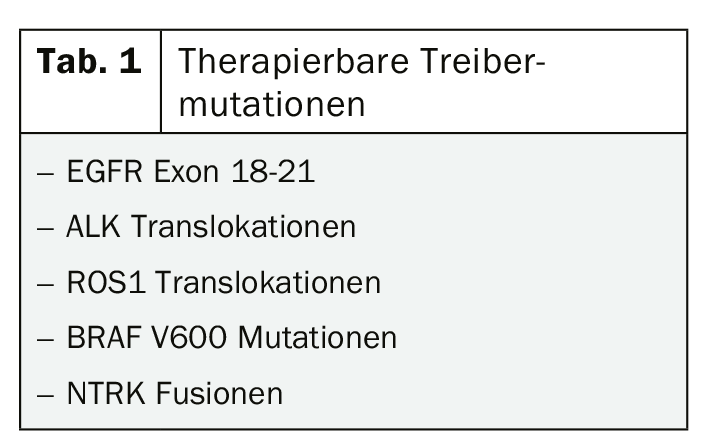
Anche se le nuove opzioni per il trattamento del NSCLC mutante, in particolare, suscitano una certa euforia e i test molecolari saranno probabilmente ampliati nel prossimo futuro, è importante tenere presente che l’80% dei NSCLC non presenta una mutazione driver trattabile. Tuttavia, per i pazienti in cui è possibile individuare una mutazione bersagliabile, la terapia mirata è la scelta migliore, almeno nello stadio IV. Di conseguenza, negli ultimi mesi si è fatto molto in questo settore, con le nuove approvazioni degli inibitori ALK brigatinib e lorlatinib, tra gli altri.
Cosa fare se non c’è una mutazione driver?
Nel caso più comune in cui non sia possibile individuare alcuna mutazione driver nel NSCLC in stadio IV, le opzioni terapeutiche sono purtroppo meno numerose. Tuttavia, anche gli immunoterapici sono sempre più utilizzati per questi tumori. In caso di espressione di PD-L1 superiore al 50%, sono stati utilizzati soprattutto gli inibitori del checkpoint, che sono chiaramente superiori alla chemioterapia in questo gruppo di pazienti. Indipendentemente dall’espressione di PD-L1, è stato dimostrato che la combinazione di immunoterapia e chemioterapia è più efficace della sola chemioterapia [7].
Recentemente, sono emersi anche altri concetti per il trattamento del NSCLC avanzato senza una mutazione driver trattabile, come la combinazione di due immunoterapie indipendenti dal livello di espressione di PD-L1 [8]. Questo approccio sembra essere chiaramente superiore alla sola chemioterapia, ma non è ancora stato confrontato con la combinazione di immunoterapia e chemioterapia. Dai dati finora disponibili, sembra che l’espressione di PD-L1 non sia un requisito obbligatorio per la risposta all’immunoterapia, in particolare all’immunoterapia intensificata con diverse classi di farmaci.
Oltre ad altre combinazioni terapeutiche, di recente sono stati resi noti nuovi bersagli. Questi includono TIGIT (immunorecettore delle cellule T con dominio immunoglobulinico e ITIM), che è spesso espresso insieme a PD-L1. Uno studio che ha combinato un inibitore corrispondente con il blocco di PD-L1 ha dato i primi risultati promettenti [9].
Il coperchio giusto per la pentola giusta
La selezione corretta e più efficiente dei pazienti per la moltitudine di terapie disponibili rimane un punto dolente. Terapie sempre più specifiche e gruppi target più piccoli contribuiscono all’importanza dei marcatori predittivi e della diagnostica genetica molecolare affidabile. Anche se la pipeline è in fermento, mancano ancora dati a lungo termine per molte delle nuove sostanze e combinazioni. Quindi, ad ogni passo emergono nuove domande, ostacoli, ma anche molte altre possibilità. In breve, c’è solo una cosa che aiuta: rimanere sintonizzati!
Fonte: Forum per la Formazione Medica Continua (FOMF), Aggiornamento, Immunoncologici e Terapie Mirate – Presentazione su “Cancro al polmone non a piccole cellule”, Livestream 20.06.2020, PD Dr. Niels Reinmuth, Medico Responsabile Oncologia presso la Clinica Asklepios
a Monaco-Gauting (D).
Letteratura:
- Antonia SJ, Villegas A, Daniel D, et al: Durvalumab dopo la chemioterapia nel carcinoma polmonare non a piccole cellule in stadio III. New England Journal of Medicine 2017;377(20): 1919-1929.
- Forde PM, Chaft JE, Smith KN, et al: Blocco PD-1 neoadiuvante nel carcinoma polmonare resecabile. N Engl J Med. 2018;378(21): 1976-1986.
- Hellmann MD, Chaft JE, William WN, Jr, et al: Risposta patologica dopo la chemioterapia neoadiuvante nei tumori polmonari non a piccole cellule resecabili: proposta per l’uso della risposta patologica maggiore come endpoint surrogato. Lancet Oncol. 2014; 15(1): e42-50.
- Rothschild S, Zippelius A, Savic S, et al.: SAKK 16/14: L’anticorpo anti-PD-L1 durvalumab (MEDI4736) in aggiunta alla chemioterapia neoadiuvante nei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) in stadio IIIA(N2) – Studio multicentrico a braccio singolo di fase II. Giornale di Oncologia Clinica. 2016;34(15_suppl): TPS8573-TPS.
- Zhong WZ, Wang Q, Mao WM, et al: Gefitinib versus vinorelbina più cisplatino come trattamento adiuvante per l’NSCLC EGFR-mutante di stadio II-IIIA (N1-N2) (ADJUVANT/CTONG1104): uno studio randomizzato, in aperto, di fase 3. Lancet Oncol. 2018;19(1): 139-148.
- Wu YL, Herbst RS, Mann H, et al: ADAURA: Studio di Fase III, in doppio cieco, randomizzato di Osimertinib rispetto al placebo nel NSCLC in stadio precoce positivo alla mutazione EGFR dopo resezione chirurgica completa. Clinica del cancro del polmone. 2018;19(4): e533-e536.
- Jotte RM, editore IMpower131: Analisi primaria della PFS e della sicurezza di uno studio randomizzato di fase III di atezolizumab + carboplatino + paclitaxel o nab-paclitaxel vs carboplatino + nab-paclitaxel come terapia 1L nel NSCLC squamoso avanzato2018; Riunione annuale ASCO: American Society of Clinical Oncology.
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al: Nivolumab più ipilimumab nel carcinoma polmonare non a piccole cellule avanzato. New England Journal of Medicine 2019;381(21): 2020-2031.
- Rodriguez-Abreu D, Johnson ML, Hussein MA, et al: Analisi primaria di uno studio randomizzato, in doppio cieco, di fase II dell’anticorpo anti-TIGIT tiragolumab (tira) più atezolizumab (atezo) rispetto a placebo più atezo come trattamento di prima linea (1L) nei pazienti con NSCLC selezionato per PD-L1 (CITYSCAPE). Giornale di Oncologia Clinica. 2020;38(15_suppl): 9503.
InFo ONCOLOGIA & EMATOLOGIA 2020; 8(4): 30-31 (pubblicato il 20.9.20, prima della stampa).
InFo PNEUMOLOGIA & ALLERGOLOGIA 2020, 2(3): 34-35