È necessario migliorare l’informazione e l’educazione del pubblico su questa malattia. Nei Paesi industrializzati, il tasso di casi non diagnosticati è stimato intorno al 50%. Per quanto riguarda la terapia, è importante una buona collaborazione tra l’oculista curante e il medico di base.
Il glaucoma è una malattia cronica degli occhi che può potenzialmente portare alla cecità ed è nota da molto tempo. Interessante e non noto a tutti è il background storico della nomenclatura: già gli antichi greci notarono che alcuni pazienti accecati mostravano un colore sorprendente del loro riflesso pupillare. La traduzione della parola greca “glaukos” è “grigio-bluastro-verdastro”. L’esatta anatomia dell’occhio e la fisiopatologia non erano ancora note. Nell’VIII secolo d.C. fu coniato il termine “cataratta” per le opacità del cristallino, ma ancora non era chiaro l’esatto meccanismo della cecità. Solo dopo l’invenzione dell’oftalmoscopio e la conseguente possibilità di valutare il fondo dell’occhio e il nervo ottico, è stato possibile separare le entità cataratta e glaucoma.
Il termine “glaucoma” utilizzato nella lingua tedesca, invece, è stato coniato solo nel XVIII secolo. All’epoca si pensava che i “succhi” nell’occhio potessero cambiare colore e assumere un colore verdastro nel glaucoma. Tuttavia, l’origine esatta del termine non è nota. La malattia può manifestarsi a qualsiasi età, ma la sua incidenza aumenta significativamente con l’età. Si presume che il 2,5% di tutte le persone di età superiore ai 40 anni in Svizzera soffra di glaucoma, ed è notevole che più della metà dei pazienti colpiti non sia consapevole della propria malattia [1].
Nel 2004, il glaucoma era la causa più comune di cecità irreversibile [2] e la cataratta era la causa più comune di cecità reversibile. La degenerazione maculare senile porta anche alla cecità irreversibile. Negli ultimi anni, il numero di pazienti che diventano ciechi a causa della degenerazione maculare è aumentato notevolmente a causa dell’aumento dell’aspettativa di vita e ha assunto la posizione di leader tra le cause di cecità in alcuni Paesi.
Fisiopatologia
In termini semplici, il bulbo oculare è una struttura sferica circondata da un guscio solido. Di conseguenza, esiste una pressione interna variabile per ogni occhio, che è importante per l’omeostasi. Questa pressione interna è controllata dal rapporto tra la produzione di umor acqueo e il deflusso di umor acqueo. Nel glaucoma, c’è una mancata corrispondenza di questi due componenti e molto spesso il deflusso nell’angolo camerale è compromesso. Se la pressione intraoculare sale oltre la pressione tollerabile per l’occhio interessato, si verifica un danno progressivo alla parte più debole, il nervo ottico. L’aumento del danno al nervo ottico porta a una progressiva compromissione del campo visivo. È importante sottolineare che la pressione interna ottimale tollerabile è diversa per ogni occhio; il glaucoma progressivo può svilupparsi anche con una pressione interna normale-bassa. Le attuali definizioni di glaucoma omettono quindi la pressione interna come fattore principale del danno al nervo ottico e la mettono sullo stesso piano degli altri fattori di rischio [3]. Questi fattori di rischio sono descritti in modo più dettagliato nella sezione sulla diagnostica.
Divisione
I glaucomi possono essere classificati in base alla loro struttura o alla loro eziologia. Strutturalmente, distinguiamo le seguenti forme:
- I glaucomi ad angolo aperto (circa il 90%) presentano un angolo di camera aperto per tutto il tempo. L’ostruzione al deflusso dell’umor acqueo è localizzata principalmente a livello della rete trabecolare e nel passaggio alle vene episclerali e porta a un aumento più o meno pronunciato della pressione intraoculare. Un sottogruppo è costituito da pazienti con il cosiddetto glaucoma a pressione normale, in cui la pressione intraoculare è sempre all’interno dell’intervallo normale, ma il nervo ottico mostra segni di danno crescente.
- I glaucomi a chiusura angolare (circa il 5%) presentano un angolo di camera più o meno chiuso. I pazienti con una situazione cosiddetta ad angolo stretto devono essere informati sui risultati, poiché in determinate condizioni può verificarsi un rapido aumento della pressione oculare. Questo rapido aumento della pressione oculare è una situazione di emergenza oftalmologica: l’attacco acuto di glaucoma è molto doloroso e, oltre ai sintomi oculari, comporta anche una marcata compromissione delle condizioni generali.
In una classificazione secondo l’eziologia, distinguiamo due forme:
- Nel glaucoma primario (circa il 95%), il glaucoma è la malattia principale dell’occhio.
- Nel glaucoma secondario (circa il 5%), è presente un’altra malattia dell’occhio e il glaucoma è una malattia secondaria.
I glaucomi congeniti sono un sottogruppo e la maggior parte sono glaucomi primari.
Diagnostica
L’oftalmologo effettua un’anamnesi per determinare il profilo di rischio. Distinguiamo i seguenti gruppi come fattori di rischio [4]:
- Fattori di rischio familiari, in particolare il glaucoma nei parenti stretti (genitori, fratelli e nonni).
- Fattori di rischio personali: L’età, l’etnia e il sesso sono fattori determinati. I fattori di rischio vascolare possono essere parzialmente influenzati, per cui l’ipotensione sistemica (soprattutto notturna) deve essere registrata. Sono degne di nota le forti fluttuazioni della pressione sanguigna, che possono essere registrate nel corso di una misurazione della pressione sanguigna di 24 ore. I pazienti con il cosiddetto glaucoma a tensione normale spesso mostrano segni di disregolazione vascolare con acra fredda, sintomi di Raynaud, emicrania e talvolta ipotensione sistemica. L’influenza dell’ipertensione sistemica e del diabete mellito è ancora controversa. L’anamnesi farmacologica è importante: gli anticolinergici possono provocare un attacco di glaucoma acuto nei pazienti con una situazione di angolo stretto. I preparati contenenti cortisone (anche in forma di pomata o iniezione) provocano un aumento della pressione intraoculare in un terzo dei pazienti. Il meccanismo si basa su un aumento della resistenza al deflusso nell’angolo camerale, per il quale sono state discusse diverse teorie ed è presumibile che sia presente un difetto genetico (“steroid responder”) [5].
- Fattori di rischio oculare: il fattore di rischio più importante è l’aumento della pressione intraoculare, anche se, come già detto, ogni occhio ha la sua pressione intraoculare massima tollerabile. Altri fattori di rischio includono anomalie refrattive maggiori (ipermetropia e miopia), una cornea sottile (norma: 500-600 micron), emorragie intraoculari (soprattutto intorno al disco ottico) e depositi nell’occhio come la dispersione di pigmento e la pseudoesfoliazione, che possono bloccare il deflusso nell’angolo camerale.
Durante l’esame, vengono determinate la refrazione e l’acutezza visiva degli occhi, per ottenere indicazioni sulle prestazioni visive. La morfologia degli occhi viene valutata utilizzando una lampada a fessura con un ingrandimento di circa 10-16 volte per identificare eventuali fattori di rischio. La pressione oculare viene solitamente misurata con la tonometria ad applanazione di Goldmann (GAT), che è ancora il gold standard [6].
La pressione intraoculare ottimale è compresa tra 8-21 mm Hg. Si tratta di un valore statistico, basato su un valore medio di 15 mm Hg e sulla consueta deviazione standard.
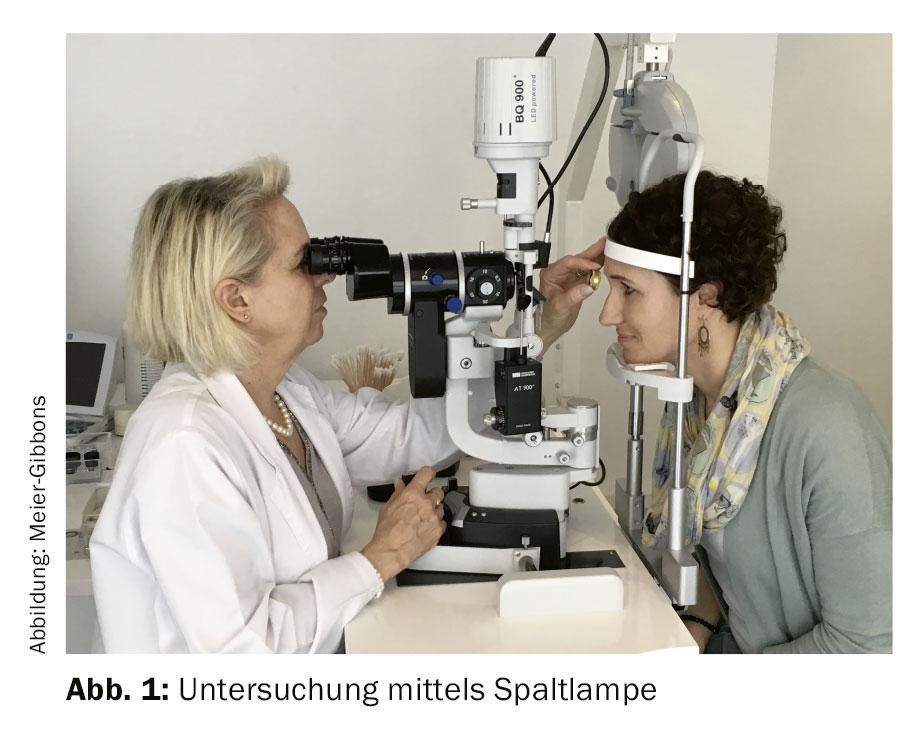
Se si sospetta un glaucoma, vengono ordinati altri esami (Fig. 1):
- La determinazione del campo visivo
- La rappresentazione morfologica del nervo ottico
- La rappresentazione dell’angolo della camera per mezzo di un vetro di contatto
- Misurazione della pressione oculare con vari dispositivi di misurazione e determinazione dello spessore corneale.
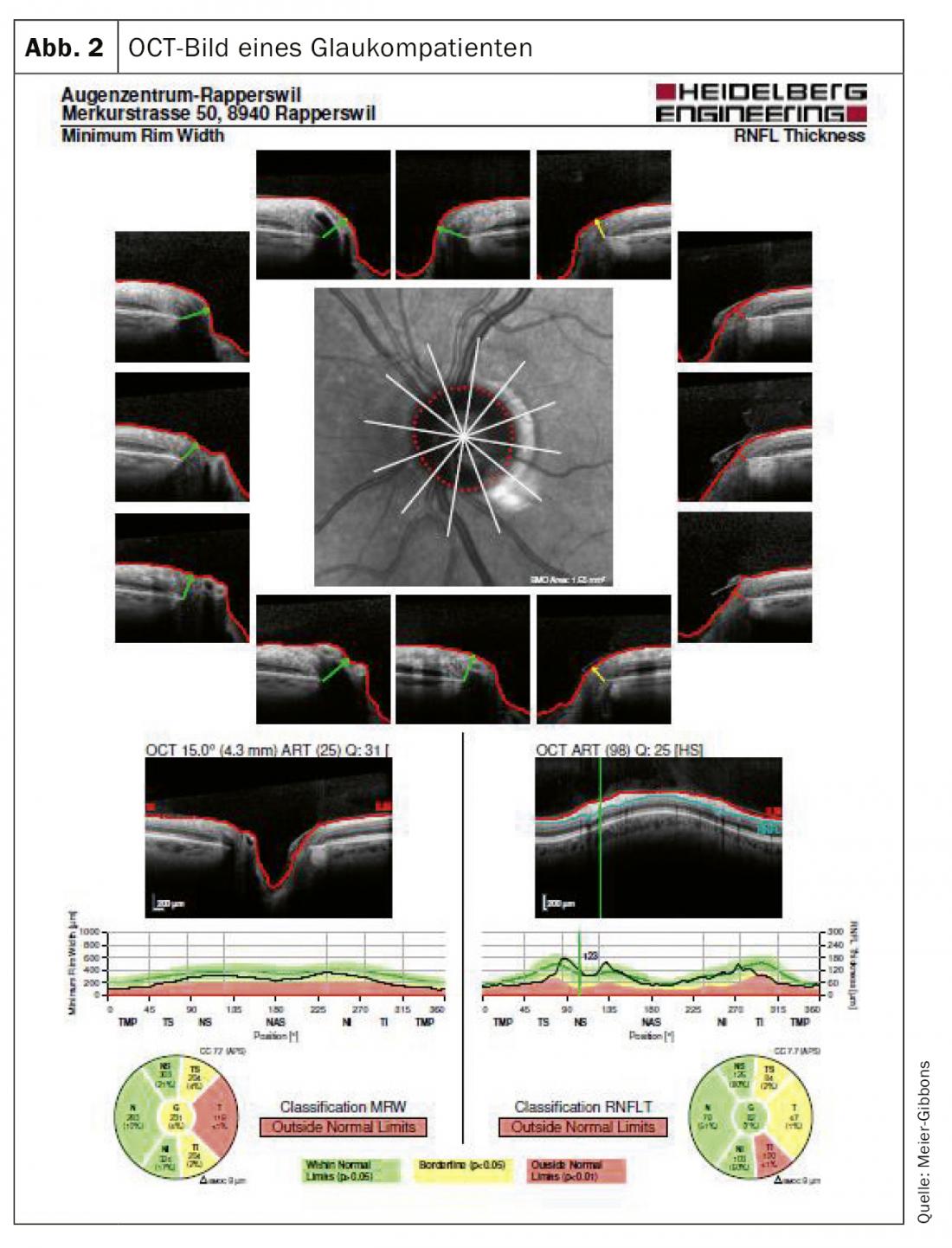
Il campo visivo viene determinato mediante la perimetria automatica. In questo esame, al paziente vengono presentati stimoli luminosi monoculari di varie dimensioni e intensità all’interno del normale campo visivo. Il nervo ottico deve essere misurato tridimensionalmente, per cui oggi si utilizza soprattutto la tomografia a coerenza oculare (OCT) guidata dal laser ( Fig. 2). Con questo esame, gli strati del tessuto nervoso possono essere rappresentati con precisione e confrontati con un database normalizzato. Spesso vengono ancora scattate fotografie a colori, che possono essere utilizzate per il confronto anche dopo molti anni, cosa che purtroppo spesso non è possibile con i dispositivi OCT che cambiano frequentemente (Fig. 3).

È importante esaminare l’angolo della camera utilizzando un vetro di contatto. La morfologia dell’angolo camerale fornisce informazioni sul tipo di glaucoma presente ed è importante per determinare la terapia. L’esame con il vetro a contatto è non invasivo e indolore per il paziente.
Negli ultimi anni, sono stati sviluppati diversi dispositivi di misurazione della pressione oculare più recenti, poiché gli studi avevano dimostrato che la misurazione secondo la GAT non rivelava la vera pressione interna in alcuni pazienti (soprattutto con cornee molto sottili, in presenza di alterazioni corneali patologiche o dopo un trattamento correttivo con il laser). Entrambi questi dispositivi di misurazione e la determinazione dello spessore corneale sono utilizzati come supplemento alla misurazione secondo GAT.
Tutti gli esami sopra citati sono indispensabili per fare una diagnosi. Distinguiamo tra risultati normali, risultati sospetti per il glaucoma e risultati chiaramente patologici.
È importante informare il paziente in modo accurato: Se i risultati oculari sono normali, si raccomanda un controllo e si informa il paziente che l’occhio può cambiare nel corso della vita e che alcune malattie possono comparire solo in età avanzata. È indispensabile fornire al paziente alcune linee guida per la distanza di controllo. Questo dipende dall’età, dall’anamnesi, dai risultati locali e dai fattori di rischio.
Nel caso di un reperto sospetto di glaucoma, è indispensabile informare il paziente: un reperto che al momento è borderline può rivelarsi un glaucoma in breve tempo. Un paziente sospettato di avere un glaucoma presenta, secondo la definizione (American Academy of Ophthalmology e European Glaucoma Society), uno o più dei seguenti risultati:
- Il disco ottico è sospetto per il glaucoma
- Il campo visivo è sospetto per il glaucoma
- La pressione oculare è superiore a 21 mm Hg (per cui è importante misurare la pressione oculare in diversi momenti della giornata per poter determinare i valori più elevati)
Osservazione generale: qualsiasi esame anormale deve essere ripetuto per sicurezza. Se la recidiva mostra davvero una patologia, potrebbe esserci una transizione verso la malattia glaucomatosa.
Terapia
Dobbiamo essere consapevoli che il paziente difficilmente si rende conto della malattia del glaucoma, almeno all’inizio, e che ogni terapia ha un effetto e spesso degli effetti collaterali.
Le linee guida della Società Europea del Glaucoma affermano che qualsiasi terapia deve soddisfare i seguenti tre punti principali: deve essere efficace e poco costosa e deve causare il minor numero possibile di effetti collaterali [3].
Al momento, la riduzione della pressione intraoculare è l’unica terapia in grado di ridurre la progressione della malattia. Naturalmente, gli altri fattori di rischio menzionati sopra devono essere controllati e ridotti, se possibile. Sarebbe interessante l’influenza e la protezione del nervo ottico stesso, la cosiddetta neuroprotezione. Purtroppo, le precedenti sperimentazioni farmacologiche non sono state molto promettenti.
Quali opzioni abbiamo per abbassare la pressione intraoculare? Ci sono davvero solo due opzioni:
- Riduzione della produzione di umore acqueo
- Miglioramento del deflusso di umore acqueo
Riduzione della produzione di umor acqueo: l’umor acqueo viene prodotto nel corpo ciliare, circola nelle camere posteriori e anteriori dell’occhio e lascia l’occhio attraverso l’angolo camerale nella circolazione vascolare. La produzione di umor acqueo può essere ridotta dai betabloccanti (BB), dagli agonisti alfa (AA) e dagli inibitori dell’anidrasi carbonica (CAI). Il betabloccante timololo viene utilizzato nella terapia del glaucoma dal 1978 e riduce la pressione intraoculare del 20-25%. A livello locale, le BB sono ben tollerate, ma spesso provocano effetti collaterali sistemici, come l’abbassamento della pressione sanguigna e del polso. A nostro avviso, i pazienti con una terapia BB pianificata dovrebbero consultarsi con il proprio medico di famiglia per evitare interferenze con altri farmaci.
Gli agonisti alfa sono stati utilizzati per molti anni, anche se gli AA disponibili in precedenza spesso provocavano effetti collaterali locali e sistemici molto pronunciati e quindi non sono più utilizzati. Oggi il farmaco più utilizzato è la brimonidina, che riduce la pressione intraoculare del 20-25%, ma può anche provocare effetti collaterali locali (iperaemia) e sistemici (vascolari e cerebrali).
Gli inibitori della carboanidrasi sono stati utilizzati in forma sistemica nella terapia del glaucoma fin dai primi anni ’50 e sono stati utilizzati anche a livello locale dal 1994. A volte provocano gravi effetti collaterali sistemici, soprattutto in presenza di ipersensibilità alle sulfonamidi. Sia gli agonisti alfa che gli inibitori dell’anidrasi carbonica sono talvolta utilizzati in combinazione con i betabloccanti per ottenere una migliore riduzione della pressione oculare.
Migliorare il deflusso dell’umor acqueo: l’umor acqueo lascia l’occhio in due modi: Il deflusso convenzionale o trabecolare e molto meno frequentemente il deflusso non convenzionale o uveosclerale. Quest’ultima corrisponde a una quota del 25-55% tra i bambini e diminuisce progressivamente con l’età. Una diminuzione del deflusso dell’umore acqueo porta a un riflusso nell’occhio e quindi a un aumento crescente della pressione intraoculare. Studi recenti hanno dimostrato che la maggior parte dell’aumento decisivo della resistenza al deflusso si trova nell’area della rete trabecolare iuxtacanalicolare e nell’area della parete interna del canale di Schlemm.
I farmaci più importanti utilizzati per migliorare il deflusso dell’umor acqueo sono gli agonisti locali delle prostaglandine. Sono stati utilizzati per la prima volta nella terapia del glaucoma a metà degli anni ’90 e hanno rapidamente conquistato la posizione di leader tra i farmaci antiglaucomatosi. Il primo prodotto è stato il latanoprost, seguito da diversi farmaci simili. L’effetto (una riduzione del 25% circa della pressione oculare) dura 24 ore, quindi l’aderenza del paziente è migliore. Gli agonisti delle prostaglandine non presentano praticamente effetti collaterali sistemici, ma gli effetti collaterali locali potrebbero essere considerevoli: Crescita delle ciglia, aumento della pigmentazione dell’iride, iperaemia della congiuntiva, ma anche scolorimento della pelle periorbitale più scura e atrofia del tessuto adiposo orbitale.
In alcuni Paesi (non ancora in Europa), sono stati approvati due nuovi gruppi di sostanze per la terapia del glaucoma: Inibitori della renina e latanoprost bunod. Entrambi i farmaci migliorano il deflusso dell’umor acqueo e devono essere usati solo una volta al giorno.
È importante per noi affrontare brevemente la questione dell’uso sempre più comune dei farmaci generici. Per definizione, il contenuto dei generici dovrebbe essere identico agli originali. Tuttavia, i colliri differiscono dai farmaci applicati per via sistemica per aspetti importanti:
- Possiamo determinare la concentrazione del principio attivo nel collirio, ma la biodisponibilità della sostanza nell’occhio stesso non può essere misurata.
- Solo il principio attivo dei generici deve essere identico al preparato originale, tutti i prodotti ausiliari possono variare. Poiché il principio attivo del latanoprost, ad esempio, è solo dello 0,005%, la maggior parte della goccia può essere modificata in un farmaco generico.
- Molti studi hanno mostrato differenze tra farmaci originator e generici in termini di dimensioni e viscosità della goccia, natura del flacone, apertura del flacone e conservante [7].
Pertanto, a nostro avviso, il passaggio a un farmaco generico è equivalente all’utilizzo di un nuovo farmaco e richiede controlli più frequenti all’inizio.
Il frequente passaggio a farmaci generici sempre più economici da parte delle farmacie è problematico, e può far sì che né il paziente né il medico sappiano quale farmaco stanno usando al momento. È opportuno discutere con il paziente per evidenziare le differenze tra i preparati originali e i generici.
Non è facile trovare una terapia antiglaucomatosa che riduca la progressione della malattia, che abbia pochi effetti collaterali e che venga utilizzata regolarmente. L’aderenza e la persistenza non sono molto buone nel glaucoma, come in altre malattie croniche. Molti studi hanno dimostrato che l’aderenza alla terapia prescritta è del 30-70% e che dopo un anno solo il 10% dei pazienti riordina i colliri prescritti [8].
Le ragioni della scarsa aderenza sono molteplici, ma dobbiamo essere consapevoli che stiamo prescrivendo una terapia che deve essere utilizzata in modo estremamente affidabile e regolare, ma che ha anche frequenti effetti collaterali. Questo è particolarmente problematico per i pazienti nelle prime fasi del glaucoma, poiché non notano quasi nulla della malattia stessa. In uno studio, Newman Casey ha riassunto le ragioni più comuni della mancata aderenza: Difficoltà con l’applicazione delle gocce, difficoltà a integrare l’applicazione delle gocce nella routine quotidiana ed effetti collaterali delle gocce [9]. Gli effetti collaterali non devono essere sottovalutati. Gli studi hanno dimostrato che due terzi dei pazienti affetti da glaucoma soffrono di effetti collaterali della loro terapia [10]. Sono sia gli effetti collaterali locali del farmaco che gli effetti tardivi sull’occhio e in particolare sulla superficie dell’occhio a dare fastidio al paziente. Se un paziente mostra effetti collaterali della sua terapia, è opportuno cambiare terapia, eventualmente anche da un derivato delle prostaglandine a un altro derivato. Per i pazienti più giovani, per quelli che assumono più farmaci e per quelli con disturbi della superficie oculare preesistenti (“sindrome sicca”), vale la pena provare un collirio senza conservanti. I conservanti, in particolare il cloruro di benzalconio, possono provocare un aumento dei problemi della superficie oculare. Tuttavia, poiché i colliri senza conservanti sono spesso confezionati in dosi singole, i pazienti con scarsa acutezza visiva o con alterazioni reumatiche alle mani possono avere difficoltà ad applicarli [11].
Oltre ai farmaci antiglaucomatosi, la pressione oculare può essere abbassata con misure chirurgiche. La prima procedura chirurgica per il glaucoma è stata eseguita nel 1856 (iridectomia di Von Graefe) e recentemente lo spettro chirurgico si è ampliato in modo significativo con l’introduzione della chirurgia microinvasiva del glaucoma (MIGS). Meno invasive sono varie tecniche laser che possono sia ridurre la produzione di umor acqueo che migliorare il deflusso dell’umor acqueo.
La chirurgia viene presa in considerazione soprattutto nei pazienti giovani con glaucoma avanzato o nei pazienti con intolleranza alla terapia locale (soprattutto problemi di superficie oculare).
Prospettive per il futuro
Il fatto che molti pazienti diventino ancora ciechi a causa del glaucoma è spaventoso, perché la malattia, se presa abbastanza presto e trattata in modo adeguato, può chiaramente essere influenzata nella sua progressione. Su cosa dobbiamo lavorare?
C’è ancora almeno il 50% dei pazienti che non sa di avere questa malattia. Pertanto, è indispensabile educare la popolazione per identificare i soggetti con glaucoma in rapido sviluppo, valutando i pazienti e i loro fattori di rischio.
Se un paziente con glaucoma inizia una terapia, l’aspetto dell’aderenza deve essere discusso con il paziente: Un farmaco applicato in gocce funziona solo se la goccia viene applicata!
Sono obbligatori controlli regolari del nervo ottico e della sua funzione; la pressione oculare deve essere controllata e la terapia regolata di conseguenza. Un paziente con diagnosi di glaucoma viene solitamente controllato da un oftalmologo 2-3 volte all’anno. I nuovi farmaci, con minori effetti collaterali e possibilmente con una diversa modalità di somministrazione (ad esempio, tappi per puntura con una forma a lento rilascio o tramite iniezione nell’occhio stesso) possono portare ad una migliore aderenza e quindi ad una migliore gestione del glaucoma.
Le alternative alla terapia farmacologica sono importanti: la terapia laser può essere utilizzata per migliorare il deflusso dell’umore acqueo; inoltre, la terapia chirurgica sta mostrando molti nuovi approcci e vengono sempre più eseguite le cosiddette procedure “microinvasive”, in cui talvolta vengono inseriti degli stent.
Il paziente stesso è e continuerà ad essere importante: deve essere informato con precisione sulla malattia e coinvolto nella terapia della sua malattia.
Messaggi da portare a casa
- Nonostante il miglioramento delle misure diagnostiche e terapeutiche, il glaucoma comporta ancora una riduzione della qualità di vita e talvolta la cecità in molti pazienti. Il numero di pazienti che non sono consapevoli della loro malattia è del 50%, anche nei Paesi industrializzati, e c’è bisogno di una maggiore informazione pubblica su questa malattia.
- Il medico deve fare un’anamnesi dettagliata di tutti gli adulti per valutare i fattori di rischio per lo sviluppo del glaucoma (familiare, sistemico e oculare). A partire dai 40 anni, è necessario un esame preventivo da parte di un oculista; i cosiddetti “esami preventivi”, talvolta eseguiti da ottici, non sono in alcun modo sufficienti.
- L’unica terapia per il glaucoma, finora, è il trattamento del fattore di rischio più importante, l’aumento della pressione oculare. Questa terapia viene effettuata per lo più con farmaci locali che abbassano la pressione oculare; con l’aumento delle opzioni chirurgiche, la terapia chirurgica diretta sarà probabilmente utilizzata più frequentemente in futuro.
- Una buona collaborazione tra l’oculista curante e il medico di base è importante per tutte le misure terapeutiche.
Letteratura:
- Quigley HA, West SK, Rodriguez J, et al: La prevalenza del glaucoma in uno studio basato sulla popolazione di soggetti ispanici: Proyecto VER. Arch Ophthalmol 2001; 119: 1819-1826.
- Bollettino dell’Organizzazione Mondiale della Sanità, novembre 2004; 82 (11).
- Linee guida EGS edizione 2014.
- Leske CM e altri. Per il gruppo di studio sul glaucoma manifesto precoce. Arch Ophthalmol. 2003;121(1): 48-56.
- Kersey JP, Broadway DC: Glaucoma indotto da corticosteroidi: una revisione della letteratura. Eye 2006; 20: 407-416.
- Goldmann H, Schmidt T: Sulla tonometria ad applanazione. Oftalmologica 1957; 134: 221-242.
- Genazzani AA, Pattarino F: Difficoltà nella produzione di un prodotto farmaceutico identico dal punto di vista della tecnologia farmaceutica. Drugs RD 2008; 9(2): 65-72.
- Friedman DS, Quigley HA e altri. Utilizzo dei dati delle richieste di rimborso in farmacia per studiare l’aderenza ai farmaci per il glaucoma: metodologia e risultati del Glaucoma Adherence and Persistency Study (GAPS). Invest Ophthalmol Vis Sci. 2007 Nov; 48(11): 5052-5057.
- Newman-Casey PA, Killeen OJ, Renner M, et al: L’accesso e le esperienze con la tecnologia e-health tra i pazienti affetti da glaucoma e la loro relazione con l’aderenza ai farmaci. Telemed J E Health 2018; DOI: 10.1089/tmj.2017.0324
- Zimmerman JB, Hahn SR, Gelb L, et al: L’impatto degli effetti avversi oculari nei pazienti trattati con analoghi topici delle prostaglandine: cambiamenti nei modelli di prescrizione e persistenza dei pazienti. J Ocul Pharmacol Ther: 1308-1316.
- Dietlein TS, Jordan JF, Lüke C, et al: Autoapplicazione di contenitori per gocce oculari monouso in una popolazione anziana: confronti con il flacone per gocce oculari standard e con pazienti più giovani. Acta Ophthalmol. 2008; 86: 856-859.
PRATICA GP 2019; 14(11): 6-10