Vengono riassunti alcuni studi importanti e interessanti nel campo della reumatologia dell’ultimo anno. Come in tutti i campi, le possibilità tecniche e analitiche stanno accelerando in modo esponenziale nella ricerca di base. Di conseguenza, anche il numero di studi pubblicati ogni anno in reumatologia è in costante aumento, e in tutte le aree della reumatologia vengono effettuate più ricerche e pubblicazioni che mai.
Il seguente articolo riassume alcuni studi importanti e interessanti nel campo della reumatologia dell’ultimo anno. Va notato che la selezione degli studi è da un lato completamente soggettiva e dall’altro naturalmente incompleta. Come in tutti i campi, le possibilità tecniche e analitiche stanno accelerando in modo esponenziale nella ricerca di base. Di conseguenza, anche il numero di studi pubblicati ogni anno in reumatologia è in costante aumento, e in tutte le aree della reumatologia vengono effettuate più ricerche e pubblicazioni che mai. (Fig. 1). Tuttavia, solo il tempo ci dirà quanti di questi risultati avranno davvero un impatto a lungo termine sulla nostra comprensione delle malattie reumatologiche.
Biopsie guidate da ultrasuoni e analisi di singole cellule
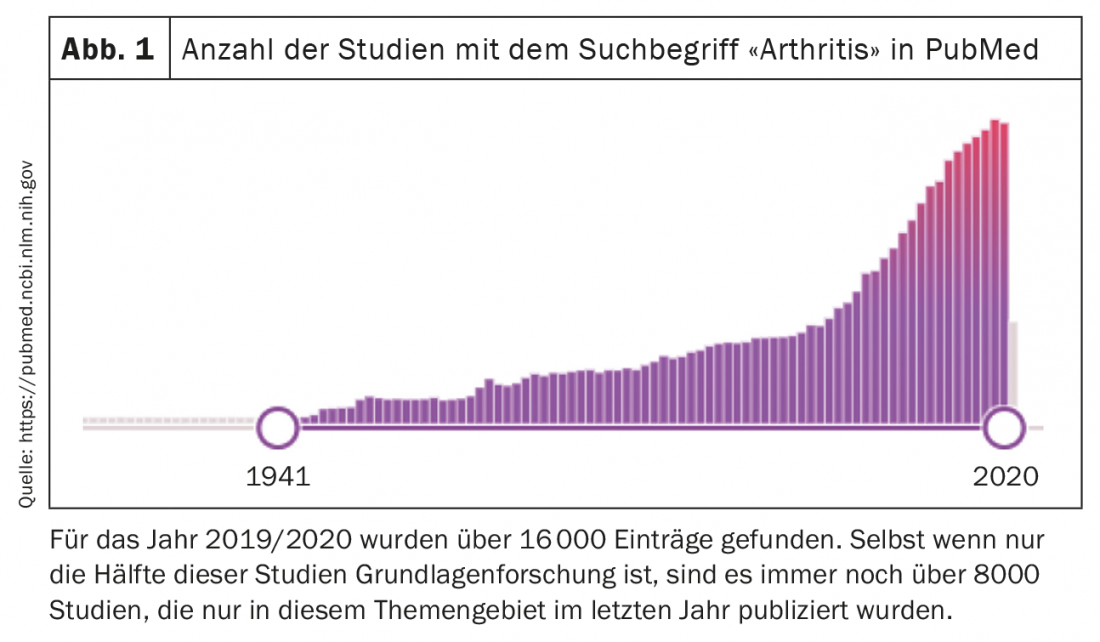
Nell’analisi delle cause patogenetiche, gli studi sul tessuto sinoviale sono diventati sempre più importanti negli ultimi anni, soprattutto nell’analisi dell’artrite reumatoide (AR), oltre agli studi sulle cellule del sangue e sugli anticorpi. Da un lato, l’esecuzione di biopsie sinoviali guidate da ultrasuoni sta diventando sempre più accettata e viene eseguita di routine in molti luoghi. D’altra parte, i progressi nello sviluppo di tecnologie per l’analisi di singole cellule stanno aprendo nuove possibilità per l’indagine differenziata dei cambiamenti nelle singole popolazioni cellulari nell’articolazione. Con queste analisi su singola cellula, l’espressione genica, il cosiddetto trascrittoma, così come l’espressione proteica e persino i cambiamenti nella cromatina possono essere misurati separatamente in ogni singola cellula. La maggior parte degli studi condotti finora ha utilizzato le misurazioni del trascrittoma per definire le popolazioni cellulari e analizzare i cambiamenti nella loro composizione e nell’espressione genica nei pazienti. Tuttavia, man mano che lo sviluppo progredisce e il campo diventa più conveniente, è probabile che ci saranno sempre più studi che misurano simultaneamente i cambiamenti della cromatina, del trascrittoma e dell’espressione proteica nelle singole cellule. L’analisi delle cellule singole di un tessuto complesso permette di caratterizzare i tipi di cellule, i sottotipi di cellule e i fenotipi di cellule in un tessuto e quindi di identificare le cellule che sono attivate in una malattia e che hanno un potenziale ruolo chiave nella patogenesi (Fig. 2) .
La cosiddetta Accelerated Medicine Partnership (AMP) degli Stati Uniti è all’avanguardia in questo settore. Questo consorzio, che è in parte finanziato dall’industria e in parte dallo Stato, è già stato in grado di presentare diversi studi in cui è stato possibile caratterizzare i tipi di cellule immunitarie, ma anche le cellule stromali in vari tessuti bersaglio e in varie malattie reumatiche. Nella sinovia sono già stati descritti nuovi tipi di cellule immunitarie rilevanti per l’AR e sono stati definiti diversi sottotipi di fibroblasti [1]. Questi dati sono stati completati l’anno scorso e la formazione e la funzione delle diverse popolazioni di fibroblasti hanno potuto essere analizzate meglio.
Interazioni tra endotelio e fibroblasti nella sinovia dell’AR
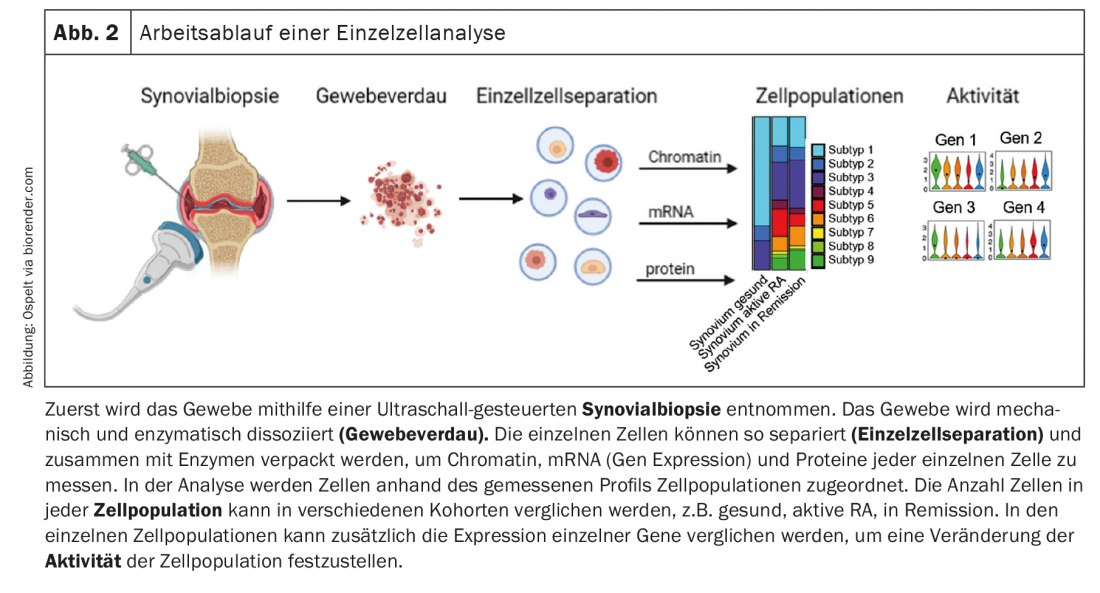
Nella loro prima pubblicazione, gli autori hanno identificato diversi sottotipi di fibroblasti sinoviali nel tessuto [1]. In particolare, è stato possibile distinguere i fibroblasti sinoviali CD90-negativi, che si trovano nel rivestimento sinoviale, e i fibroblasti sinoviali CD90-positivi, che si trovano nel rivestimento secondario. Gli autori hanno ora perseguito l’ipotesi che nel tessuto sinoviale si stabilisca un gradiente che supporta la formazione di questi diversi sottotipi di fibroblasti [2]. In effetti, le analisi dei recettori dei ligandi hanno mostrato che le cellule endoteliali stabilizzano il sottotipo di fibroblasti CD90-positivi attraverso l’attivazione della via di segnalazione Notch. Questa attivazione è stata più forte nel tessuto RA rispetto al tessuto OA. Utilizzando modelli murini con topi Notch3 knock-out, o l’inibizione farmacologica della via di segnalazione Notch, gli autori hanno potuto dimostrare che l’inibizione di Notch è un nuovo potenziale bersaglio per la terapia dell’AR, in quanto l’artrite nei topi ne è stata influenzata in modo significativamente positivo [2]. Nel complesso, questo studio si inserisce elegantemente in studi precedenti che hanno dimostrato che nell’AR sono soprattutto i fibroblasti CD90-positivi ad espandersi [1] e che i fibroblasti del rivestimento sono più responsabili dell’invasione e i fibroblasti del sottofondo sono più responsabili della risposta infiammatoria [3]. Questo nuovo studio suggerisce ora che l’attivazione dell’endotelio porta alla mobilitazione di popolazioni locali di fibroblasti nell’AR, che poi mantengono l’infiammazione. In sintesi, la via di segnalazione Notch è interessante in questo caso come potenziale bersaglio terapeutico, da un lato, e il ruolo dell’attivazione endoteliale nella RA, dall’altro, che certamente deve essere ulteriormente studiato in futuro (Fig. 3).
Nuova popolazione di macrofagi nel tessuto sinoviale
Anche la nostra conoscenza delle popolazioni di macrofagi nel tessuto sinoviale è stata notevolmente ampliata nell’ultimo anno. Culeman e colleghi hanno studiato diverse popolazioni di midollofagi nell’articolazione dei topi e il loro comportamento durante lo sviluppo dell’artrite [4]. Tra le altre cose, sono stati trovati macrofagi nel rivestimento sinoviale (CX3CR1+), che sembrano sigillare la sinovia dall’interno dell’articolazione con la loro disposizione e i contatti cellula-cellula. Quando è stata indotta l’artrite nei topi, questa architettura del rivestimento è cambiata. I macrofagi aprono i loro contatti cellula-cellula e ora formano delle palizzate. I fibroblasti di rivestimento, che si trovavano sotto questo strato di macrofagi nell’articolazione sana, ora si sono praticamente schiacciati tra di loro e sono entrati maggiormente in contatto con l’interno dell’articolazione. Questi macrofagi non proliferano per divisione, ma sono probabilmente alimentati da un pool di macrofagi CX3CR1-negativi proliferanti nel rivestimento che si differenziano in questa popolazione CX3CR1-positiva. È importante notare che questo cambiamento morfologico dei macrofagi è stato riscontrato anche nel rivestimento sinoviale dei pazienti con RA, ma non in quelli con OA. Nell’OA, cioè nella sinovia relativamente sana, questi macrofagi sono positivi al TREM2, che è un marcatore di una sottopopolazione midollare antinfiammatoria. Quando questa popolazione di macrofagi è stata impoverita nei topi, la progressione dell’artrite è stata più rapida e più grave. Questa popolazione specializzata di macrofagi sembra quindi avere un’importante funzione di barriera nell’articolazione. (Fig. 3). La stabilizzazione di questa barriera, ad esempio con l’imatinib, che stabilizza le giunzioni strette nella barriera emato-encefalica e che ha avuto un effetto positivo sulla comparsa dell’artrite nei topi in questo studio, potrebbe quindi essere un nuovo approccio terapeutico per i pazienti con RA.
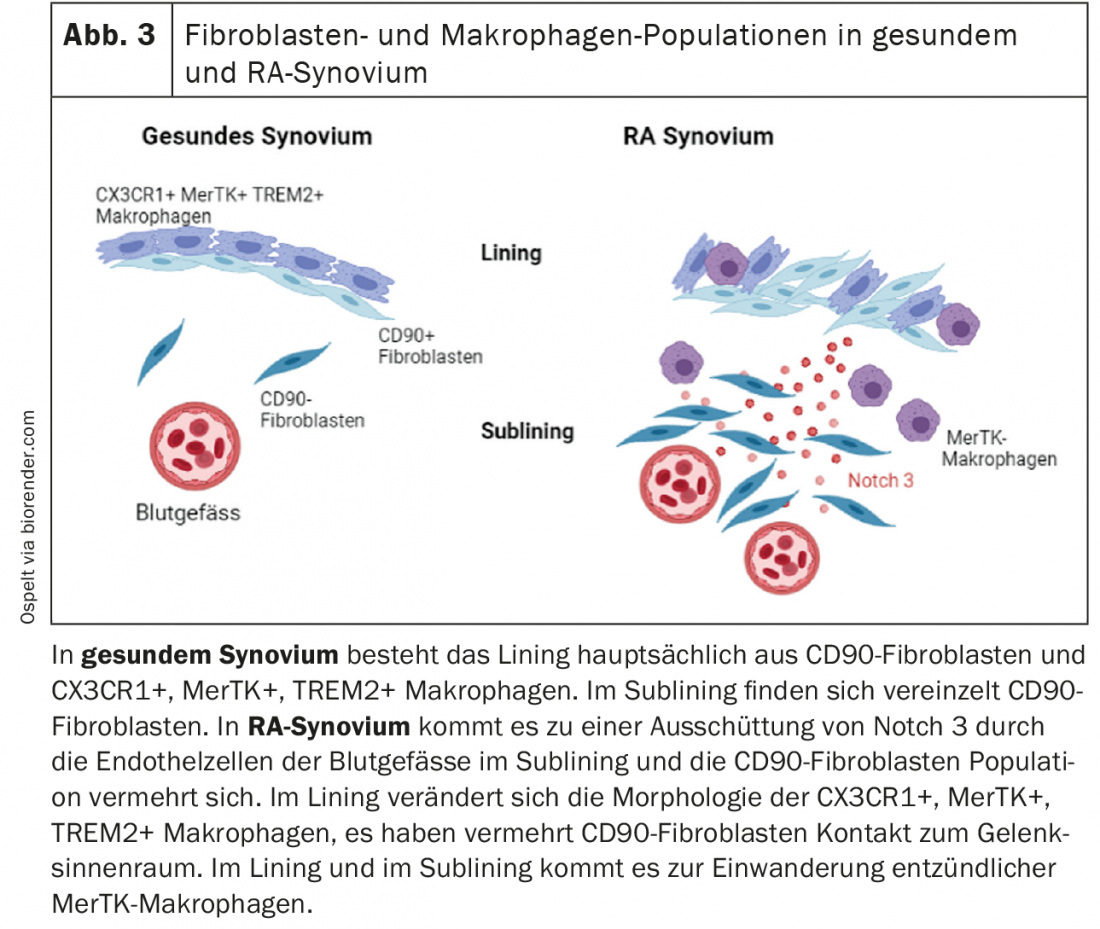
Un altro studio si è concentrato intensamente sulle popolazioni di macrofagi nell’articolazione. In questo caso, il tessuto sinoviale di pazienti con RA in remissione clinica è stato confrontato con quello di pazienti con RA attiva [5]. Anche in questo caso, nel tessuto sinoviale sono state trovate diverse popolazioni di macrofagi. Nei pazienti con RA attiva, sono state trovate in particolare le cosiddette popolazioni di macrofagi MerTK-negativi, che presentavano un profilo di espressione pro-infiammatorio. Nei pazienti RA in remissione, soprattutto i macrofagi MerTK-positivi, che possono esprimere anche TREM2, erano altamente arricchiti. Questi macrofagi MerTK-positivi trovati nel rivestimento sinoviale sono probabilmente i macrofagi barriera TREM2-positivi nel rivestimento già descritti nello studio sopra citato nei topi e nei pazienti con OA. In esperimenti di co-cultura con macrofagi MerTK-positivi e fibroblasti sinoviali, è stato dimostrato che i fibroblasti producono meno fattori pro-infiammatori e distruttivi dell’articolazione grazie alla presenza di questi macrofagi [5]. Al contrario, i fibroblasti sinoviali erano in grado di influenzare l’espressione di questo fenotipo macrofagico antinfiammatorio. Sembra quindi che ci sia una stretta interazione tra fibroblasti e macrofagi nella sinovia, che possono influenzarsi e modellarsi a vicenda nelle diverse fasi dell’AR. In futuro, sarebbe interessante vedere se la presenza di macrofagi MerTK-positivi nella sinovia sia un biomarcatore prognostico per una maggiore possibilità di remissione senza farmaci, e se sia possibile iniziare a ridurre la terapia precocemente in questi pazienti senza rischiare una ricaduta della malattia.
Previsione delle ricadute della malattia nei pazienti con RA
La prognosi delle ricadute nei pazienti con RA è stata oggetto di uno studio pubblicato sul New England Journal of Medicine [6]. In questo caso, è stata prelevata settimanalmente una goccia di sangue dal polpastrello di 4 pazienti per un periodo da 1 a 4 anni e sono state effettuate misurazioni mensili dell’attività della malattia. Il sangue di queste gocce è stato sequenziato per trovare un modello di espressione genica prima o durante un episodio di malattia. Infatti, è stato possibile identificare due gruppi di geni che erano sempre misurabili nel sangue prima di una ricaduta. In base ai geni regolati in questi cluster, è stato possibile ipotizzare che uno di essi provenisse probabilmente dalle cellule immunitarie. L’altro, invece, assomigliava sorprendentemente di più a un profilo noto dei fibroblasti sinoviali. È stato possibile isolare queste “cellule mesenchimali pre-infiammatorie” (PRIME) dal sangue di altri pazienti RA e dimostrare che queste cellule PRIME sono effettivamente la popolazione cellulare che produce la firma genica che stiamo cercando. Questi dati potrebbero quindi significare che prima di una ricaduta, le cellule mesenchimali, ad esempio i fibroblasti sinoviali delle articolazioni, fuoriescono nel sangue e questo processo è foriero della ricaduta o la scatena. Tuttavia, l’origine e il ruolo di queste cellule nell’AR non sono ancora del tutto chiari e saranno certamente affrontati in ulteriori studi futuri.
Nuove intuizioni sullo sviluppo del Lupus Eritematoso Sistemico (LES)
Da tempo si sa che una speciale sottopopolazione di granulociti, chiamata granulociti a bassa densità (LDG), è presente nel sangue dei pazienti con LES e si è ipotizzato che questi giochino un ruolo nello sviluppo della firma interferonica nel LES. In una nuova analisi, si è potuto dimostrare che i monociti da un lato e questi LDG dall’altro sono effettivamente responsabili dell’elevata produzione di geni di risposta all’interferone nei pazienti con LES [7]. Inoltre, lo studio è stato in grado di dimostrare, con l’aiuto di analisi di singole cellule, che questa sottopopolazione LDG può anche essere nuovamente suddivisa e che questi diversi fenotipi sono correlati a diversi parametri clinici. In particolare, sono stati distinti due sottotipi di LDG, quelli che sono CD10-positivi e quelli che sono CD10-negativi. Poiché il CD10 è un marcatore di maturazione per i granulociti neutrofili, le LDG CD10-negative sono probabilmente un precursore immaturo. Questi granulociti neutrofili immaturi non erano in grado di creare trappole nucleari extracellulari (NET) in vitro, mostravano una minore attività chemiotattica e fagocitante rispetto ai granulociti CD10-positivi, ma producevano più mieloperossidasi, indicando una maggiore capacità di degranulazione. Di conseguenza, soprattutto la LDG matura CD10-positiva si è correlata con i parametri clinici, come il danno d’organo e il tasso di filtrazione glomerulare. Ciò suggerisce che le stesse funzioni che le LDG mature CD10-positive svolgono, come la formazione di NET, la chemiotassi e la fagocitosi, giocano un ruolo nella patogenesi di questi sintomi.
Un nuovo approccio per chiarire come questa formazione di NET possa essere innescata nel LES è stato presentato da un gruppo di ricercatori di Bethesda, USA [8]. Questo gruppo è stato in grado di dimostrare che i canali anionici dipendenti dal voltaggio (VDAC) si oligomerizzano e, stabilizzati dal DNA mitocondriale libero, formano un canale nella membrana mitocondriale da cui il DNA mitocondriale può uscire nel citoplasma. Questo DNA mitocondriale ha innescato una risposta interferonica nel citoplasma da un lato e ha portato alla formazione di NET nelle LDG già menzionate sopra dall’altro. Nelle cellule del sangue dei pazienti con LES, questi canali mitocondriali sono stati trovati con un’abbondanza maggiore e in un modello di topo di lupus, il blocco della formazione di questi canali nei mitocondri ha portato a una riduzione del DNA mitocondriale nel citoplasma, a una minore produzione di interferone, a una minore formazione di NET e a un miglioramento dei parametri clinici. La formazione di NET potrebbe anche essere ridotta nei granulociti dei pazienti con LES con questo trattamento. Il blocco di questa proteina canale potrebbe quindi essere un nuovo, promettente approccio nella terapia del LES.
L’analisi delle cellule B fornisce approfondimenti sullo sviluppo delle malattie immuno-mediate
Le nuove tecnologie hanno anche aiutato ad analizzare in dettaglio le cellule B e i loro recettori in diverse malattie immuno-mediate [9]. Cellule B di pazienti con vasculite associata ad ANCA (AAV), LES, Mb. Crohn, Mb. Malattia di Behçet, granulomatosi eosinofila con poliangioite (EGPA, ex sindrome di Churg-Strauss) e vasculite IgA. Lo studio ha esaminato gli isotipi, i geni del locus IGHV, cioè la catena pesante del recettore delle cellule B, e la clonalità del repertorio delle cellule B e ha scoperto alcune cose interessanti. Gli anticorpi IgA erano sovrarappresentati in tutte le malattie studiate, ad eccezione di AAV ed EGPA. Poiché la secrezione di IgA viene stimolata principalmente attraverso il sistema immunitario della mucosa, ad esempio nell’intestino, era prevedibile che nei pazienti con Mb. Nella malattia di Crohn, il contenuto di IgA è elevato. Tuttavia, è stato sorprendente che i livelli di IgA molto elevati siano stati misurati anche nei pazienti con LES. Questo potrebbe anche indicare una stimolazione della mucosa, ad esempio dell’intestino, nel LES. Anche l’analisi dei geni che codificano per la regione variabile della catena pesante dell’immunoglobulina ha rivelato differenze interessanti. L’espressione dei geni IGHV6 e IGHV4 era particolarmente elevata in LES, EGPA e Mb. Il Crohn è aumentato. Questi geni sono stati precedentemente collegati all’autoreattività. L’alta espressione dei geni IGHV1 nelle cellule B dei pazienti con Mb. Behçet, poiché la sovrapproduzione di questi geni è associata principalmente alle infezioni. Questo supporta l’ipotesi che l’infezione possa precedere l’insorgenza della Mb. Behçet potrebbe essere alla base. L’indagine sulla clonalità delle cellule B nelle diverse malattie ha mostrato che nei pazienti con LES e Mb. Crohn, l’espansione dei cloni e la diversità dei cloni di cellule B sono aumentate. Sebbene questo fosse prevedibile, dimostra al contrario che nelle altre malattie, nonostante la forte attivazione del sistema immunitario, la clonalità delle cellule B è normale. Inoltre, questo studio ha anche analizzato i cambiamenti nel repertorio delle cellule B dopo la terapia, dimostrando che i diversi trattamenti immunosoppressivi hanno effetti diversi sul repertorio delle cellule B. Il trattamento con micofenolato mofetile ha determinato un aumento della proporzione di cellule B che producono IgM e IgD e quindi una riduzione del numero di cellule B che hanno subito uno switch isotipico. Al contrario, dopo la terapia con rituximab, il numero di cellule B circolanti è diminuito bruscamente, ma le cellule B persistenti hanno per lo più cambiato il loro isotipo e si sono espanse clonalmente. Nell’AAV, le cellule B che producono IgA sono state trovate prevalentemente dopo il rituximab, nel LES IgG1 o IgG2.
Sommario
In sintesi, si può dire che soprattutto i più recenti metodi analitici su base monocellulare hanno portato a nuovi approfondimenti sulla funzione di alcuni sottotipi cellulari nei tessuti sani e malati. Possiamo quindi differenziare i processi patologici nelle varie malattie reumatiche in modo sempre più preciso, il che, si spera, porterà anche a nuove terapie per le singole malattie in futuro. In particolare, in reumatologia, il passo dalla ricerca di base ai nuovi metodi di trattamento è già stato compiuto con successo molte volte.
Messaggi da portare a casa
- Le biopsie sinoviali guidate dagli ultrasuoni e le analisi di singole cellule sono diventate una parte importante della ricerca traslazionale.
- L’inibizione farmacologica di Notch e la stabilizzazione delle giunzioni strette dei macrofagi nel rivestimento sinoviale sono nuovi bersagli terapeutici per l’AR.
- La formazione di NET e la produzione di geni dell’interferone nel LES da parte di un sottotipo specifico di granulociti neutrofili è correlata ai sintomi clinici.
- L’inibizione della formazione dei canali della membrana mitocondriale è un nuovo bersaglio terapeutico nel LES.
Letteratura:
- Zhang F, et al: Definizione degli stati cellulari infiammatori nei tessuti sinoviali delle articolazioni dell’artrite reumatoide, integrando la trascrittomica a singola cellula e la citometria di massa. Nat Immunol 2019; 20: 928-942.
- Wei K, et al: La segnalazione di Notch guida l’identità dei fibroblasti sinoviali e la patologia dell’artrite. Natura 2020; 582: 259-264.
- Croft AP, et al: Sottoinsiemi distinti di fibroblasti guidano l’infiammazione e il danno nell’artrite. Natura 2019; 570: 246-251.
- Culemann S, et al: I macrofagi sinoviali residenti che si rinnovano localmente forniscono una barriera protettiva per l’articolazione. Natura 2019; 572: 670-675.
- Alivernini S, et al: Sottoinsiemi distinti di macrofagi del tessuto sinoviale regolano l’infiammazione e la remissione nell’artrite reumatoide. Nat Med 2020; 26: 1295-1306.
- Orange DE, et al: Identificazione di tre sottotipi di malattia dell’artrite reumatoide mediante l’integrazione di apprendimento automatico delle caratteristiche istologiche della sinovia e dei dati di sequenziamento dell’RNA. Arthritis Rheumatol 2018; 70: 690-701.
- Mistry P, et al: Le analisi trascrittomiche, epigenetiche e funzionali implicano la diversità dei neutrofili nella patogenesi del lupus eritematoso sistemico. Proc Natl Acad Sci USA 2019; 116: 25222-25228.
- Kim J, et al: Gli oligomeri VDAC formano pori mitocondriali per rilasciare frammenti di mtDNA e promuovere una malattia simile al lupus. Science 2019; 366: 1531-1536.
- Bashford-Rogers RJM, et al: Analisi del repertorio di cellule B in sei malattie immuno-mediate. Natura 2019; 574: 122-126.
InFo PAIN & GERIATURE 2021; 3(1): 6-9