Il tumore ovarico viene solitamente diagnosticato in fase avanzata e ha una prognosi sfavorevole. La chirurgia citoriduttiva massima possibile è terapeuticamente e prognosticamente al primo posto, seguita dalla chemioterapia contenente platino. Negli stadi III-IV senza reintervento pianificato, l’aggiunta di bevacizumab alla prima chemioterapia e come terapia di mantenimento è stata approvata da diversi mesi. Lo stesso vale per la terapia delle recidive sensibili al platino. L’ultima indicazione approvata è bevacizumab per il carcinoma ovarico resistente al platino dopo un massimo di due terapie precedenti con monochemioterapia. Le donne con tumore ovarico geneticamente indotto sono trattate allo stesso modo delle pazienti con tumori sporadici, ma ora hanno l’opzione di una terapia di mantenimento con olaparib nella situazione di recidiva.
Il carcinoma ovarico è il secondo carcinoma più comune in ambito ginecologico ed è la causa più frequente di morte tra questi tumori. In Svizzera, colpisce circa 600 donne all’anno (3% di tutti i tumori). L’età media alla diagnosi è di 63 anni, il 14% delle donne ha meno di 50 anni. Il 90% dei carcinomi ovarici sono tumori di origine epiteliale, gli altri sono tumori delle cellule germinali, dello stroma o sarcomatosi o neoplasie a piccole cellule. L’OMS divide i carcinomi epiteliali in sei classi istologiche. I carcinomi sierosi sono i più comuni (circa l’80%), possono essere da poco a molto aggressivi.
Diagnosi e fattori di rischio
I sintomi che spesso precedono la diagnosi sono aspecifici: dolore addominale, tensione addominale, problemi di minzione e, nel corso del tempo, aumento della circonferenza addominale o irregolarità mestruali. I fattori di rischio sono il numero di ovulazioni (maggiore è il numero di ovulazioni, più alto è il rischio), l’endometriosi, le ovaie policistiche e il gene BRCA 1 o 2. Al contrario, le nascite, l’allattamento, la contraccezione orale, la legatura delle tube e l’isterectomia riducono il rischio.
La diagnosi di solito avviene in uno stadio avanzato (FIGO III e IV), il che significa che solo il 15% circa dei carcinomi ovarici è confinato a una sola ovaia. I fattori rilevanti per la prognosi sono lo stadio, l’istologia e un intervento il più completo possibile. Purtroppo, la prognosi del carcinoma ovarico come gruppo rimane scarsa: solo il 40% circa delle pazienti con stadio FIGO III (metastasi al di fuori della pelvi ma intra-addominali) e solo il 19% circa con stadio FIGO IV (metastasi a distanza) sopravvive a cinque anni, con questi dati che provengono da prima delle moderne opzioni terapeutiche (bevacizumab +/- terapia di mantenimento, olaparib, HIPEC).
Chiarimenti e terapia chirurgica
Senza una stadiazione chirurgica o un intervento chirurgico, non è possibile determinare in modo affidabile l’esatta estensione della malattia. Le donne di solito consultano prima il loro ginecologo, che utilizza l’ecografia vaginale per fare una diagnosi (Fig. 1) .
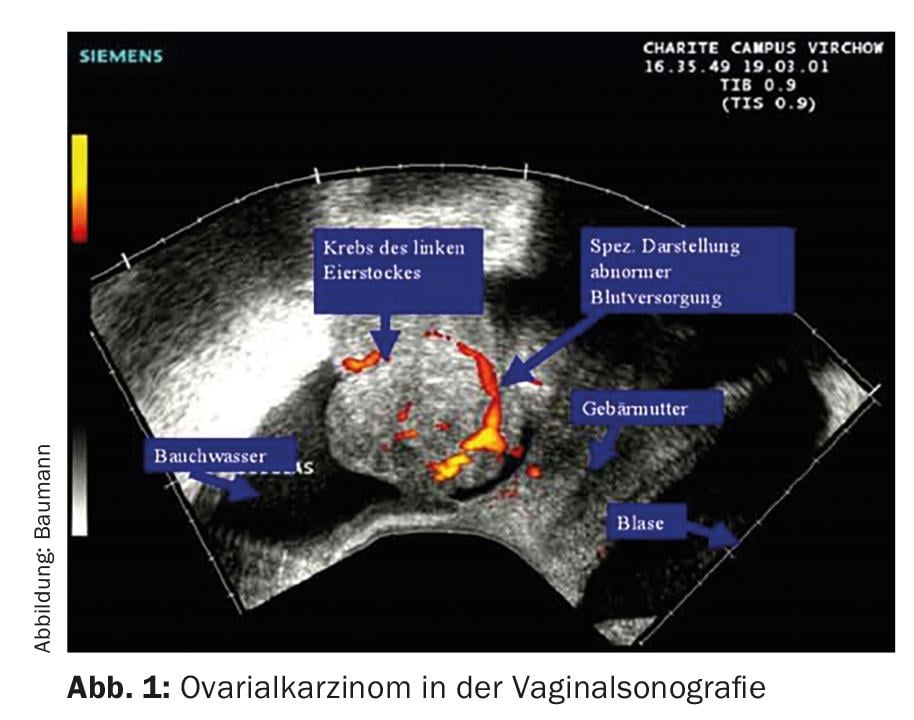
Se si sospetta un carcinoma, seguirà una tomografia computerizzata o una PET-CT (fig. 2) . Anche la determinazione del marcatore tumorale Ca 125 può essere utile.
L’intervento comprende un’isterectomia, un’annessectomia bilaterale, una linfoadenectomia retroperitoneale e, a seconda dell’estensione del tumore, anche un’omentectomia infracolica e infragastrica, oltre a biopsie peritoneali multiple e mirate. L’esperienza del chirurgo (numero di interventi eseguiti annualmente) è importante, poiché la prognosi è influenzata dal risultato chirurgico ottenuto (debulking ottimale). Quando è possibile, tutti i tumori macroscopicamente visibili devono essere rimossi, vale a dire che l’operazione richiede ginecologi esperti e possibilmente anche chirurghi viscerali in grado di eseguire le procedure addominali talvolta più grandi, come le asportazioni parziali dell’intestino, le peritonectomie, ecc. La terapia del carcinoma ovarico avanzato dovrebbe essere discussa già prima dell’intervento in modo interdisciplinare e dovrebbero essere discussi anche i possibili interventi o trattamenti. Le loro conseguenze/morbosità devono essere discusse in anticipo con i pazienti. La stadiazione postoperatoria è secondo FIGO o TNM [1].
Terapia degli stadi iniziali (FIGO I-IIA)
Negli ultimi anni non è cambiato nulla nel trattamento dei primi stadi. I pazienti in questi stadi (circa il 20%) hanno una prognosi migliore (sopravvivenza a 5 anni 60-90%). Fattori come il grado, la rottura capsulare, l’interessamento unilaterale o bilaterale e l’età del paziente, se presente, sono importanti per decidere se è necessario somministrare una terapia adiuvante. Non è raccomandata alcuna chemioterapia per i pazienti con stadio FIGO IA, G1. Nello stadio IB, i fattori aggiuntivi e la stadiazione chirurgica ottimale sono importanti; anche in questo caso, la chemioterapia può spesso essere omessa.
Tutte le altre pazienti in stadio precoce (tutti gli stadi FIGO II e/o tutti i gradi istologici superiori a 1) beneficiano della chemioterapia adiuvante a base di platino. Non voglio addentrarmi nella discussione se il carboplatino da solo sia sufficiente (sei cicli) o se sia preferibile la combinazione di carboplatino e paclitaxel (tre cicli possono essere sufficienti, ma di solito ne vengono somministrati sei) [2,3].
Terapia degli stadi avanzati (FIGO IIB-IV)
Negli stadi avanzati, è particolarmente importante un intervento chirurgico il più completo possibile. I pazienti in cui non è visibile alcun tumore a livello macroscopico hanno la prognosi migliore. Se il tumore deve rimanere, le donne con residui tumorali di dimensioni inferiori a 1 cm hanno maggiori possibilità rispetto alle donne con residui tumorali superiori a 1 cm. Nei pazienti con un’operazione principalmente subottimale (ad esempio, senza team interdisciplinare – anche se necessario), può essere utile il cosiddetto debulking di intervallo. In questo contesto, vengono somministrati prima tre cicli di chemioterapia standard con carboplatino e paclitaxel, seguiti da un secondo intervento chirurgico e da altri tre cicli di chemioterapia se c’è una risposta.
Tutti i pazienti con stadi avanzati sono stati trattati finora con sei cicli di chemioterapia combinata contenente platino (per lo più con paclitaxel). L’aggiunta di altri farmaci citostatici o l’esecuzione di più di sei cicli non ha mostrato alcun beneficio.
Nel 2009, un gruppo giapponese ha pubblicato un lavoro con “paclitaxel/carboplatino ad alta densità di dose”, che ha mostrato una migliore sopravvivenza globale del 72% dopo tre anni, rispetto al 65% del gruppo di pazienti con terapia standard [4]. “Dose densa” significa che il paclitaxel viene somministrato settimanalmente senza interruzione, mentre il carboplatino continua ad essere somministrato ogni tre settimane. Gli effetti collaterali (soprattutto ematologici) si sono verificati un po’ più frequentemente nel gruppo di pazienti trattati in questo modo. Tuttavia, esistono anche schemi per l’applicazione settimanale di entrambe le sostanze [5].
Terapia con bevacizumab
Un’opzione terapeutica più recente è l’aggiunta di bevacizumab alla chemioterapia. Bevacizumab inibisce tutte le isoforme del recettore VEGF-A. Attualmente esistono quattro grandi studi che dimostrano l’efficacia dell’inibizione dell’angiogenesi nel carcinoma ovarico (GOG 0218 e ICON7 in prima linea, OCEANS e AURELIA per le recidive). Comune a tutti gli studi è il miglioramento di 3,5-4 mesi della sopravvivenza libera da progressione (PFS) e del tasso di risposta, ma non della sopravvivenza globale. Gli studi differiscono non solo per l’indicazione e il disegno, ma anche per il dosaggio di bevacizumab e la durata della terapia. L’inibizione dell’angiogenesi viene utilizzata in questi studi non solo in parallelo alla chemioterapia, ma soprattutto come terapia di mantenimento. Bevacizumab è la prima terapia di mantenimento a mostrare un beneficio.
Bevacizumab è approvato in Svizzera per le pazienti con carcinoma ovarico avanzato (FIGO III-IV) in combinazione con carboplatino/paclitaxel come terapia iniziale, se non è previsto un secondo intervento o trattamento. è previsto un debulking a intervalli. I pazienti ricevono bevacizumab 7,5 mg/kgKG ogni tre settimane in parallelo a sei cicli di chemioterapia; successivamente, bevacizumab viene somministrato come terapia di mantenimento ogni tre settimane fino a progressione o morte. per un massimo di 15 mesi. Lo spettro degli effetti collaterali del bevacizumab è noto da altre terapie tumorali: vanno menzionati l’ipertensione arteriosa, la proteinuria, raramente il tromboembolismo e soprattutto un tasso leggermente aumentato di perforazione intestinale – oltre all’aumento significativo dei costi della terapia.
Chemioterapia intraperitoneale
Già negli anni ’70 si è cercato di aumentare le possibilità di sopravvivenza dei pazienti preoperati in modo ottimale con alte dosi locali di chemioterapia (intraperitoneale). Questo processo molto complesso e lungo è stato continuamente migliorato nel corso degli anni. La chemioterapia intraperitoneale viene sempre somministrata in parallelo alla chemioterapia endovenosa. Le sostanze nella parte di terapia endovenosa sono state parzialmente scambiate e la chemioterapia intraperitoneale con cisplatino e paclitaxel viene effettuata riscaldata (chemioterapia intraperitoneale ipertermica, HIPEC). Come in precedenza, la tossicità e le complicanze sono notevoli, per cui questa terapia non è uno standard nonostante il vantaggio di sopravvivenza dimostrato in singoli studi, ma viene sempre più utilizzata nei centri più grandi [6]. Recentemente è stata pubblicata una revisione dell’uso e dei benefici della chemioterapia intraperitoneale in sei grandi centri negli Stati Uniti [7]. Nel corso del tempo (2007-2012), l’HIPEC è stata sempre più utilizzata, ma secondo gli autori, questa procedura è ancora utilizzata in meno del 50% dei pazienti idonei. La sopravvivenza complessiva dopo tre anni è stata dell’81% nel braccio HIPEC e del 71% nel braccio standard.
Terapie ricorrenti
Poiché la maggior parte delle pazienti con carcinoma ovarico avanzato subisce una recidiva, si pone la questione della terapia ottimale per la recidiva. Per i pazienti con un lungo intervallo libero da terapia, in buone condizioni generali e con una recidiva che può essere rimossa macroscopicamente in toto, un secondo intervento è un’opzione, anche se la situazione dello studio in questo caso non è molto buona. In casi eccezionali, in questa situazione si valuta anche l’HIPEC.
La decisione principale è se il carcinoma è sensibile al platino (recidiva solo dopo sei, preferibilmente dodici mesi) o resistente. Per i carcinomi sensibili, si può riutilizzare la doppietta carboplatino (meglio tollerato, altrettanto efficace del cisplatino) e paclitaxel o, in alternativa, carboplatino/pegilato doxorubicina liposomiale o carboplatino/gemcitabina. Anche in questo caso, la terapia combinata è più efficace della monoterapia [4]. Per la malattia refrattaria al platino (recidiva prima di sei mesi), si devono utilizzare farmaci non cross-resistenti: Gemcitabina, etoposide orale, vinorelbina o anche docetaxel e oxaliplatino. Esistono anche dati sulla trabectedina in combinazione con Caelyx® [8].
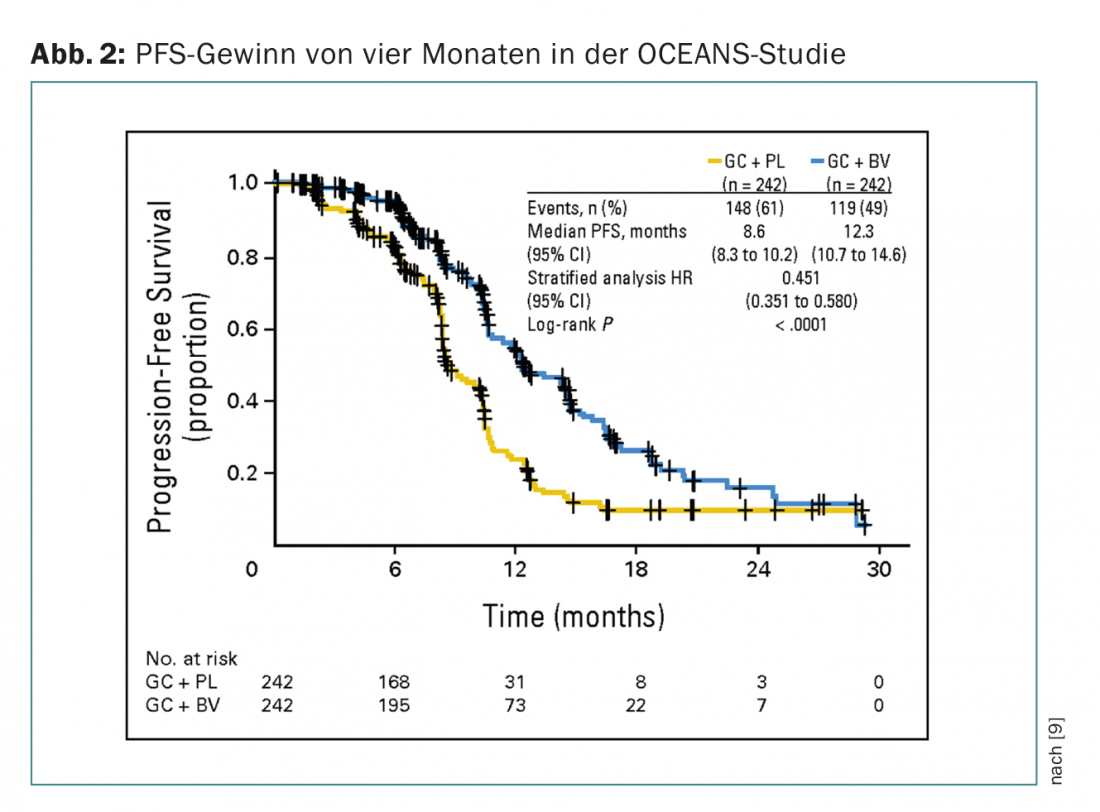
Nelle situazioni di recidiva, anche l’aggiunta di bevacizumab (anche come terapia di mantenimento) ha mostrato un beneficio in termini di PFS in misura simile. Le pazienti con carcinoma ovarico sensibile al platino sono state incluse nello studio OCEANS (fase III, guadagno PFS di quattro mesi) (Fig. 2) [9]. La chemioterapia in entrambi i bracci consisteva in carboplatino/gemcitabina. Bevacizumab è stato utilizzato nel braccio sperimentale a 15 mg/kgKG ogni tre settimane fino alla progressione. I pazienti non potevano essere pre-trattati (eccetto quelli adiuvanti) e non era ammessa una precedente terapia anti-VEGF. In Svizzera, bevacizumab è approvato anche in questa situazione, ma è necessario ottenere un’approvazione dei costi (che si applica a tutte le indicazioni di bevacizumab).
L’indicazione più recente per bevacizumab nel carcinoma ovarico è il carcinoma resistente al platino (AURELIA) con non più di due terapie precedenti senza precedenti inibitori dell’angiogenesi. Il trattamento viene somministrato insieme a topotecan, paclitaxel o Caelyx®. Il dosaggio è di 10 mg/kgKG ogni 14 giorni fino alla progressione della malattia. Anche il guadagno in termini di PFS è di 3,5 mesi, che può essere considerato significativo in questa situazione, in cui i pazienti sopravvivono altrimenti meno di 12 mesi. AURELIA ha inoltre dimostrato un miglioramento della qualità di vita. Tuttavia, ci sono alcune avvertenze da menzionare in questo studio, in particolare il disegno open-label con possibilità di cross-over.
Che l’inibizione dell’angiogenesi abbia un ruolo nel cancro ovarico (anche nella genesi dell’ascite) è noto da tempo. Ora possiamo anche utilizzare questo principio terapeutico. Tuttavia, il momento più ottimale non è ancora chiaro (forse più volte?), e i costi non possono essere trascurati nella situazione attuale [10].
Terapia per i portatori dei geni BRCA 1 e 2
Circa il 10-15% dei tumori ovarici sono familiari, con i due geni BRCA che sono i più importanti. Il rischio di cancro ovarico nel corso della vita per un portatore di BRCA 1 è del 25-55%, per un portatore di BRCA 2 del 10-25%. Dopo aver completato la pianificazione familiare, l’annessiectomia bilaterale profilattica dovrebbe essere discussa con queste pazienti (oltre ad altre opzioni preventive).
La terapia di questi carcinomi ovarici non è ancora diversa da quella dei carcinomi sporadici, né la prognosi è peggiore [11]. La terapia di mantenimento con olaparib deve essere menzionata come un’innovazione.
Fino al 50% dei carcinomi sierosi di alto grado presenta un difetto nella ricombinazione omologa (nella linea germinale come nei portatori di BRCA o a livello somatico nelle cellule tumorali), un percorso importante per correggere il danno al DNA. Gli enzimi PARP (polimerasi) sono responsabili della riparazione delle rotture del DNA a singolo filamento. Nelle cellule sane, queste vengono ricombinate in modo omologo. Tuttavia, questo non è possibile senza un gene BRCA funzionante. Gli inibitori della PARP portano all’instabilità cellulare e alla morte cellulare (“letalità sintetica”). Le cellule tumorali sono particolarmente sensibili a questo meccanismo.
Uno studio di fase II ha dimostrato che la terapia di mantenimento con l’inibitore orale di PARP olaparib fornisce un beneficio in termini di PFS nelle donne con carcinoma ovarico sieroso di alto grado, pretrattato (almeno due terapie, sensibile al platino, rispondente all’ultima terapia) [12]. Il guadagno in termini di PFS è stato dimostrato soprattutto nei pazienti con malattia BRCA-positiva (germinale o tumorale) ed era ancora di sette mesi in questo gruppo (HR 0,35). Non è ancora stato dimostrato un beneficio in termini di OS. Olaparib non è ancora ufficialmente approvato in Svizzera, ma le pazienti BRCA-positive possono essere arruolate in un programma speciale tramite l’azienda. Gli effetti collaterali sono accettabili (principalmente affaticamento, gastrointestinali, ematologici) e raramente di grado 3 e 4.
Al congresso ASCO di quest’anno, sono stati presentati anche i primi dati clinici sugli inibitori del checkpoint immunitario con anticorpi anti-PD-1 e anti-PDL-1. Queste “immunoterapie” – per dirla in modo semplice – liberano i freni del sistema immunitario dell’organismo contro le cellule tumorali, e sono già utilizzate con buon successo per il melanoma e il carcinoma del bronco. Gli inibitori del checkpoint immunitario sembrano avere un effetto anche nel cancro ovarico, in particolare nei tumori indotti da mutazioni BRCA.
Si spera che la prognosi delle pazienti con tumore ovarico avanzato migliori presto con le nuove opzioni terapeutiche.
Letteratura:
- Manuale di stadiazione del cancro, Manuale di stadiazione AJCC7a edizione 2010.
- Sandercock J, et al: Trattamento di prima linea per il carcinoma ovarico avanzato: paclitaxel, platino e le prove. British Journal of Cancer 2002; 87: 815-824.
- L’International Collaborative Ovarian Neoplasm Group: Paclitaxel più carboplatino rispetto alla chemioterapia standard con carboplatino a singolo agente o ciclofosfamide, doxorubicina e cisplatino nelle donne con cancro ovarico: lo studio randomizzato ICON3. Lancet 2002; 360: 505-515.
- Katsumata N, et al: Dose densa di paclitaxel una volta alla settimana in combinazione con carboplatino ogni 3 settimane per il carcinoma ovarico avanzato: uno studio di fase 3, in aperto, randomizzato e controllato. Lancet 2009; 374: 1331-1338.
- Sehouli J, et al: Paclitaxel e carboplatino settimanali per le pazienti con carcinoma ovarico avanzato: risultati di uno studio multicentrico di fase II del NOGGO. Cancer Chemother Pharmacol 2008; 61: 243-250.
- Armstrong DK, et al: Cisplatino e paclitaxel intraperitoneali nel cancro ovarico. N Engl J Med 2006; 354: 34-43.
- Wright AA, et al: Uso ed efficacia della chemioterapia intraperitoneale per il trattamento del cancro ovarico. J Clin Oncol 2015; 33: 2841-2847.
- Poveda A, et al: Trabectedina più doxorubicina liposomiale pegilata nel carcinoma ovarico recidivato: esiti nella sottopopolazione parzialmente sensibile al platino (intervallo libero da platino 6-12 mesi) dello studio randomizzato di fase III OVA-301. Ann Oncol 2011; 22(1): 39-48. doi.1093/annonc/mdq352.
- Aghajanian C, et al: OCEANS: studio di fase III, randomizzato, in doppio cieco, controllato con placebo, sulla chemioterapia con o senza bevacizumab nelle pazienti con cancro ovarico epiteliale ricorrente sensibile al platino, peritoneale primario o delle tube di Falloppio. J Clin Oncol 2012; 30(17): 2039-2045.
- Liu JF, et al: Ruolo emergente del bevacizumab in combinazione con la chemioterapia per le pazienti con cancro ovarico resistente al platino. J Clin Oncol 2014; 32: 1287-1289.
- Rubin SC, et al: Caratteristiche cliniche e patologiche del cancro ovarico nelle donne con mutazioni germinali di BRCA1. N Engl J Med 1996; 335: 1413-1416.
- Ledermann J, et al: Terapia di mantenimento con Olaparib nel carcinoma ovarico recidivato sensibile al platino. N Engl J Med 2012; 366: 1382-1392.
InFo ONCOLOGIA ED EMATOLOGIA 2016; 4(2): 25-28











