La prognosi dell’amiloidosi a catena leggera (AL), una discrasia plasmacellulare, è in gran parte determinata dalla presenza di un coinvolgimento cardiaco. La stadiazione convenzionale si basa sui biomarcatori cardiaci e sulla differenza delle catene leggere libere. Un nuovo studio ha cercato di valutare il ruolo dei parametri ecocardiografici come marcatori prognostici nell’amiloidosi AL e di indagare la loro utilità rispetto alla stadiazione convenzionale.
L’amiloidosi cardiaca è l’archetipo della cardiomiopatia infiltrativa e spesso si presenta con il fenotipo clinico dell’insufficienza cardiaca con frazione di eiezione conservata. L’amiloidosi sistemica a catene leggere (amiloidosi AL) è una discrasia plasmacellulare con coinvolgimento multisistemico; tuttavia, la prognosi dell’amiloidosi AL è spesso legata al coinvolgimento cardiaco. Questo si riflette nell’uso del “punteggio Mayo” nella stadiazione dell’amiloidosi AL. Questo punteggio comprende i biomarcatori cardiaci troponina ad alta sensibilità (hs-Trop) e peptide natriuretico pro-cerebrale N-terminale (NT-proBNP), nonché la differenza di catene leggere libere (dFLC) [2].
Sebbene i punteggi Mayo originali e rivisti per la classificazione dell’amiloidosi AL abbiano dimostrato la loro utilità prognostica, ci sono dei limiti nell’uso di questi biomarcatori. Le differenze tra i test della troponina utilizzati nei diversi centri, ad esempio hs-TropI e hs-TropT, ognuno dei quali ha i propri intervalli definiti, rendono difficili i confronti nel tempo. Anche i test per l’NT-proBNP sono cambiati nel tempo, con implicazioni simili a quelle della troponina. Inoltre, sia la troponina che l’NT-proBNP sono influenzati da fattori come l’indice di massa corporea e l’insufficienza renale coesistente, quest’ultima relativamente comune nell’amiloidosi AL sistemica.
Al contrario, i tradizionali marcatori ecocardiografici della struttura e della funzione cardiaca sono standardizzati e hanno intervalli normali universalmente definiti. Inoltre, l’ecocardiogramma transtoracico (TTE) viene eseguito di routine nei pazienti con amiloidosi AL per valutare il coinvolgimento cardiaco, poiché è poco costoso e ampiamente disponibile. Nuovi indici ecocardiografici come la deformazione longitudinale globale del ventricolo sinistro (LVGLS) sono stati convalidati per un’ampia gamma di processi patologici e sono sempre più utilizzati nella valutazione clinica dell’amiloidosi AL [3]. Uno studio recente ha quindi analizzato l’utilità prognostica dei parametri ecocardiografici rispetto alla stadiazione di Mayo nei pazienti con amiloidosi AL [1].
Caratteristiche del paziente e parametri ecocardiografici
Sono stati identificati retrospettivamente 75 pazienti consecutivi con amiloidosi AL, valutati presso una clinica amiloidea di riferimento e sottoposti a un esame ecocardiografico completo. L’età media era di 61,8 ± 10 anni e 51/75 pazienti erano maschi. 71 dei 75 pazienti hanno ricevuto la chemioterapia, la maggior parte con bortezomib (Velcade), ciclofosfamide e desametasone (VCD; 30/75); 11 pazienti sono stati sottoposti a trapianto di cellule staminali allogeniche. 25 pazienti sono stati classificati come stadio Mayo I, 22 come stadio II, mentre gli stadi III e IV comprendevano 15 e 13 pazienti, rispettivamente.
I parametri ecocardiografici studiati includevano la frazione di eiezione ventricolare sinistra, la massa, i parametri di funzione diastolica, la deformazione longitudinale globale (GLS) e il volume atriale sinistro (LA). La mortalità è stata determinata attraverso una revisione delle cartelle cliniche. Durante un follow-up mediano di 51 mesi, 29/75 (39%) pazienti sono morti. I pazienti sono stati divisi in due sottogruppi in base alla mortalità, che non differivano per età, sesso o indice di massa corporea, anche se la pressione arteriosa sistolica ha raggiunto una significatività statistica (p=0,051). 11 pazienti hanno avuto una fibrillazione atriale; il tasso di fibrillazione atriale era simile nei due gruppi: 6/46 (13%) nei sopravvissuti contro 5/29 (17%) nei non sopravvissuti (p=0,617). I pazienti che sono morti avevano un volume LA significativamente maggiore (35 ± 10 vs. 47 ± 12 mL/m2, p<0,001) e un E/e’ più alto (14 ± 6 vs. 18 ± 10, p=0,026); sia la massa LV che il LVGLS si sono avvicinati alla significatività statistica. Non ci sono state differenze tra i gruppi nella funzione sistolica LV valutata dalla LVEF. Come previsto, la mortalità è aumentata con l’aumentare dello stadio Mayo ed è stata dell’8, 45, 60 e 62%, rispettivamente, per i pazienti negli stadi Mayo I-IV.
Stadio di Mayo e predittori ecocardiografici univariati di sopravvivenza
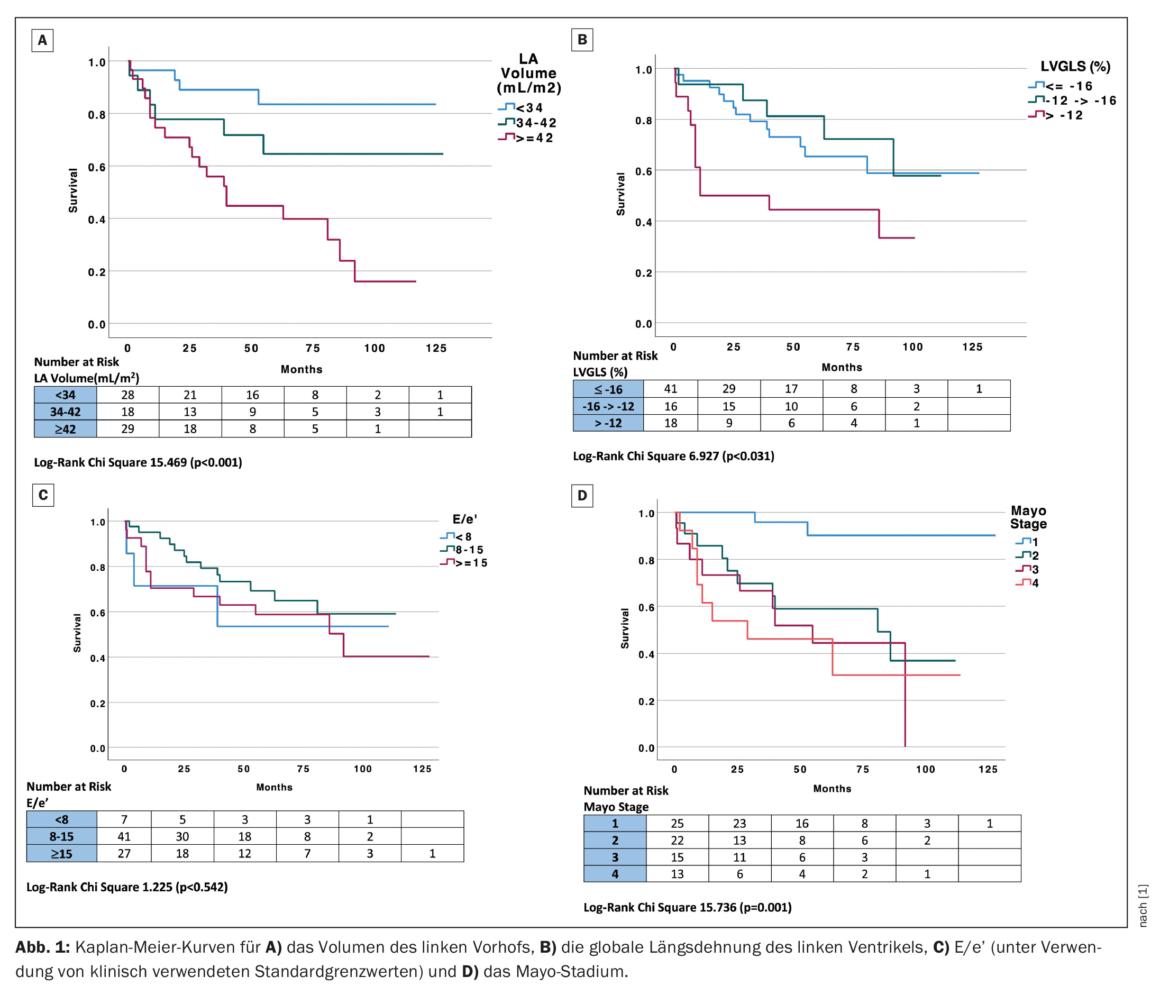
L’analisi univariata ha mostrato che i parametri ecocardiografici che prevedevano la mortalità con una significatività di p<0,1 includevano LAVI, velocità e’, E/e’ e LVGLS. Anche lo stadio di Mayo era un predittore indipendente di sopravvivenza. I predittori ecocardiografici univariati di mortalità (significatività di p<0,1) sono stati inseriti in un modello multivariabile di Cox a rischi proporzionali e hanno incluso E/e’ e volume LA e LVGLS (la velocità e’ non è stata inclusa nel modello a causa della collinearità con E/e’). In questo modello multivariabile di parametri ecocardiografici, il LAVI era l’unico predittore ecocardiografico indipendente di mortalità. Il volume atriale sinistro indicizzato era correlato con lo stadio Mayo (coefficiente di correlazione di Spearman 0,5, p<0,001), e tutti i pazienti negli stadi Mayo III e IV presentavano atrii sinistri dilatati (LAVI ≥34 mL/m2).
Classificazione dei pazienti in tre diversi gruppi di rischio
LVGLS (funzione sistolica ventricolare sinistra), LAVI ed E/e’ (funzione diastolica) sono stati analizzati come variabili categoriche utilizzando valori cut-off clinicamente applicabili per valutare il loro impatto sulla mortalità rispetto allo stadio Mayo. La deformazione longitudinale globale del ventricolo sinistro è stata suddivisa in tre gruppi in base al cut-off clinico precedentemente riportato di migliore di -16, da -12 a -16% e peggiore di -12% per GLS normale, ridotto e gravemente ridotto, rispettivamente [4]. Il volume atriale sinistro indicizzato è stato suddiviso in tre gruppi utilizzando un cut-off clinico di ≤34, 34-42 e ≥42 mL/m2, corrispondenti a dilatazione LAVI normale, da lieve a moderata o superiore a moderata [5]. ‘E/e’ è stato classificato in tre gruppi in base ai valori clinici di <8, 8-15 e ≥15, corrispondenti a pressione di riempimento LV normale, probabilmente anormale ed elevata [6]. La stratificazione per gruppo clinico di LAVI (p<0,001), LVGLS (p=0,031) e stadio Mayo (p=0,001) sono stati predittori significativi di mortalità, mentre E/e’ non ha raggiunto la significatività nell’analisi di Kaplan-Meier (Fig. 1) [1]. Da notare che i pazienti con un LAVI normale <34 mL/m2 hanno avuto esiti particolarmente buoni a lungo termine (follow-up mediano 60,5 ± 46 mesi) e, al contrario, i pazienti con un LVGLS inferiore a -12% hanno avuto un esito negativo.
Sistema di punteggio per la dilatazione atriale sinistra e la riduzione della deformazione longitudinale globale del ventricolo sinistro
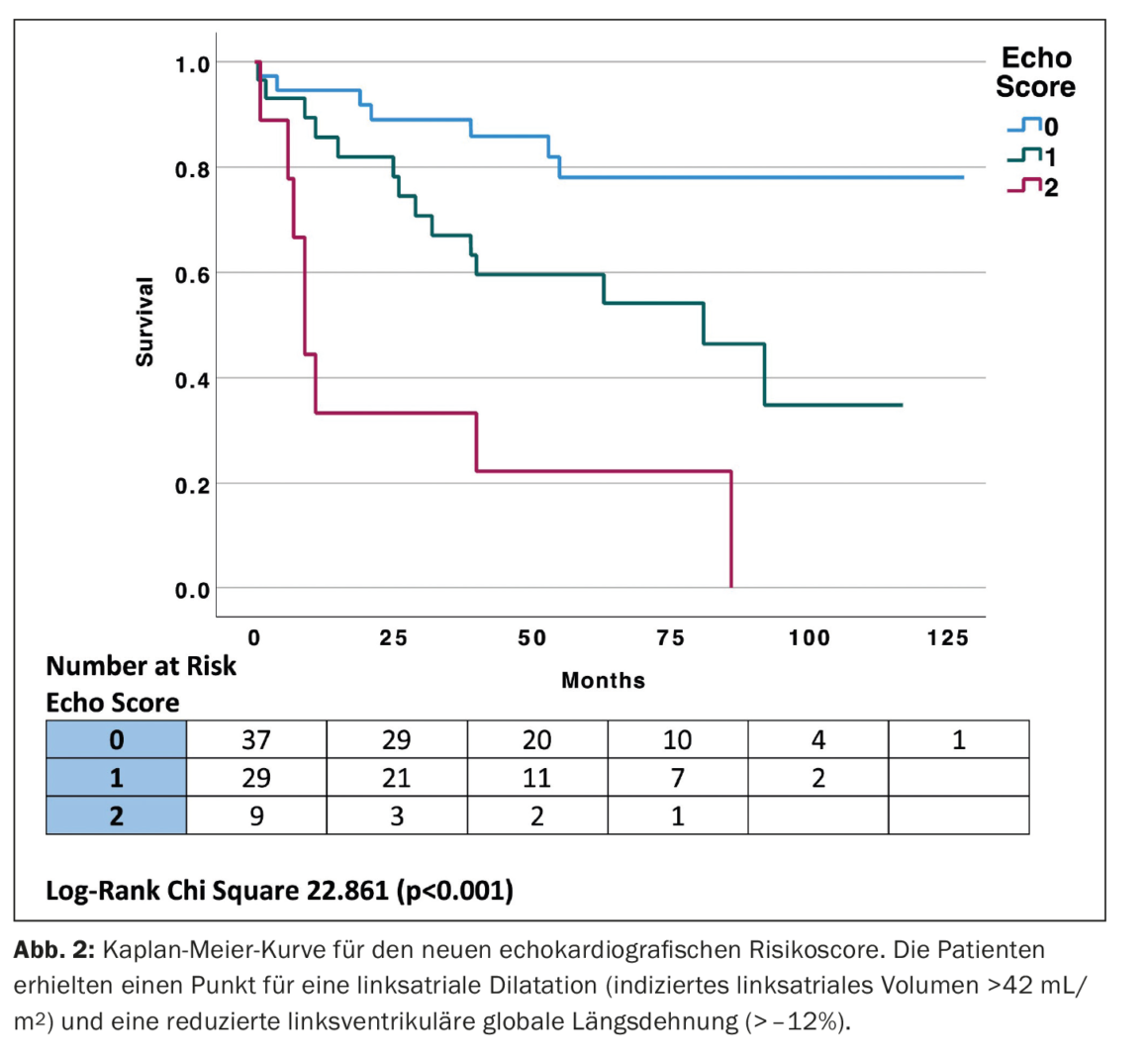
Utilizzando i valori clinici di cut-off per LVGLS e LAVI per generare un semplice punteggio ecocardiografico, il gruppo a più alto rischio ha mostrato sia LVGLS (peggiore di -12%) che LAVI (>42 mL/m2), il gruppo a rischio intermedio aveva LVGLS da -12 a -16% e LAVI 34-42 mL/m2, e il gruppo a rischio più basso aveva LVGLS migliore di -16% e LAVI <34 mL/m2. È stato poi generato un punteggio di rischio assegnando un punto ciascuno per LVGLS peggiore di -12% e LAVI >34 mL/m2, collocando i pazienti in uno dei tre gruppi. Il gruppo a più alto rischio aveva sia LVGLS (peggiore di -12%) che LAVI (>42 mL/m2), il gruppo a rischio intermedio aveva o LVGLS peggiore di -12% o LAVI >42 mL/m2 e il gruppo a rischio più basso aveva un LVGLS migliore di -12% e LAVI <42 mL/m2 con due, uno e zero punti rispettivamente. Sono state create curve Kaplan-Meier per il nuovo punteggio di rischio ecocardiografico (Echo Score) (Fig. 2) [1]. Il nuovo “punteggio eco” aveva prestazioni prognostiche simili allo stadio Mayo [AUC 0,745, intervallo di confidenza (CI) al 95% 0,638-0,853 vs AUC 0,752, CI al 95% 0,645-0,858, p=0,911].
La previsione della mortalità per tutte le cause è paragonabile al sistema di stadiazione Mayo esistente.
La variabilità intra- e interosservatore della LAVI è stata eccellente con un coefficiente di correlazione intraclasse di 0,987 (95% CI 0,946-0,997), mentre il coefficiente di correlazione interosservatore è stato di 0,935 (95% CI 0,731-0,984). Il LVGLS era anche altamente riproducibile con un coefficiente di correlazione intraclasse di 0,989 (95% CI 0,864-0,998), mentre il coefficiente di correlazione interosservatore era di 0,980 (95% CI 0,924-0,995). La frazione di eiezione ventricolare sinistra ha mostrato una buona variabilità all’interno e tra gli osservatori, con un coefficiente di correlazione intraclasse di 0,871 (95% CI 0,517-0,967) e un coefficiente interosservatore di 0,772 (95% CI 0,115-0,943). Questi risultati mostrano che l’imaging cardiaco può essere utilizzato per identificare i pazienti con una mortalità più elevata, in modo che tale stratificazione del rischio possa potenzialmente portare alla selezione di terapie ottimali.
Messaggi da portare a casa
- Un semplice parametro ecocardiografico, il LAVI, era un marcatore prognostico indipendente nei pazienti con amiloidosi AL.
- Il volume atriale sinistro indicizzato e il LVGLS stratificato in base ai valori di cut-off clinici hanno mostrato esiti peggiori con un LVGLS peggiore e un LAVI crescente.
- Un punteggio ecocardiografico composito derivato da LAVI e LVGLS ha un valore predittivo simile alla stadiazione di Mayo.
Letteratura:
- Genty P, et al.: A novel echocardiographic risk score for light-chain amyloidosis. Eur Heart J 2023; https://doi.org/10.1093/ehjopen/oead040.
- Kumar S, et al.: Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol 2012; 30: 989–995.
- Cohen OC, Ismael A, Pawarova B, et al.: Longitudinal strain is an independent predictor of survival and response to therapy in patients with systemic AL amyloidosis. Eur Heart J 2021; 43: 333–341.
- Potter E, Marwick TH: Assessment of left ventricular function by echocardiography: the case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11: 260–274.
- Lang RM, et al.: Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28: 1–39.e14.
- Ommen SR, et al.: Clinical utility of Doppler echocardio-graphy and tissue Doppler imaging in the estimation of left ventricular filling pressures: a comparative simultaneous Doppler-catheterization study. Circulation 2000; 102: 1788–1794.
CARDIOVASC 2023; 22(2): 50–52
| Immagine di copertina: micrografia ad alto ingrandimento dell’amiloidosi cardiaca senile. Congo red stain. Campione autoptico. ©Wikimedia (Nephron) |