Le cheratosi attiniche sono un marcatore del danno solare cronico e della carcinogenesi della pelle. La protezione solare, soprattutto in giovane età, è la più importante misura di prevenzione primaria contro le cheratosi attiniche in caso di esposizione cronica ai raggi UV. È indicato un trattamento precoce delle cheratosi attiniche. Sono disponibili diverse opzioni di trattamento.
Le cheratosi attiniche o solari (AK) rappresentano carcinomi a cellule squamose in situ della pelle e sono tra le dermatosi più comuni nella pratica quotidiana. Come suggerisce il nome, il sole, o meglio il Le radiazioni UV, soprattutto UV-B, sono responsabili del loro sviluppo. In primo luogo, l’esposizione cronica ai raggi UV provoca un danno permanente e maggiore al DNA e al genoma della pelle (in particolare la mutazione del gene soppressore del tumore p53), la cui conseguenza è una proliferazione più o meno pronunciata di cheratinociti discheratotici trasformati.
È noto da tempo che le persone con esposizione professionale ai raggi UV (“lavoratori all’aperto”) hanno l’AK molto più spesso di coloro che lavorano prevalentemente in ufficio. Oltre all’intensità dei raggi UV, anche il tipo di pelle della persona esposta ai raggi UV contribuisce al rischio di sviluppare la AK. Pertanto, si osservano prevalenze molto più elevate nelle regioni con un’elevata radiazione UV e con popolazioni dalla pelle chiara. Alle nostre latitudini, l’AK è presente nell’11-25% delle persone di età superiore ai 40 anni, mentre in Australia è circa il 60%. Uno studio condotto ad Amburgo nel 2013 ha dimostrato che la prevalenza complessiva era del 2,7%, con gli uomini più colpiti (3,9%) rispetto alle donne (1,5%).
Tuttavia, la prevalenza aumenta anche con l’età, come hanno dimostrato alcuni studi: Negli uomini di età superiore ai 60 anni, il 20% è già colpito e negli uomini di età superiore ai 70 anni addirittura il 52%. Negli ultimi 10 anni è stato osservato anche un aumento significativo della AK in generale. Oltre ai fattori eziologici, come l’esposizione cronica ai raggi UV, la ragione di questo fenomeno è probabilmente il cambiamento demografico, con una maggiore percentuale di persone anziane.
L’immunosoppressione farmacologica, ad esempio a seguito di un trapianto d’organo, non deve essere tralasciata come un altro fattore di rischio significativo: in uno studio, la AK è stata riscontrata nel 29% di 452 pazienti sottoposti a trapianto di rene al momento della visita iniziale.
Poiché il carcinoma a cellule squamose della pelle (PEK) può svilupparsi dall’AK, di solito ci si chiede: con quale probabilità ed entro quale periodo di tempo? Una revisione sistematica della letteratura del 2013, in cui sono stati analizzati 24 studi, ha concluso che, a causa del numero limitato di dati disponibili e delle limitazioni metodologiche, non è attualmente possibile ottenere stime affidabili della frequenza di sviluppo di AK in carcinoma invasivo e sono necessari ulteriori studi.
Risultati clinici
L’AK si presenta soprattutto sulle aree cutanee esposte ai raggi UV, come il capillizio, l’elice dell’orecchio, il ponte del naso, i lati estensori dell’avambraccio o il dorso della mano, come macule, papule o placche squamose di colore rossastro o rossastro-brunastro (Fig. 1). Raramente si verificano lesioni singole; piuttosto, viene colpita un’intera regione. In questo contesto, si parla di cancerogenesi dei campi.

Diagnostica
L’ispezione e la palpazione sono adatte per fare una diagnosi provvisoria di AK. Tuttavia, la AK è caratterizzata da un eritema variabile con una cheratosi espressa in modo variabile. La classificazione clinica dell’AK non è correlata all’espressione istologica. L’invasività non può quindi essere valutata con certezza clinica.
In caso di risultati poco chiari, la dermoscopia è una procedura adatta per differenziare altre malattie e tumori. Numerosi studi hanno dimostrato che l’AK, l’AK pigmentata, la malattia di Bowen e la PEK mostrano modelli tipici, soprattutto dei vasi, alla dermoscopia: Le AK mostrano principalmente una pseudorete rossa e squame leggermente giallo-brunastre, mentre i carcinomi invasivi presentano vasi a forcina e irregolari, follicoli piliferi targoidi, masse centrali di cheratina e ulcerazioni. AK e PEK possono quindi essere facilmente distinti dai carcinomi basocellulari. Inoltre, la dermoscopia è adatta anche per distinguere tra lentigo maligna, lentigo senilis e AK pigmentata. Inoltre, il grado di invasività è correlato all’atipia vascolare, quindi la dermoscopia può essere utilizzata anche per valutare l’invasività. Altri metodi di imaging non invasivi includono la microscopia laser confocale e la tomografia a coerenza ottica, ma questi sono per lo più disponibili solo per le cliniche.
Se è presente un reperto clinico tipico, l’AK non richiede una diagnosi istologica. D’altra parte, le lesioni che non sono clinicamente chiare, dove ci sono segni di progressione verso la PEK, o dove ci sono segni di progressione verso la PEK, devono essere indagate. il cui comportamento biologico non può essere valutato, è necessario eseguire una biopsia. Anche le AK che non rispondono a una terapia adeguata devono essere sottoposte a biopsia.
Terapia
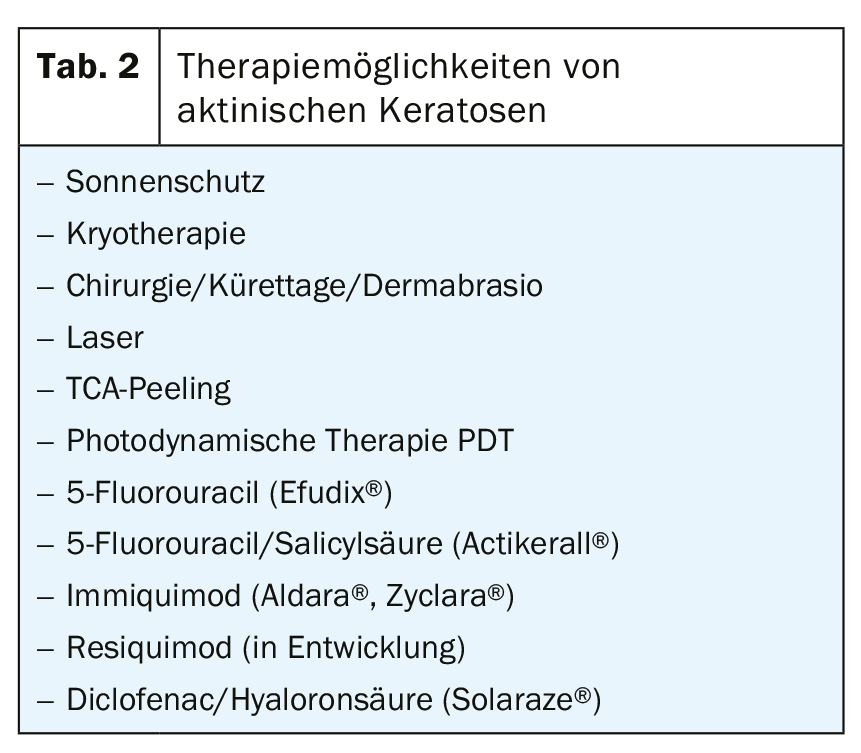
Attualmente esiste un gran numero di opzioni terapeutiche disponibili per il trattamento dell’AK, il che non rende necessariamente più facile decidere una terapia particolare nella pratica quotidiana. Inoltre, la scelta di un trattamento appropriato dipende da fattori specifici del paziente, della lesione e della terapia. I fattori del paziente includono l’età, le comorbidità, l’immunosoppressione, i farmaci, i desideri e le preferenze del paziente e l’aderenza al trattamento. Gli aspetti legati alle lesioni comprendono il numero di AK, la loro localizzazione, la natura clinica e le dimensioni del campo interessato. Inoltre, come detto all’inizio, l’AK si basa patogeneticamente sul danno al DNA della pelle, che preprogramma le recidive prima o poi.
In linea di principio, ognuna delle opzioni di trattamento esistenti si basa sulla distruzione delle aree colpite e sulla successiva riepitelizzazione.
Crioterapia
La crioterapia con azoto liquido (-196°C) è la procedura di trattamento fisicamente distruttiva più comune per l’AK nella vita quotidiana. Frequenza, durata, intensità e temperatura specifica dell’area di trattamento non sono standardizzate. I pochi studi esistenti mostrano tassi di guarigione correlati alla lesione compresi tra il 41,9% e l’88%, tassi correlati al paziente compresi tra il 25% e il 90,3% e tassi di recidiva compresi tra l’1,2% e il 12% entro il primo anno. Nel complesso, si tratta più o meno di un metodo basato sull’eminenza che di un metodo basato sull’evidenza, ma è poco costoso, richiede poco tempo ed è ben tollerato dal paziente senza anestesia locale. La durata del congelamento è correlata all’efficacia, ma anche ai possibili effetti collaterali (ipo/iperpigmentazione, cicatrici).
Altre procedure ablative, che devono essere menzionate qui solo per completezza e che, tuttavia, negli studi hanno dimostrato di essere equivalenti alla crioterapia, sono le procedure chirurgiche (curettage, escissione piatta, escissione, dermoabrasione), il peeling TCA e il laser (ablativo, non ablativo).
Terapia fotodinamica PDT
La PDT si basa sulla distruzione selettiva delle cellule tumorali cutanee nell’epidermide e nel derma, utilizzando una sostanza fotosensibilizzante (acido 5-aminolevulinico ALA, metil-5-ammino-4-ossopentanoato MAL [Metvix®]) e l’irradiazione con luce rossa ad alta energia. Gli studi rilevano tassi di guarigione correlati alla lesione tra il 58% e il 94,3% e correlati al paziente tra il 31,8% e il 91%, con risultati estetici prevalentemente valutati come “eccellenti” o “buoni”. Tuttavia, il tempo richiesto (devono trascorrere 3 ore tra l’applicazione della crema e l’irradiazione), il dolore e le reazioni locali più forti (eritema, edema, pustole, erosioni) sono percepiti come svantaggi.
Per semplificare la procedura di trattamento, in alternativa è disponibile un cerotto contenente ALA (Ameluz®, Alacare®).
Una nuova variante alla PDT convenzionale è la cosiddetta PDT diurna, che può essere effettuata dalla fine di aprile alla fine di settembre. Dopo il curettage delle croste e delle ipercheratosi e l’applicazione di una protezione solare SPF 20, il MAL viene applicato sulle cheratosi attiniche senza occlusione e il paziente viene istruito a rimanere all’aperto per 90-120 minuti (a seconda dell’esposizione al sole) tra le 11.00 e le 16.00 dopo circa mezz’ora. In seguito, il MAL deve essere lavato via. Nella panoramica dello studio, questo tipo di PDT sembra essere leggermente inferiore al metodo convenzionale, con una riduzione significativa del dolore.
5-fluorouracile topico (Efudix®)
Il 5-fluorouracile è un analogo della pirimidina che viene incorporato nell’RNA e nel DNA come antimetabolita e quindi inibisce la sintesi di questo acido nucleico. C’è anche un’inibizione della timidil sintetasi. Il 5-Fluorouracile 5% deve essere applicato due volte al giorno per 2 – 4 settimane, ma sono comuni anche altre variazioni di dosaggio, ad esempio ogni 2 giorno per 3 settimane fino all’autotrattamento da parte del paziente. Di solito si verificano reazioni infiammatorie più o meno pronunciate fino a erosioni, vesciche o necrosi, che alla fine possono essere limitanti per la terapia. I tassi di guarigione legati alla lesione variavano dal 47% al 94%, quelli legati al paziente dal 38% al 96%. Il fluorouracile topico a basso dosaggio allo 0,5% in combinazione con l’acido salicilico al 10% (Actikerall®), applicato una volta al giorno, di solito mostra reazioni cutanee meno infiammatorie. Tasso di guarigione correlato alla lesione: dal 39,4% al 98,7%, correlato al paziente: 55,4%.
Imiquimod
Imiquimod è un agonista specifico del TLR-7 e provoca il rilascio di una serie di citochine (IFN-alfa, IL-1, IL-6, IL-12 e TNF-alfa), determinando un aumento dell’immunità cellulare con proprietà antivirali e antitumorali. La crema al 5% (Aldara®) viene applicata tre volte alla settimana per 4 settimane. Secondo gli studi, il tasso di guarigione legato alla lesione è compreso tra il 45,1% e il 93,6%, quello legato al paziente tra il 24% e l’85%. La crema al 3,75% (Zyclara®) viene utilizzata come terapia a intervalli: 1× al giorno per 2 settimane, 2 settimane di pausa, 1× al giorno per 2 settimane, ottenendo tassi di guarigione correlati alla lesione tra il 34% e l’81,8%.
Diclofenac in gel di acido ialuronico (Solaraze®)
Diclofenac come inibitore COX1 e COX2 rallenta la proliferazione e la neoangiogenesi nella carcinogenesi e promuove l’apoptosi. Il gel viene applicato due volte al giorno per 60-90 giorni. Nella panoramica dello studio, è stato osservato un tasso di guarigione correlato alla lesione tra il 51,8% e l’81%, e correlato al paziente tra il 27% e il 50%, con reazioni avverse (prurito, eritema, ipo e parestesia, reazioni fotoallergiche) significativamente inferiori rispetto all’imiquimod o al 5-fluorouracile.
Ingenolo mebutato (Picato®)
Il gel applicato topicamente derivato da una pianta di euforbia, che induce una rottura del potenziale di membrana mitocondriale con conseguente necrosi cellulare, che si manifesta clinicamente con una dermatite tossica più o meno grave, è stato ritirato dal mercato nel gennaio 2020 a causa di un possibile rischio di aumento della cancerogenesi cutanea nelle aree trattate.
Sommario
In sintesi, la protezione solare, soprattutto in giovane età e in caso di esposizione cronica ai raggi UV, è la misura più importante nella prevenzione primaria dell’AK. Tuttavia, una volta che il danno solare si è fissato e “bruciato” nel genoma della pelle, la diagnosi precoce e il trattamento diventano una priorità assoluta. Per il trattamento dell’AK sono disponibili diverse opzioni e modalità terapeutiche. Ogni metodo presenta alcuni vantaggi, ma anche svantaggi. La panoramica dello studio mostra che l’efficacia delle opzioni di trattamento presentate è compresa tra il 50% e il 90%, con la PDT che si comporta leggermente meglio di Solaraze®, il che riflette anche l’esperienza clinica. L’obiettivo è quello di avere un regime di trattamento adattato individualmente al rispettivo paziente, per cui è possibile passare da una procedura all’altra o combinare i metodi nel corso del tempo. Inoltre, non tutti i pazienti rispondono ugualmente bene a un determinato metodo di trattamento. Occasionalmente, durante il trattamento si verificano reazioni infiammatorie locali più pronunciate, mentre in altri pazienti sembra che all’inizio non succeda nulla, ma alla fine le lesioni AK guariscono completamente. A questo proposito, il colloquio educativo e la guida del paziente hanno funzioni molto decisive. Da un lato, il paziente deve essere informato sui danni cronici della luce sulla pelle, sull’insorgenza della cancerogenesi e sui controlli regolari che saranno probabilmente necessari per tutta la vita; dall’altro, deve essere informato sulle varie opzioni terapeutiche. Tuttavia, ciò richiede che il dermatologo curante abbia familiarità con la “tastiera” delle opzioni di trattamento dell’AK.
Messaggi da portare a casa
- La protezione solare, soprattutto in giovane età, è la misura di prevenzione primaria più importante contro l’AK in caso di esposizione cronica ai raggi UV.
- Le AK sono un marcatore del danno solare cronico e della cancerogenesi della pelle.
- È indicato un trattamento precoce dell’AK.
- Sono disponibili diverse opzioni di trattamento della AK.
- L’educazione e il concetto di trattamento individuale sono principi fondamentali della terapia AK.
Letteratura:
- Linea guida S3 Cheratosi attinica e carcinoma a cellule squamose della pelle, linea guida AWMF della Società Dermatologica Tedesca marzo 2020.
- Kornek T, Augustin M: Prevenzione del cancro della pelle. J Dtsch Dermatol Ges 2013; 11(4): 283-296.
- Green AC: Epidemiologia delle cheratosi attiniche. Curr Probl Dermatol 2015; 46: 1-7.
- Memon AA, et al: Prevalenza del solardamage e della cheratosi attinica in una popolazione del Merseyside. Br J Dermatol 2000 ; 142(6): 1154-1159.
- Schmitt J, et al: L’esposizione professionale alla luce ultravioletta aumenta il rischio di sviluppare il carcinoma cutaneo a cellule squamose: una revisione sistematica e una meta-analisi. Br J Dermatol 2011; 164(2): 291-307.
- Werner RN, et al: La storia naturale della cheratosi attinica: una revisione sistematica. Br J Dermatol 2013; 169(3): 502-518.
- Huerta-Brogeras M, et al: Convalida della dermoscopia come tecnica di diagnostica per immagini non invasiva in tempo reale per la cheratosi attinica. Arch Dermatol 2012 ; 148(10): 1159-1164.
- Zalaudek I, et al: Dermatoscopia della cheratosi attinica del viso, del carcinoma intraepidermico e del carcinoma invasivo a cellule squamose: un modello di progressione. J Am Acad Dermatol 2011.
- Akay BN, et al: Dermatoscopia delle lesioni piatte pigmentate del viso: sfida diagnostica tra cheratosi attinica pigmentata e lentigo maligna. Br J Dermatol 2010; 163(6): 1212-1217.
- Lallas A, et al: Le caratteristiche cliniche e dermoscopiche del carcinoma cutaneo invasivo a cellule squamose dipendono dal grado istopatologico di differenziazione. Br J Dermatol 2015; 172(5): 1308-1315.
PRATICA DERMATOLOGICA 2020; 30(4): 6-9