Il trattamento dell’artrite reumatoide (RA) ha compiuto progressi significativi negli ultimi anni, ma la terapia rimane una sfida per molti pazienti: fino al 60% delle persone colpite non risponde al trattamento iniziale o perde la risposta alla terapia nel tempo [2]. Gli inibitori del TNF (TNFi) sono ancora spesso utilizzati di routine come terapie di prima linea dopo i DMARD (cs)sintetici convenzionali e, in caso di risposta insufficiente, sono utilizzati come terapie di prima linea. passano a un secondo TNFi, il che è noto come ciclo di TNFi [3]. I dati attuali suggeriscono che questa pratica dovrebbe essere riconsiderata: invece di un altro ciclo di TNFi, il passaggio a sostanze con un diverso meccanismo d’azione, come gli inibitori della Janus chinasi (JAKi), potrebbe essere vantaggioso per i pazienti [1].
Nelle attuali raccomandazioni di trattamento a obiettivo (T2T) per l’AR, la remissione clinica è l’obiettivo primario del trattamento [4]. [5-7] La remissione è di importanza centrale per i pazienti, in quanto non solo rallenta la progressione del danno articolare, ma migliora anche in modo significativo il benessere psicologico e il funzionamento fisico delle persone colpite. [8-10] La remissione precoce, in particolare, è fondamentale per gli effetti a lungo termine della malattia. I dati degli studi e gliesiti riferiti dai pazienti (PRO) mostrano che la remissione precoce è associata alla remissione a lungo termine [8, 9]. Tuttavia, circa il 30-40% dei pazienti con RA che iniziano una terapia di prima linea con TNFi interrompono il trattamento a causa di un fallimento primario, di una mancata risposta secondaria o di un’intolleranza [1]. In questi casi, è particolarmente importante passare rapidamente a una terapia alternativa insieme, per mantenere la possibilità di una remissione duratura e non perdere il controllo della malattia.
Ciclismo vs. commutazione
L’American College of Rheumatology (ACR) raccomanda il passaggio a un bDMARD o tsDMARD di un’altra classe di farmaci nell’AR dopo il fallimento di un agente terapeutico biologico o target-specifico iniziale (bDMARD o tsDMARD), mentre l’Alleanza Europea delle Associazioni per la Reumatologia (EULAR) raccomanda il passaggio a un altro meccanismo d’azione e il ciclaggio [4, 11]. [12] Sia la ciclicità del TNFi che il passaggio a un meccanismo d’azione alternativo sono spesso utilizzati quando la terapia con TNFi fallisce. [13] Tuttavia, i dati degli studi dimostrano che i pazienti che si sottopongono a più cicli di TNFi hanno maggiori probabilità di fallire la terapia e di passare di nuovo ad un altro meccanismo d’azione. [14,15] Tuttavia, il passaggio a un meccanismo d’azione diverso sarebbe associato a una maggiore possibilità di miglioramento clinico e a un tasso di abbandono inferiore.
Upadacitinib è favorevole alla commutazione
Uno studio multinazionale che ha analizzato i dati del registro di 503 pazienti con RA dopo il fallimento della terapia TNFi di prima linea ha analizzato il successo di diverse terapie di follow-up [1]. I pazienti sono stati confrontati con il passaggio al JAKi upadacitinib (RINVOQ®, UPA, n=261), a un secondo TNFi (n=128) o a un DMARD con un diverso meccanismo d’azione (n=114) [1, 16]. I pazienti che sono passati da un TNFi a UPA hanno ottenuto risultati clinici significativamente migliori rispetto a quelli che hanno ricevuto un secondo TNFi. Ad esempio, il 67,7% dei pazienti con UPA ha raggiunto la remissione rispetto al 40,3% di coloro che hanno ricevuto un secondo TNFi (p=0,002). La libertà dal dolore è stata più elevata con l’UPA (55,7 % rispetto al 25,4 %, p=0,001) e l’aderenza è stata del 60 % rispetto al 34,2 % dei pazienti con TNFi (p=0,005) (Fig. 1) [1]. L’UPA era anche superiore a un DMARD con un diverso meccanismo d’azione in tutti e tre gli aspetti. [17] Inoltre, i dati a 5 anni pubblicati di recente dallo studio SELECT-COMPARE sottolineano che un cambio di meccanismo d’azione sembra essere vantaggioso per i pazienti con RA che non hanno raggiunto il loro obiettivo terapeutico e che questo vantaggio può essere mantenuto a lungo termine. [17] Lo studio ha evidenziato differenze numeriche soprattutto a favore dei pazienti che sono passati da ADA a UPA. Tuttavia, non solo nell’AR, ma anche nell’artrite psoriasica (PsA) e nella spondiloartrite assiale (axSpA), i dati degli studi indicano che i pazienti rispondono meno bene a un secondo o terzo TNFi rispetto al primo [12, 18, 19].
Upadacitinib è vantaggioso anche come terapia di prima linea dopo i csDMARDs
L’efficacia di UPA rispetto al TNFi come terapia di prima linea è stata confrontata negli studi testa a testa del programma SELECT-COMPARE [20, 21]. UPA + metotrexato (MTX) ha mostrato un’efficacia significativamente superiore rispetto ad adalimumab (ADA) + MTX in vari parametri come DAS28≤2.6, ACR50, variazione di HAQ-DI e sollievo dal dolore già a partire da 12 settimane [20, 21]. [21] È stato inoltre possibile dimostrare una remissione sostenuta più elevata con UPA + MTX rispetto ad ADA + MTX per 5 anni. Diversi studi reali hanno ora dimostrato anche la buona efficacia e la lunga durata del trattamento con upadacitinib nella pratica quotidiana [22, 23]. [24] Inoltre, i dati fino a 7,5 anni pubblicati a EULAR 2024 confermano il noto profilo di sicurezza di UPA in oltre 4.700 pazienti.
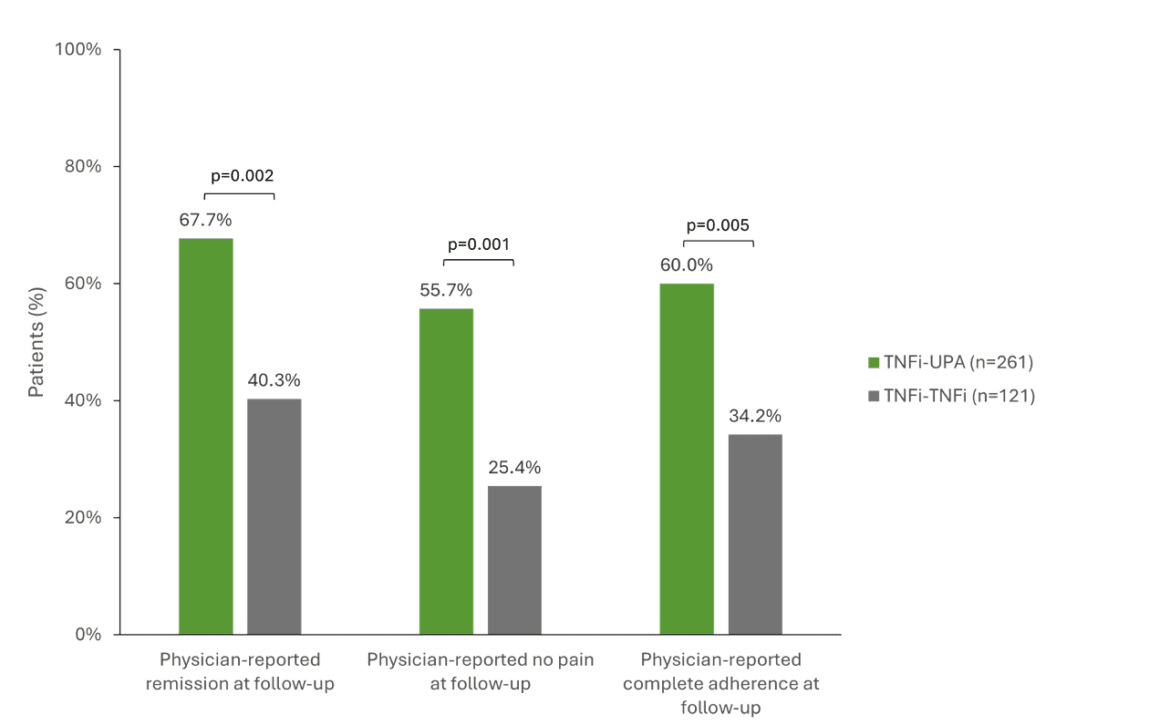
Fig. 1: Risultati clinici significativamente migliori quando si passa a UPA (TNFi-UPA) rispetto a un secondo TNFi (TNFi-TNFi). TNFi = inibitore del TNF, UPA = upadacitinib. Adattato da [1].
Conclusione
I dati disponibili suggeriscono che il passaggio dal TNFi all’UPA può essere un’opzione terapeutica favorevole per i pazienti con RA che non hanno risposto adeguatamente o sono intolleranti alla terapia iniziale con TNFi [1]. Rispetto al ciclo di TNFi, il passaggio all’UPA con un meccanismo d’azione alternativo offre maggiori possibilità di remissione, libertà dal dolore e aderenza al trattamento [1]. Questi risultati supportano la raccomandazione di passare a un meccanismo d’azione alternativo in una fase precoce, al fine di migliorare i risultati del trattamento a lungo termine per i pazienti con RA e aumentare le possibilità di una remissione duratura.
Abbreviazioni: ACR = American College of Rheumatology; ACR50 = risposta ACR con miglioramento ≥50%; ADA = adalimumab; axSpA = spondiloartrite assiale; csDMARD = DMARD sintetico convenzionale; DAS28 = Disease Activity Score 28; DMARD = farmaci antireumatici modificanti la malattia; EULAR = European Alliance of Associations for Rheumatology; HAQ-DI = Health Assessment Questionnaire Disability Index; JAK = Janus chinasi; JAKi = JAK inibitore; MTX = metotrexato; PRO = patient-reported outcome; PsA = artrite psoriasica; RA = artrite reumatoide; T2T = treat-to-target; TNF = fattore di necrosi tumorale; TNFi = inibitore del TNF; UPA = upadacitinib.
Brevi informazioni tecniche RINVOQ®

Questo articolo è stato realizzato con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Questo articolo è stato pubblicato in tedesco. Testo: Dr sc. nat.
Stefanie Jovanovic CH-RNQ-240019 11/2024
Letteratura
1 Caporali, R., et al, A Real-World Comparison of Clinical Effectiveness in Patients with Rheumatoid Arthritis Treated with Upadacitinib, Tumour Necrosis Factor Inhibitors, and Other Advanced Therapies After Switching from an Initial Tumour Necrosis Factor Inhibitor. Adv Ther, 2024. 41(9): p. 3706-3721.
2 Vallejo-Yague, E., et al, Efficacia comparativa dei biologici nei pazienti con artrite reumatoide stratificati in base all’indice di massa corporea: uno studio di coorte in un registro svizzero. BMJ Open, 2024. 14(2): p. e074864.
3 Edgerton, C., et al, Real-World Treatment and Care Patterns in Patients With Rheumatoid Arthritis Initiating First-Line Tumour Necrosis Factor Inhibitor Therapy in the United States. ACR Open Rheumatol, 2024. 6(4): p. 179-188.
4 Smolen, J.S., et al, Raccomandazioni EULAR per la gestione dell’artrite reumatoide con farmaci antireumatici sintetici e biologici modificanti la malattia: aggiornamento 2022. Ann Rheum Dis, 2023. 82(1): p. 3-18.
5 Lillegraven, S., et al, Remissione ed esito radiografico nell’artrite reumatoide: applicazione dei criteri di remissione ACR/EULAR 2011 in una coorte osservazionale. Ann Rheum Dis, 2012. 71(5): p. 681-6.
6 McInnes, I.B. e G. Schett, La patogenesi dell’artrite reumatoide. N Engl J Med, 2011. 365(23): p. 2205-19.
7 Einarsson, J.T., et al, La remissione sostenuta migliora la funzione fisica nei pazienti con artrite reumatoide consolidata e dovrebbe essere un obiettivo di trattamento: uno studio di coorte osservazionale prospettico della Svezia meridionale. J Rheumatol, 2016. 43(6): p. 1017-23.
8 Ten Klooster, P.M., et al, Esiti clinici, funzionali e di costo a lungo termine per i pazienti con artrite reumatoide precoce che hanno raggiunto o meno la remissione precoce in una strategia treat-to-target del mondo reale. Clin Rheumatol, 2019. 38(10): p. 2727-2736.
9 Xie, W., J. Li e Z. Zhang, L’impatto di diversi set di criteri sulla remissione precoce e l’identificazione dei suoi predittori nell’artrite reumatoide: risultati di una coorte osservazionale (2009-2018). Clin Rheumatol, 2020. 39(2): p. 381-389.
10 Snoeck Henkemans, S.V.J., et al, Esiti riferiti dal paziente e progressione radiografica nei pazienti con artrite reumatoide in remissione sostenuta rispetto alla bassa attività di malattia. RMD Open, 2024. 10(1).
11 Fraenkel, L., et al, 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken), 2021. 73(7): p. 924-939.
12 Bogas, P., et al, Confronto dell’efficacia a lungo termine tra gli agenti biologici dopo il fallimento dell’inibitore del fattore di necrosi tumorale nei pazienti con artrite reumatoide: uno studio prospettico di coorte. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211060910.
13 Wei, W., et al, Persistenza del trattamento ed esiti clinici del ciclo di inibitori del fattore di necrosi tumorale o del passaggio a una terapia con un nuovo meccanismo d’azione: studio osservazionale sul mondo reale di pazienti affetti da artrite reumatoide negli Stati Uniti con precedente terapia con inibitori del fattore di necrosi tumorale. Adv Ther, 2017. 34(8): p. 1936-1952.
14 Migliore, A., et al, Ciclizzazione degli inibitori del fattore di necrosi tumorale rispetto al passaggio a una terapia con meccanismo d’azione diverso nei pazienti con artrite reumatoide con risposta inadeguata agli inibitori del fattore di necrosi tumorale: una meta-analisi di rete bayesiana. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211002682.
15 Mann, H., et al, Il passaggio a un farmaco mirato con un diverso modo d’azione dopo l’interruzione del primo inibitore del TNF è associato a una migliore sopravvivenza rispetto a un secondo inibitore del TNF nell’artrite reumatoide: un’analisi con punteggio di propensione del registro ceco ATTRA. Abstract 2277, presentato all’ACR Convergence, 14-19 novembre 2024, Washington DC, USA.
16 Riassunto attuale delle caratteristiche del prodotto di RINVOQ® (upadacitinib) su www.swissmedicinfo.ch.
17 Fleischmann, R., et al, Efficacia e sicurezza a lungo termine dopo il passaggio tra Upadacitinib e Adalimumab nei pazienti con artrite reumatoide: dati a 5 anni di SELECT-COMPARE. Rheumatol Ther, 2024. 11(3): p. 599-615.
18 Linde, L., et al, Secondo e terzo inibitore del TNF in pazienti europei con spondiloartrite assiale: efficacia e impatto del motivo del cambio. Rheumatology (Oxford), 2024. 63(7): p. 1882-1892.
19 Ørnbjerg, L.M., et al, Efficacia farmacologica del secondo e terzo inibitore del TNF nell’artrite psoriasica – relazione con il motivo del ritiro dal trattamento precedente. Joint Bone Spine, 2024. 91(4): p. 105729.
20 Fleischmann, R., et al, Upadacitinib rispetto a placebo o adalimumab nei pazienti con artrite reumatoide e risposta inadeguata al metotrexato: risultati di uno studio di fase III, in doppio cieco, randomizzato e controllato. Arthritis Rheumatol, 2019. 71(11): p. 1788-1800.
21 Fleischmann, R., et al, Sicurezza ed efficacia a lungo termine di upadacitinib rispetto ad adalimumab nei pazienti con artrite reumatoide: dati a 5 anni dello studio randomizzato di fase 3 SELECT-COMPARE. RMD Open, 2024. 10(2).
22 Witte, T., et al, L’impatto dei livelli di proteina C-reattiva sull’efficacia di upadacitinib nei pazienti con artrite reumatoide: uno studio prospettico tedesco non interventistico di 12 mesi. Clin Exp Rheumatol, 2024. 42(3): p. 726-735.
23 Bessette, L., et al, Efficacia nel mondo reale di Upadacitinib per il trattamento dell’artrite reumatoide nei pazienti canadesi: Risultati intermedi dello studio prospettico osservazionale CLOSE-UP. Rheumatol Ther, 2024. 11(3): p. 563-582.
24 Burmester GR, et al, Sicurezza di Upadacitinib nell’artrite reumatoide, nell’artrite psoriasica e nella spondiloartrite assiale, con 15.000 pazienti-anni di dati clinici. Presentato al Congresso Europeo di Reumatologia (EULAR), 12-15 giugno 2024, Vienna, Austria. POS0894.
Le referenze possono essere richieste dai professionisti all’indirizzo medinfo.ch@abbvie.com.










