Il ruolo della diagnostica per immagini nella diagnosi di PD attualmente consiste principalmente nell’esclusione di cause di parkinsonismo secondario. Tuttavia, in relazione alla clinica, può anche fornire argomenti per la presenza della malattia di Parkinson o di sindromi di Parkinson atipiche. Gli sviluppi più recenti mirano alla diagnosi corretta dei singoli pazienti attraverso l’imaging in un contesto clinico.
La malattia di Parkinson è il disturbo del movimento neurodegenerativo più comune e la malattia neurodegenerativa più diffusa dopo il morbo di Alzheimer [1]. Prende il nome dal medico inglese James Parkinson, che pubblicò la prima descrizione dettagliata del quadro clinico nel 1817 [2].
La diagnosi di malattia di Parkinson viene fatta clinicamente, anche se può essere confermata definitivamente solo a livello istopatologico. Di solito, è necessaria una combinazione di sintomi motori (rigore, tremore, bradicinesia) con esordio asimmetrico dei sintomi, una risposta alla L-dopa, un decorso progressivo di oltre dieci anni e l’esclusione di altre cause di parkinsonismo [3, 4]. Nelle fasi iniziali, tuttavia, spesso non sono presenti tutti i sintomi; inoltre, altre entità possono causare una sovrapposizione della sintomatologia; studi post mortem hanno dimostrato che viene fatta una percentuale relativamente alta di diagnosi errate di PD (76% di conferme all’autopsia [5]).
I metodi di imaging (sia morfologici che funzionali) non possono aiutare nella diagnosi di PD fornendo segni specifici della malattia, ma possono identificare o supportare la diagnosi di altre cause di PD. Con l’aiuto di metodi più recenti, si sta anche cercando di diagnosticare la malattia di Parkinson stessa per i singoli pazienti.
Imaging trasversale
Il correlato anatomo-patologico della malattia di Parkinson è la perdita di cellule dopaminergiche nella substantia nigra pars compacta (Fig. 1), che tuttavia solo raramente si riflette in un restringimento della stessa nella risonanza magnetica. Nella maggior parte dei casi, c’è solo un’atrofia aspecifica con espansione degli spazi interni ed esterni del liquor. Attualmente, il vero valore della diagnostica per immagini risiede nella possibilità di escludere altre cause della sintomatologia, eventualmente trattabili.
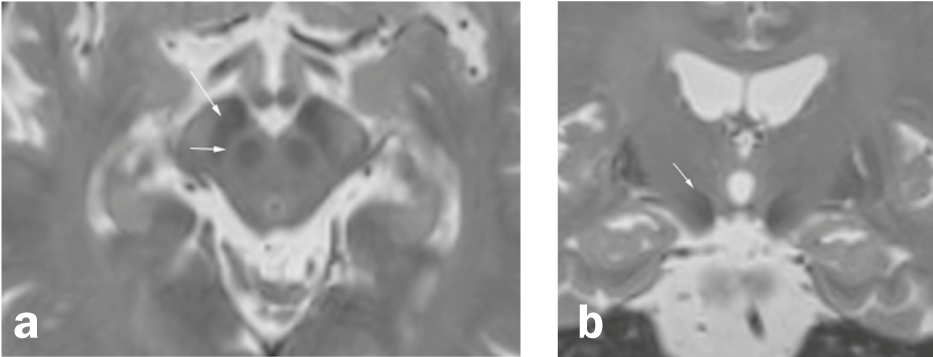
Fig. 1 Substantia nigra e dintorni
Assiale (a) e coronarica (b) Ricostruzione di una sequenza 3D T2-pesata ad alta risoluzione (RM). a) La substantia nigra situata tra il nucleo ruber e i fasci di fibre del crus cerebri è costituita da due strati, una zona ipointensa nella parte posteriore del crus cerebri (pars reticularis; freccia lunga) e uno strato relativamente iperintenso (freccia corta) tra la pars reticularis e il nucleo ruber (per cui le zone nella ponderazione T2 non corrispondono esattamente alla localizzazione anatomica). b) Il nucleo subtalamico (freccia) è un nucleo mediale alla capsula interna e superolaterale al ncl. ruber e una delle aree target per la stimolazione cerebrale profonda nella malattia di Parkinson.
Esclusione di altre cause di parkinsonismo: le diagnosi differenziali di PD includono il parkinsonismo secondario di eziologia tossica, metabolica o vascolare e lo pseudoparkinsonismo, ad esempio dovuto all’idrocefalo a pressione normale [6] o all’ematoma subdurale cronico, alcuni dei quali sono facilmente rilevabili con la TAC e/o la RM (Fig. 2).
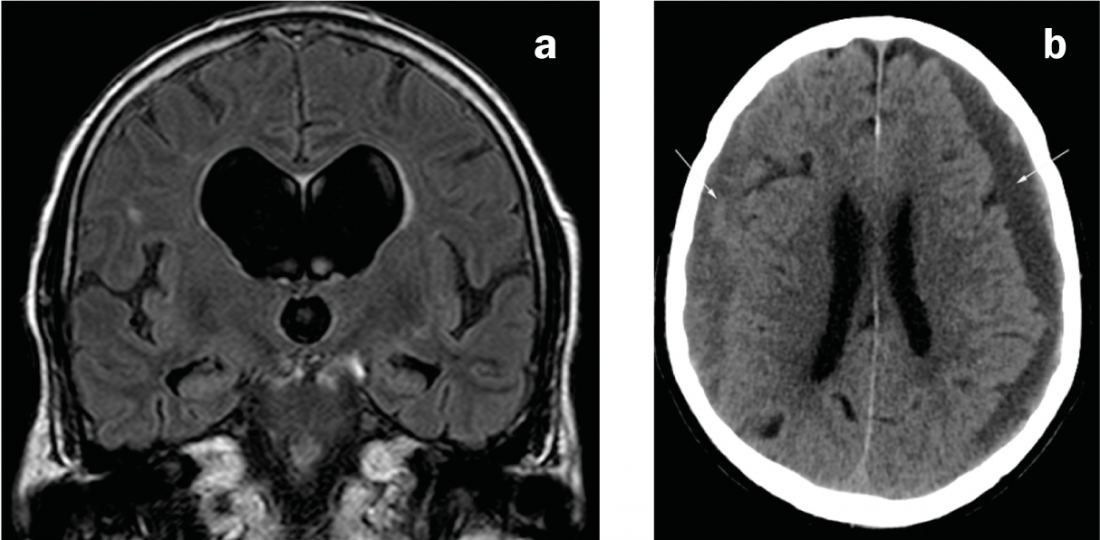
Fig. 2: Cause del parkinsonismo secondario
a) Risonanza magnetica coronarica con ponderazione FLAIR. Sistema ventricolare sproporzionatamente dilatato rispetto agli spazi esterni del liquor nell’idrocefalo a pressione normale. b) TAC assiale. Ematoma subdurale bilaterale di età mista: sinistra prevalentemente ipodensa (cioè cronica), destra prevalentemente isodensa (cioè subacuta).
Esclusione della sindrome di Parkinson atipica: le diagnosi differenziali clinicamente e radiologicamente più difficili includono le sindromi di Parkinson atipiche MSA (atrofia multisistemica), PSP (paralisi sopranucleare progressiva dello sguardo) e CBD (degenerazione gangliare corticobasale). Spesso le manifestazioni di imaging possono essere rilevate solo negli stadi avanzati.
I segni di MSA-C (tipo cerebellare) sono l’atrofia dei poni e del cervelletto (compreso il brachium pontis) e il segno del “hot cross bun” (iperintensità a forma di croce nei poni nelle immagini assiali pesate in T2/FLAIR, dovuta alla degenerazione dei neuroni pontini e delle connessioni pontocerebellari). (Fig. 3a e b). Il segno tipico della MSA-P (tipo putaminale/Parkinsoniano, una diagnosi differenziale alla malattia di Parkinson a causa dei sintomi extrapiramidali) è l’ipointensità del putamen dorsolaterale nelle sequenze pesate T2-/T2* con una striscia iperintensa adiacente (“segno della fessura putaminale” dovuto alla perdita di volume putaminale). (Fig. 3c). I reperti descritti possono essere riscontrati in tutti i sottotipi di MSA, anche se i reperti infratentoriali sono più comuni nell’MSA-C che nell’MSA-P (e i reperti putaminali, a loro volta, sono più comunemente descritti nell’MSA-P) [7].
Nella PSP, c’è un’atrofia del mesencefalo (compresi i collicoli superiori) e del peduncolo cerebellare superiore, che porta al segno del ‘pinguino’ sulle immagini sagittali (si dice che il mesencefalo piatto e la rotondità conservata dei poni portino a una somiglianza con la silhouette di un pinguino con una testa piccola e un ventre rotondo). (Fig. 3d ed e). Il grigio periaqueduttale può apparire T2 iperintenso.
I risultati della CBD sono un restringimento del giro pre e postcentrale (Fig. 3f), Gliosi sottocorticale con iperintensità T2/FLAIR e prominente atrofia parasagittale. L’atrofia dei gangli della base può essere discreta.
Poiché tutti questi segni possono essere molto sottili e c’è una certa sovrapposizione nei risultati di tutti i quadri clinici menzionati, sono state utilizzate varie misurazioni (ad esempio, diametro e area del mesencefalo e del pons o del peduncolo cerebellare superiore e mediano) e indici nel tentativo di definire segni oggettivi per la diagnosi differenziale delle varie entità e quindi per fare diagnosi specifiche al di là delle differenze a livello di gruppo. Ad esempio, il “MR-parkinsonian-index” [8] permette di distinguere una possibile o probabile PSP di M. Parkinson, MSA e controlli normali.
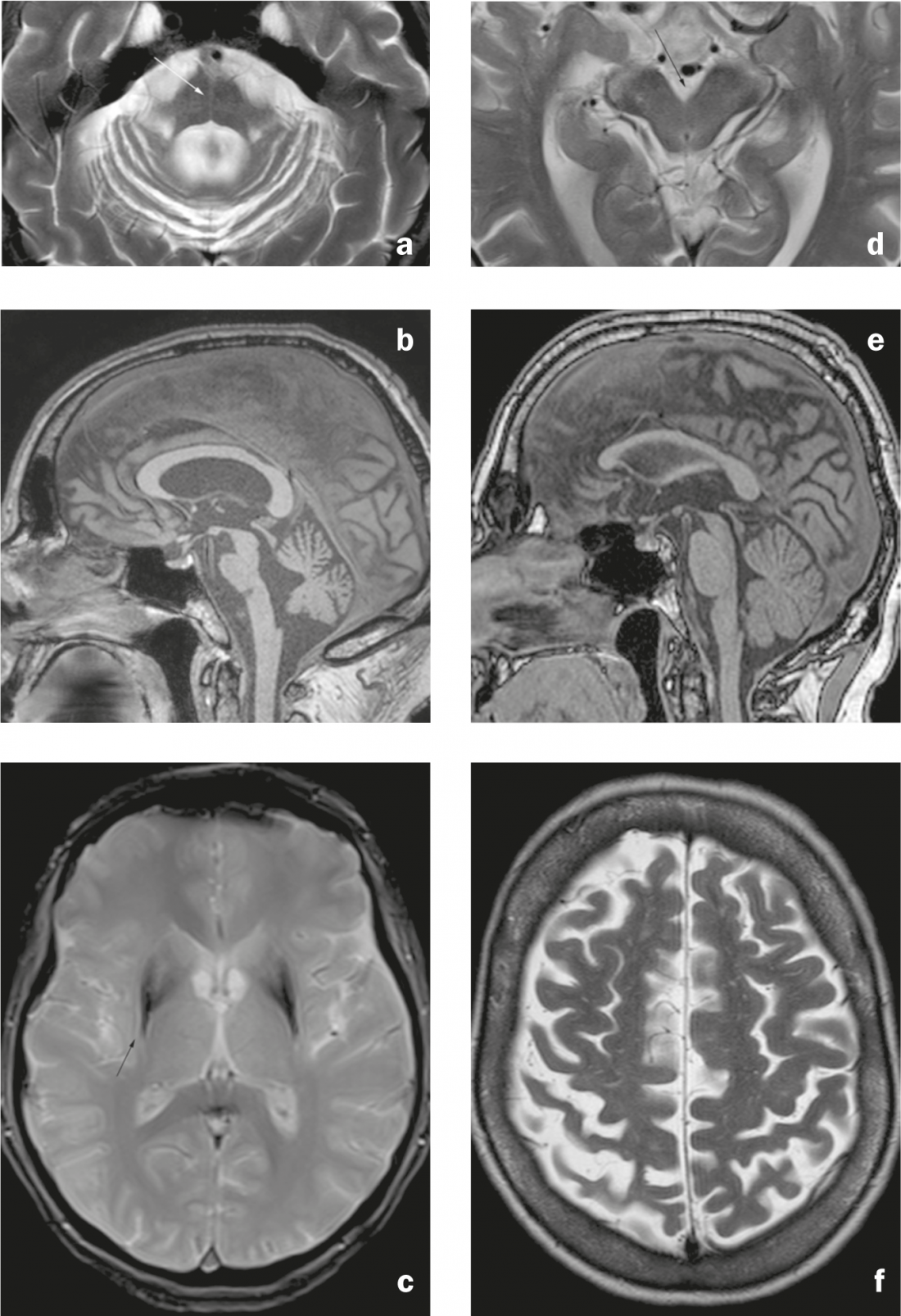
Fig. 3: Sindromi di Parkinson atipiche. MSA-C: a) Immagine assiale T2-pesata. Atrofia pontina e cerebellare con segno “hot cross bun” (freccia), dilatazione del quarto ventricolo e restringimento del brachium pontis. b) Immagine sagittale con ponderazione T1. Appiattimento del pons. MSA-P: c) Immagine assiale pesata in T2*. Ipointensità del putamen dorsolaterale con iperintensità lineare adiacente (freccia). PSP: d) Immagine assiale T2-pesata. Atrofia del mesencefalo con dilatazione della cisterna interpeduncolare. e) Immagine sagittale T1-pesata. Atrofia del mesencefalo, che appare stretto rispetto al pons (segno del “pinguino” o del “colibrì”). CBD: f) Immagine assiale T2-pesata. Atrofia del giro precentrale e postcentrale con allargamento del solco centrale (enfasi a destra).
Nuovi sviluppi nella risonanza magnetica: oltre all’imaging convenzionale, si stanno studiando tecniche di risonanza magnetica avanzate come l’imaging ponderato con la diffusione (DWI), l’imaging del tensore di diffusione (DTI) o le sequenze ponderate con la suscettibilità, come T2* o l’imaging ponderato con la suscettibilità (SWI), per quanto riguarda la differenziazione dei pazienti con PD e dei pazienti con sindromi atipiche [9, 10]. Le nuove sequenze o le nuove varianti delle sequenze esistenti saranno utilizzate per rilevare i sottili cambiamenti nelle strutture anatomiche molto piccole colpite dalla malattia di Parkinson nelle fasi iniziali. Ad esempio, utilizzando la tecnica PADRE (“phase difference enhanced imaging”; realizzata su una risonanza magnetica 3T), è stata dimostrata una sfocatura del confine tra la substantia nigra e i fasci di fibre dei crus cerebri nei pazienti con Parkinson [11], che non è rilevabile sulle sequenze di risonanza magnetica convenzionali.
Inoltre, vengono utilizzate tecniche avanzate di analisi strutturale della materia grigia (“morfometria basata sui voxel”, VBM) e bianca (“statistica spaziale basata sui tratti”, TBSS) [12, 13] per rilevare piccole differenze di segnale nella risonanza magnetica che non sono evidenti con l’analisi puramente visiva.
Imaging preoperatorio: oltre a escludere cause di parkinsonismo diverse dalla malattia di Parkinson, l’imaging trasversale è utile per il targeting preoperatorio (globus pallidus e soprattutto nervo subtalamico) prima dell’impianto di elettrodi per la stimolazione cerebrale profonda.
Metodi di medicina nucleare
I metodi di medicina nucleare consentono di rilevare un disturbo del sistema dopaminergico e sono utilizzati nella routine clinica come test diagnostico aggiuntivo nei casi non chiari. Per esempio, la disponibilità dei trasportatori presinaptici di dopamina (DaT) o l’attività della dopa decarbossilasi possono essere studiati utilizzando diversi ligandi nella SPECT o nella PET. In particolare, la “scansione DaT” ( [123I]FP-CIT-SPECT) si è diffusa come test per le sindromi di Parkinson non chiare. La malattia di Parkinson mostra una riduzione del legame con il legante(Fig. 4), che permette di distinguerla dal tremore essenziale (ma non con certezza dalle sindromi di Parkinson atipiche) [14].
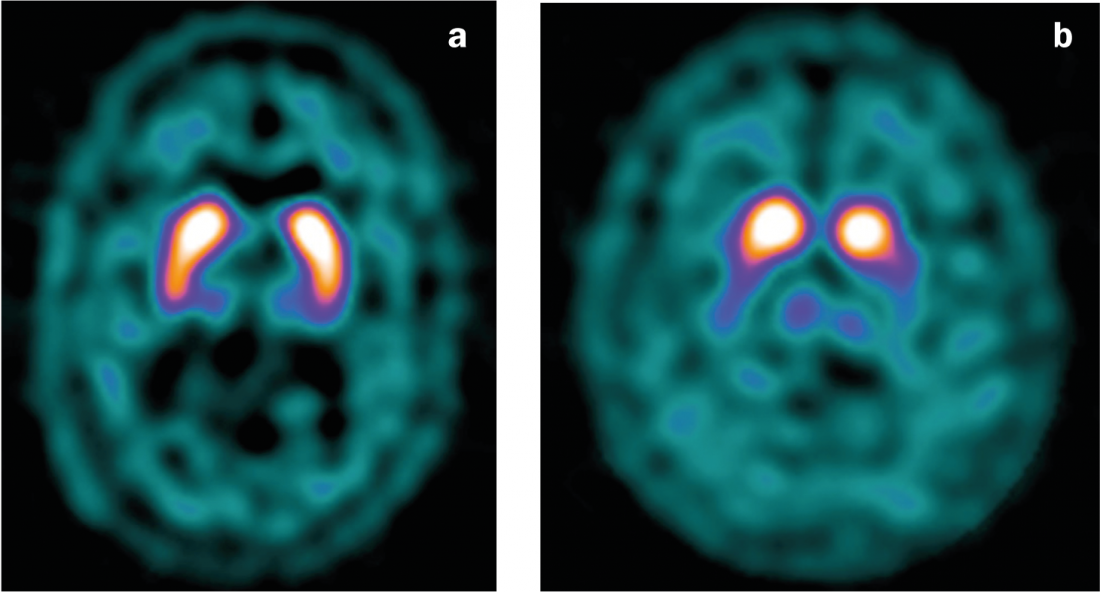
Fig. 4: Scansione DaT
a) Risultati normali con legame simmetrico del ligando nello striato.
b) Riduzione del legame con il legante nella malattia di Parkinson, soprattutto sul lato sinistro (con una clinica prevalentemente destra).
Metodi di classificazione
Oltre alle analisi morfologiche descritte in precedenza, vengono intraprese sempre più spesso analisi di classificazione per migliorare la diagnosi nei singoli pazienti. Questi non si basano, come gli studi di gruppo, sull’idea di confrontare gruppi di pazienti con soggetti di controllo sani, al fine di rilevare i cambiamenti strutturali legati alla malattia [15], le cui differenze possono essere significative a livello di gruppo ma non abbastanza pronunciate a livello individuale per consentire una diagnosi nella pratica clinica quotidiana. Piuttosto, perseguono l’obiettivo di identificare o classificare correttamente i singoli pazienti. Gli studi di classificazione vengono eseguiti utilizzando analisi di “support vector machine” di vari dati (ad esempio, sequenze DTI o SWI). Un classificatore “support vector machine” è un metodo di analisi che mira a classificare i dati in due o più gruppi (ad esempio, malattia di Parkinson/ parkinsonismo atipico) sulla base del riconoscimento dei modelli. A tal fine, in una prima fase, le immagini elaborate (cioè trasferite in uno spazio standard, ad esempio) vengono esaminate per trovare le caratteristiche più discriminanti utilizzando vari algoritmi. In una seconda fase, il classificatore determinato viene testato per sensibilità, specificità e accuratezza utilizzando una nuova serie di dati [16]. I risultati preliminari dell’analisi dei dati DTI e SWI hanno mostrato un’elevata precisione di classificazione per i pazienti con PD (rispetto ai pazienti con sintomi atipici di PD [12, 13]).
Bibliografia dell’editore
Sven Haller, MD
Isabelle Barnaure, MD











