Il carcinoma della prostata è il tumore più comune negli uomini. Non tutti i tumori alla prostata sono uguali (parola chiave stratificazione del rischio). Non tutti i carcinomi della prostata devono essere trattati (parola chiave sovra-terapia). A seconda del profilo di rischio, sono disponibili diverse opzioni terapeutiche curative per il trattamento del carcinoma prostatico localizzato.
In Svizzera, ogni anno a circa 6100 uomini viene diagnosticato un tumore alla prostata. Questo rende il carcinoma della prostata il tipo di cancro più comune in assoluto. Nella maggior parte dei casi, lo stadio iniziale del tumore è localizzato o confinato agli organi. In questo caso, l’urologo curante ha a disposizione una serie di opzioni terapeutiche. Si va dalla sorveglianza attiva alla prostatectomia radicale.
Prima di decidere a favore o contro una forma di terapia, occorre valutare per ogni paziente le condizioni generali, l’aspettativa di vita e le caratteristiche del tumore (stratificazione del rischio). L’aspettativa di vita gioca un ruolo più importante dell’età biologica quando si considerano le modalità di trattamento. Con l’avanzare dell’età del paziente o la riduzione dell’aspettativa di vita, le comorbidità del paziente riducono il rischio di morire a causa del cancro alla prostata: I pazienti muoiono quindi con il carcinoma prostatico, ma non per il carcinoma prostatico.
Stratificazione del rischio
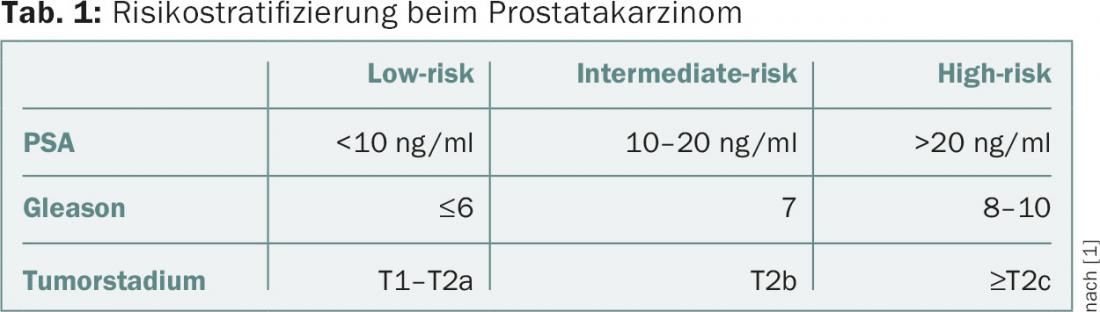
La stratificazione del rischio nel cancro alla prostata si basa sul valore del PSA, sul punteggio di Gleason bioptico e sullo stadio clinico. Una classificazione comune è quella di D’Amico et al. [1]. Qui i pazienti con carcinoma prostatico localizzato sono suddivisi in tre gruppi di rischio (tab. 1).
Sorveglianza attiva
Lo squilibrio tra incidenza e mortalità nel cancro alla prostata localizzato suggerisce che alcuni pazienti non traggono beneficio dal trattamento (sovratrattamento). Gli uomini che non cercano un trattamento immediato possono optare per la Sorveglianza Attiva (AS) in presenza di un tumore a basso rischio [2]. Lo stato locale e il valore del PSA vengono monitorati e le rebiopsie vengono eseguite secondo un programma. AS ha due obiettivi: In primo luogo, gli uomini con un carcinoma prostatico localizzato non dovrebbero ricevere una terapia curativa immediatamente, ma in tempo, in caso di progressione. In secondo luogo, per ridurre i rischi di complicazioni indotte dal trattamento (ad esempio, disfunzione erettile, incontinenza) negli uomini con carcinomi a basso rischio.
Con una buona selezione dei pazienti, i risultati sono promettenti. La sopravvivenza complessiva dei pazienti nel decorso a lungo termine è la stessa dei pazienti che hanno ricevuto direttamente la terapia curativa. Circa il 25% dei pazienti sottoposti a SA si sottopone a terapia curativa durante il periodo di osservazione. Il carico psicologico talvolta elevato dei pazienti e il possibile peggioramento della prognosi con una terapia ritardata sono contrari al concetto di AS. Per esempio, esistono dati che indicano che i pazienti che hanno aspettato più di 180 giorni per la terapia dopo la diagnosi di carcinoma prostatico avevano un rischio di recidiva post-operatoria 2,7 volte superiore rispetto ai pazienti sottoposti a prostatectomia radicale nei primi tre mesi [3].
La SA ha indubbiamente un posto nel trattamento del carcinoma prostatico localizzato, ma attualmente mancano ancora predittori affidabili per una stima sicura della prognosi. Pertanto, i pazienti devono essere informati ed educati sui rispettivi vantaggi e svantaggi della SA.
Brachiterapia a basso dosaggio
Nella brachiterapia a bassa dose (LDR), gli spilli metallici radioattivi (semi) vengono inseriti nella prostata attraverso il perineo con aghi cavi sotto controllo ecografico. I semi rimangono nella ghiandola prostatica e vi erogano la dose radioattiva richiesta. L’intervento viene eseguito in anestesia e richiede circa due ore e mezza o tre ore, compresi tutti i preparativi, con una degenza di solito di una sola notte dopo l’operazione.
Di grande importanza per la brachiterapia è la selezione dei pazienti. A causa della situazione eterogenea dei dati, la brachiterapia LDR è un’opzione terapeutica solo per i pazienti con un carcinoma a basso rischio (cioè i pazienti che si qualificano anche per l’AS), una dimensione della prostata <50 cm3 e senza sintomi rilevanti di minzione (IPSS ≤12). La sopravvivenza libera da malattia dopo cinque anni è del 71-93%, dopo dieci anni del 65-85% [4]. Ad oggi, nessuno studio randomizzato ha confrontato la brachiterapia con altre terapie curative per il cancro alla prostata localizzato.
Radioterapia esterna
La radioterapia percutanea esterna (“radioterapia a fasci esterni”, EBRT) è una terapia alternativa per il carcinoma prostatico confinato all’organo. Nei confronti retrospettivi, l’EBRT mostra risultati oncologici paragonabili alla prostatectomia radicale nei tumori ben differenziati; la prostatectomia radicale presenta dei vantaggi nei tumori poco differenziati. L’EBRT viene eseguita come irradiazione individuale a guida di immagine (TC, RM, PET-CT) utilizzando fotoni con un utilizzo ottimale dell’organo bersaglio e risparmiando il più possibile gli organi a rischio circostanti. La durata della EBRT è di diverse settimane (ad esempio, 78 Gy di dose totale con dosi singole di 2 Gy = 39 frazioni = otto settimane di terapia).
A seconda del gruppo di rischio, secondo D’Amico et al. I pazienti con EBRT ricevono una terapia neoadiuvante, concomitante o adiuvante di deprivazione androgenica (ADT). Pertanto, a causa della dipendenza ormonale del cancro alla prostata, i risultati dell’EBRT sono difficili da confrontare con quelli di altre modalità di terapia curativa. Se si verifica una recidiva dopo l’EBRT primaria, in linea di principio può essere trattata e curata anche con la prostatectomia radicale di salvataggio, ma la procedura è associata a un rischio significativamente maggiore di gravi complicazioni (incontinenza nel 56%, disfunzione erettile nell’81%) [5]. Non è chiaro se e quanto spesso si verifichino secondi tumori dopo la EBRT.
Prostatectomia radicale
Nella prostatectomia radicale (RP), viene rimossa l’intera ghiandola prostatica con le vescicole seminali e le ampolle dei vasi deferenti. Nei centri di trattamento, la procedura viene oggi eseguita preferibilmente con una procedura minimamente invasiva assistita da robot (RARP), utilizzando il sistema da Vinci. Studi recenti riportano una minore morbilità perioperatoria e una migliore funzione erettile post-operatoria con il sistema da Vinci rispetto alla tecnica aperta [6,7]. Al contrario, le osservazioni iniziali a lungo termine con un follow-up di dieci anni indicano un’efficacia oncologica equivalente della chirurgia robot-assistita e di quella aperta [8].
A seconda delle caratteristiche del tumore e della funzione sessuale del paziente, la RP viene eseguita con risparmio dei nervi (per preservare la funzione erettile) o senza risparmio dei nervi. A seconda del profilo di rischio, viene eseguita una linfoadenectomia pelvica contemporaneamente alla RP. Tra i vari metodi curativi per il trattamento del carcinoma prostatico localizzato, la RP è l’unico per il quale esiste un livello di evidenza I per quanto riguarda il controllo del tumore. Un altro vantaggio potenziale della RP rispetto alla EBRT è che, in caso di recidiva dopo la RP, una percentuale sostanziale di pazienti può essere curata con una morbilità accettabile (incontinenza nel 13%, disfunzione erettile nel 61%) mediante una radioterapia additiva (la cosiddetta radioterapia di salvataggio) [5].
Altri trattamenti
Oltre alle modalità di trattamento consolidate già descritte, esiste una varietà di altre forme di terapia. Queste includono la crioterapia, gli ultrasuoni focalizzati ad alta intensità (HIFU), la brachiterapia prostatica interstiziale ad alto dosaggio e le terapie combinate (ad esempio, EBRT e brachiterapia prostatica interstiziale). Una valutazione scientifica di queste procedure è ancora in corso e quindi non consente di formulare raccomandazioni chiare.
Conclusione
Agli uomini con un carcinoma prostatico di nuova diagnosi, localmente limitato e con un’elevata aspettativa di vita, oggi possono essere offerti tutti i metodi consolidati (EBRT, RP, brachiterapia prostatica LDR o AS) a seconda del profilo di rischio. La scelta della procedura ottimale per il singolo paziente è impegnativa e richiede una stretta collaborazione tra tutte le discipline coinvolte. Questo può essere realizzato al meglio nell’ambito di un comitato interdisciplinare per i tumori.
Letteratura:
- D’Amico AV, et al: Esito biochimico dopo prostatectomia radicale, radioterapia a fasci esterni o radioterapia interstiziale per il cancro alla prostata clinicamente localizzato. JAMA 1998; 280(11): 969-974.
- Klotz L: Sorveglianza attiva: selezione del paziente. Curr Opin Urol 2013; 23(3): 239-244.
- Lellig K, et al: [Active surveillance of low risk prostate cancer]. Urologo A 2014; 53(7): 1031-1039.
- Mottet N, et al: Linee guida sul cancro alla prostata. Associazione Europea di Urologia. Linee guida sul cancro alla prostata. Associazione Europea di Urologia 2015.
- van der Poel HG, et al: Trattamento sequenziale per il cancro alla prostata localizzato ricorrente. Journal of Surgical Oncology 2008; 97(5): 377-382.
- Ficarra V, et al: Revisione sistematica e meta-analisi degli studi che riportano il recupero della continenza urinaria dopo la prostatectomia radicale robot-assistita. Eur Urol 2012; 62(3): 405-417.
- Haglind E, et al: Incontinenza urinaria e disfunzione erettile dopo la prostatectomia radicale robotica rispetto a quella aperta: uno studio prospettico, controllato e non randomizzato. Eur Urol 2015; 68(2): 216-225.
- Diaz M, et al: Esiti oncologici a 10 anni dopo la prostatectomia radicale robotica. Eur Urol 2015; 67(6): 1168-1176.
InFo ONCOLOGIA ED EMATOLOGIA 2015; 3(11-12): 8-10