Le ferite colonizzate da biofilm rappresentano una delle maggiori sfide nella cura delle ferite croniche. Si stima che il 2% della popolazione dell’Europa centrale soffra di ferite croniche, con un rischio che aumenta con l’età. La diagnosi e il trattamento della malattia di base, solitamente la malattia occlusiva arteriosa periferica (CAD), l’insufficienza venosa (CVI), il diabete mellito di tipo I o II o una malattia immunologica, è sempre il primo passo verso un trattamento di successo. Le infezioni ricorrenti (locali) e il biofilm persistente della ferita prolungano il processo di guarigione.
Le ferite colonizzate da biofilm sono una delle maggiori sfide nella cura delle ferite croniche [1,2]. Si stima che il 2% della popolazione dell’Europa centrale soffra di ferite croniche, con un rischio che aumenta con l’età [3]. La diagnosi e il trattamento della malattia di base, solitamente arteriopatia periferica (CAD), insufficienza venosa (CVI), diabete mellito di tipo I o II o una malattia immunologica, è sempre il primo passo verso un trattamento di successo [4]. Le infezioni ricorrenti (locali) e il biofilm persistente della ferita prolungano il processo di guarigione. Questo richiede solitamente mesi e anche un trattamento intersettoriale (ospedale, ambulatorio, medico di base o specialista, infermiere) [5]. Inoltre, una volta chiusa una ferita, non c’è garanzia che rimanga chiusa. Di conseguenza, il termine “remissione della ferita” è più appropriato di “guarigione della ferita” per i pazienti con disturbi cronici della guarigione della ferita.
Biofilm della ferita – definizione e patogenesi
Secondo una meta-analisi, circa il 78% di tutte le ferite croniche sono colonizzate da microrganismi patogeni sotto forma di biofilm [6]. Questi sono responsabili della cronicizzazione di una ferita, data la migliore terapia possibile per la malattia di base [2]. Il biofilm della ferita è definito come segue:
“Il biofilm è una comunità strutturata di microbi con diversità genetica ed espressione genica variabile (fenotipo) che crea comportamenti e meccanismi di difesa che portano alla produzione di infezioni uniche (croniche) con una significativa tolleranza agli antibiotici e agli antimicrobici, pur essendo protetti dall’immunità dell’ospite”. [Processo Delphi di consenso, IWII 05/2016].
Qualsiasi ferita, anche quella acuta, viene colonizzata nel giro di poche ore da microrganismi del microbioma cutaneo, che possono contenere anche specie patogene. Il letto della ferita è un buon terreno di coltura per loro. In questa fase, si parla di “contaminazione della ferita”. Con il passare del tempo, i batteri si moltiplicano all’interno e sulla ferita; si formano colonie batteriche. La pulizia esterna (antisettica) della ferita può ridurre la colonizzazione batterica e il sistema immunitario lavora anche contro la diffusione dei batteri nella ferita. Se questi processi non avvengono o se le cellule immunitarie locali non sono abbastanza efficienti, sempre più batteri colonizzano la ferita. Viene definita “colonizzata”, o “criticamente colonizzata” se la carica batterica aumenta con una reazione locale di accompagnamento.
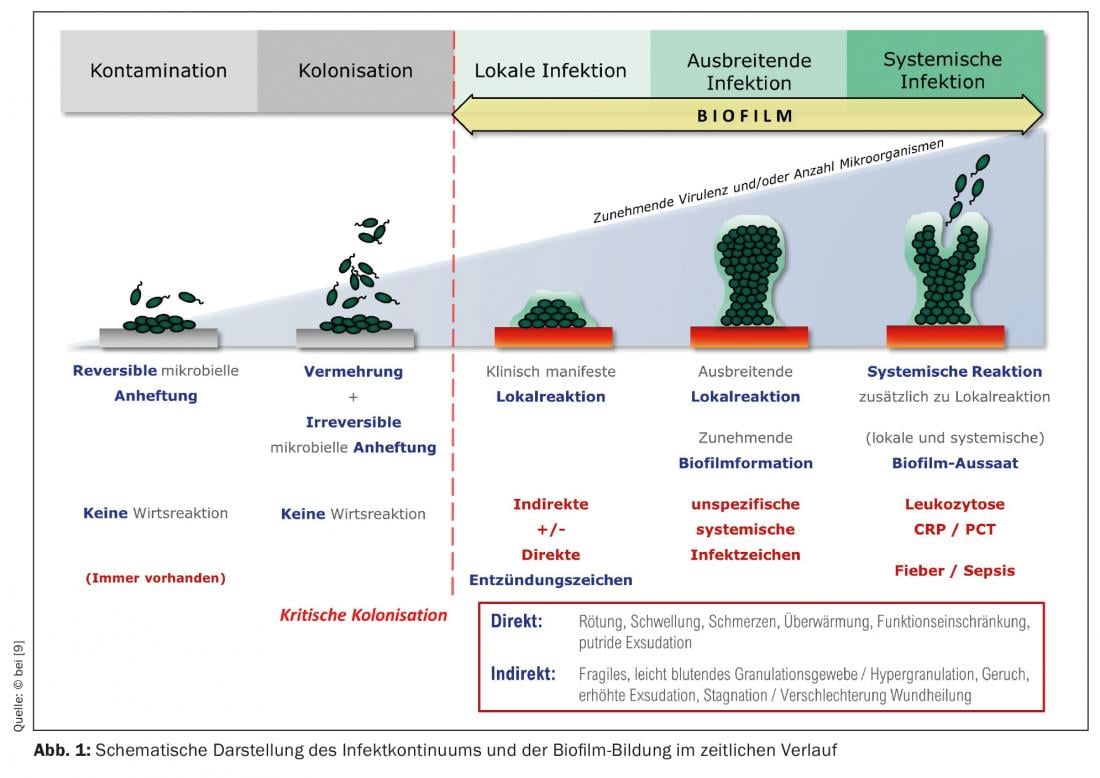
I cosiddetti biofilm immaturi possono formarsi da queste colonie batteriche in sole 24 ore (Fig. 1). Nella maggior parte dei casi, questi biofilm non sono costituiti da una sola specie batterica (come nel caso dei biofilm degli impianti nella chirurgia ortopedica), ma contengono molte specie batteriche diverse, cioè un biofilm multispecie. Le specie batteriche principali nei biofilm delle ferite, qui utilizzando l’esempio delle ulcere delle gambe, sono lo Staphylococcus aureus (47,6%), la sua variante resistente alla meticillina (MRSA) (8,6%), lo Pseudomonas aeruginosa (31,1%) e gli enterobatteri (28,6%) [7]. Questi microrganismi – più raramente sono coinvolti anche i funghi – iniziano a circondarsi della cosiddetta sostanza extrapolimerica (EPS), quasi “murandosi dentro”. L’EPS è costituito principalmente da polisaccaridi (ad esempio, alginato, cellulosa, destrano) e da una varietà di proteine, lipidi, glicoproteine, glicolipidi [8], ossia zuccheri e proteine, che lo fanno aderire saldamente al letto della ferita. Dopo 2-4 giorni, si parla di “biofilm maturo”. Può diventare spesso fino a 2 mm, cioè plastico e visibile. (Fig. 2A/B). In questa fase, il biofilm è in grado di rilasciare i batteri planctonici (sospesi nel liquido) con l’essudato della ferita, che viene prodotto in abbondanza a causa dell’infiammazione. (Fig. 1), che possono colonizzare l’ambiente della ferita o altre ferite [9]. Qui ricomincia il ciclo di formazione del biofilm.
Riconoscere il biofilm della ferita
Il primo e più importante passo è la diagnosi clinica, cioè considerare la possibilità di colonizzazione da biofilm della ferita (cronica) come fattore di interferenza nella guarigione. Il biofilm maturo può essere facilmente identificato e verificato clinicamente mediante l’esplorazione della ferita (bordo) con l’uso di pinze o curette (Fig. 2A/B) . Lo stesso biofilm della ferita fornisce una risposta immunitaria o un’infiammazione duratura, più o meno pronunciata, a livello locale. Può essere alla base di un’infezione della ferita, ma può anche persistere per settimane e mesi senza indurla.
Nelle ferite con persistenza del biofilm nudo, di solito non si riscontra un danno (tissutale) pronunciato, a parte la mancanza di guarigione, perché le varie specie microbiche del biofilm vivono in simbiosi con un metabolismo ridotto e una proliferazione ridotta e si nutrono dell’essudato della ferita (umana). D’altra parte, esistono anche biofilm della ferita molto aggressivi, ad esempio quelli dominati da P. aeruginosa , che portano a una grave essudazione e a una dermatite ambientale, che di conseguenza provoca un allargamento della ferita. È comune un forte odore di ferita che accompagna la ferita.
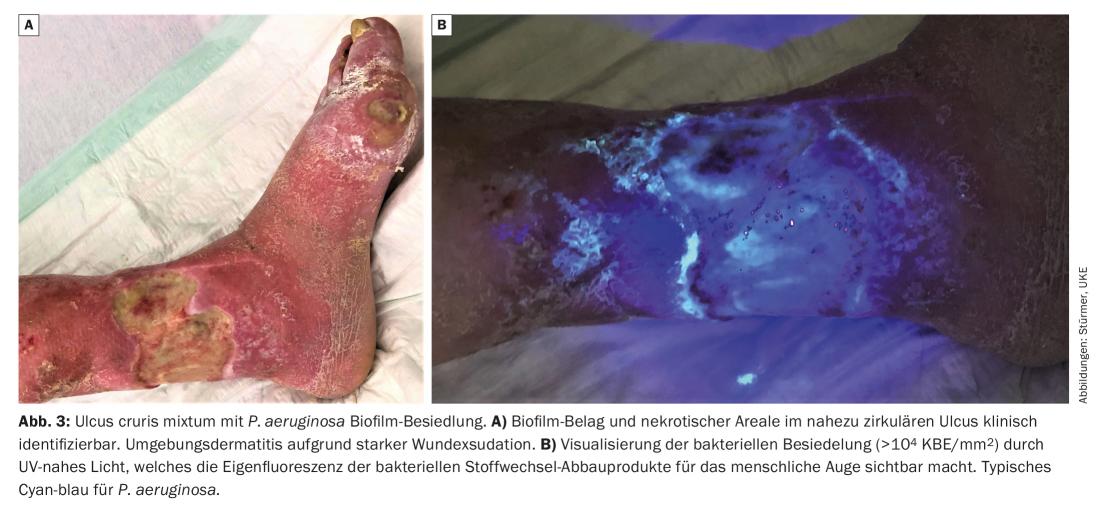
Un biofilm della ferita o una forte colonizzazione batterica della ferita (>104 CFU/mm2) possono essere resi visibili all’occhio umano utilizzando la luce UV-near (ad esempio, MolecuLight®, MolecuLight Corp., Toronto, Canada) (Fig. 3) : Utilizzando la luce di lunghezza d’onda 450 nm, le aree ad alta attività metabolica batterica possono essere visualizzate grazie alla fluorescenza rossa dei prodotti metabolici batterici depositati, come le porfirine (ad esempio, da… Staphylococcus Spp. ed Enterobacteriaceae) o dalla fluorescenza ciano-blu della pioverdina secreta da Pseudomonas Spp. [10]. Da molte ferite è stato possibile rilevare che P. aeruginosa colonizza e infiltra prevalentemente il margine della ferita, mentre S. aureus è più probabile che si trovi alla base della ferita.
La terapia del biofilm della ferita
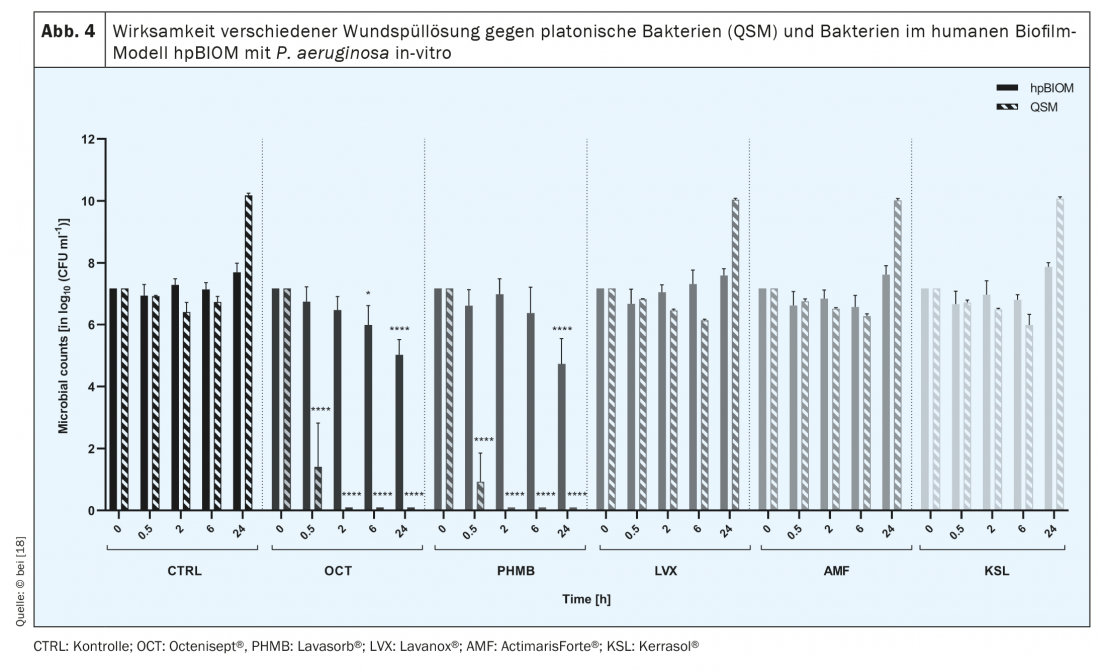
La comunità simbiotica e interspecie di microrganismi da cui si formano i biofilm produce una sostanza protettiva, cosiddetta extrapolimerica (EPS), che funziona come barriera biochimica contro il sistema immunitario dell’ospite e, in particolare, contro gli agenti antimicrobici [11,12]. Pertanto, questi ultimi spesso falliscono nell’eradicazione del biofilm [13–15] (Fig. 4) . Attraverso le molecole di segnalazione, i microrganismi possono anche comunicare tra loro, ad esempio per modificare la loro attività metabolica [13,15]. Una minore attività metabolica di specifici batteri, le cosiddette cellule persister nella profondità del biofilm, così come l’interazione di diversi microrganismi, ad esempio attraverso il trasferimento genico di resistenza laterale, sono ulteriori aspetti che contribuiscono all’elevata resilienza dei biofilm [17]. La sua “tolleranza” alle sostanze antimicrobiche, alle soluzioni e alle medicazioni è elevata, poiché queste portano all’induzione della morte cellulare di batteri e funghi, ma non alla distruzione dell’EPS. In questo modo, gli agenti antimicrobici non possono dispiegare la loro efficacia contro i microrganismi, poiché – a causa dello ‘scudo protettivo’ dell’EPS – non riescono nemmeno a penetrarvi [15]. Lo stesso vale per gli antibiotici applicati per via sistemica, che, a causa dell’EPS, non possono penetrare abbastanza in profondità nel biofilm della ferita dall’interno, cioè dal letto della ferita, per eliminare completamente i germi patogeni. Non solo per questo motivo, ma in generale, la prescrizione di antibiotici nella terapia delle ferite croniche deve essere considerata in modo critico, per evitare lo sviluppo di resistenze nel lungo processo di guarigione delle ferite croniche.
Biofilm della ferita e soluzioni di irrigazione della ferita (antimicrobiche)
Esistono diversi approcci per eliminare la colonizzazione da biofilm delle ferite [17]. Ad esempio, si consigliano le soluzioni antimicrobiche disponibili in commercio che hanno dimostrato di essere efficaci nelle analisi in vitro. Tuttavia, l’osservazione clinica a volte contraddice le prestazioni antimicrobiche dichiarate (Fig. 4).
Esistono diversi tipi di soluzioni per l’irrigazione delle ferite: con alcune, come la soluzione fisiologica o NaCl, l’attenzione si concentra sull’effetto detergente e diluente; con gli altri gruppi, sull’efficacia antimicrobica più o meno pronunciata. È noto che alcune soluzioni per l’irrigazione delle ferite perdono il loro potenziale antimicrobico quando entrano in contatto con ambienti ricchi di proteine, come quelli dell’essudato della ferita [19]. Di conseguenza, varia anche l’efficacia delle diverse soluzioni di irrigazione delle ferite contro i biofilm batterici, con l’EPS che agisce anche come “scudo protettivo”. Le soluzioni antimicrobiche per l’irrigazione delle ferite affrontano e distruggono le pareti, le membrane e le proteine di trasporto batteriche o ne inibiscono la funzione. Se non riescono a fare breccia nell’EPS, che consiste principalmente di polisaccaridi e proteine, non possono lavorare in modo efficace.
Non esistono studi clinici comparativi con soluzioni di irrigazione delle ferite (antimicrobiche), che potrebbero essere la base per raccomandazioni terapeutiche differenziate. Tuttavia, i test traslazionali sistematici condotti sul modello di biofilm umano hpBIOM dimostrano che Octenisept® è in grado di rompere i biofilm e di uccidere i batteri in essi contenuti entro 72 ore (!). [15,18] (Fig. 5). Il PHMB riesce in misura limitata nello stesso periodo, ma l’eradicazione completa non viene raggiunta nemmeno dopo 72 ore. Le soluzioni ipoclorose per l’irrigazione delle ferite e la clorexidina non riescono a eliminare efficacemente i batteri nel biofilm [18].
Biofilm della ferita e medicazioni antimicrobiche
Le ferite colonizzate da biofilm si dividono fondamentalmente in due tipi: Ferite con biofilm residente e meno aggressivo. Queste sono caratterizzate da un ambiente tranquillo della ferita con un’essudazione da leggera a moderata (Fig. 2) . L’altro tipo di biofilm della ferita mostra una forte essudazione che richiede cambi di medicazione giornalieri. L’accompagnamento di gonfiore, arrossamento, elevata sensibilità dell’intera regione della ferita e spesso anche una dermatite circostante sono obbligatori (Fig. 3). Pertanto, in questi pazienti, occorre prestare particolare attenzione alla pelle circostante la ferita, che deve essere trattata (ad esempio con pomate a base di urea, zinco o cortisone a basso dosaggio).
Gli studi clinici comparativi con medicazioni (antimicrobiche) sono rari [20]. È difficile ricavarne raccomandazioni terapeutiche differenziate, poiché non solo variano i principi attivi (ioni d’argento, argento nanocristallino, PHMB, derivati dello iodio, ecc.) e le loro concentrazioni, ma anche le rispettive basi delle medicazioni (schiuma PU, alginati, fibre, ecc.). Molteplici test in vitro, utilizzando un modello di biofilm umano, hanno dimostrato che un prodotto combinato di iodio e amido (iodio cardexomero) era in grado di eradicare completamente i batteri nel biofilm entro 6 (!) giorni (Fig. 5). Altre medicazioni contenenti PHMB o argento (MP classe 2B) hanno ridotto solo la carica batterica [21]. Tuttavia, le medicazioni antimicrobiche sono state analizzate per 6 giorni senza cambi; un’efficacia maggiore dovrebbe essere raggiunta da tutte le medicazioni testate con cambi di medicazione giornalieri o di 2 giorni.
Biofilm della ferita e sbrigliamento (brusco)
Il debridement chirurgico o tagliente costante è attualmente l’unica terapia efficace e sostenibile per il biofilm della ferita, raccomandata dal consenso degli esperti [6]; tuttavia, non è sempre un’opzione praticabile nel contesto dell’assistenza domiciliare (ad esempio, igiene limitata, pazienti trattati con farmaci e anticoagulati). L’applicazione di questa terapia locale relativamente aggressiva anche alle ferite “tranquille” con colonizzazione da biofilm (Fig. 2) richiede talvolta un certo sforzo da parte dell’operatore: Dopo la rimozione della medicazione, la ferita deve essere ispezionata per verificare l’eventuale colonizzazione del biofilm visivamente o con l’ausilio della suddetta luce UV, al fine di rimuoverla con una curette e/o un bisturi, se necessario. Solo dopo la sua rimozione, le sostanze antimicrobiche presenti nelle soluzioni e nelle medicazioni delle ferite possono agire efficacemente contro i microrganismi patogeni rimanenti.
Lo sbrigliamento chirurgico è spesso indicato quando è necessario rimuovere il tessuto necrotico oltre al biofilm della ferita [22]. Viene eseguita in anestesia di conduzione o intubazione. Rispetto allo sbrigliamento acuto, è più invasivo e rimuove anche parti del margine della ferita e del letto della ferita utilizzando un bisturi e un rasoio. All’inizio, le dimensioni della ferita aumentano di conseguenza. Un’altra opzione per rimuovere il biofilm della ferita è lo sbrigliamento chimico (ad esempio, Debrichem®), che elimina efficacemente i batteri ma infiltra anche il letto e il margine della ferita. Qui vengono uccisi i batteri profondi, ma sono coinvolte anche le cellule umane, per cui anche in questo caso l’effetto primario è l’allargamento della ferita [23,24].
Conclusione
Il biofilm (batterico) della ferita richiede una terapia complessa a livello locale, perché è costituito da diversi “componenti”. È importante rendersi conto che si trova su oltre il 75% di tutte le ferite croniche e può quindi essere rimosso. La pulizia della ferita con la sola soluzione di irrigazione e l’impacco non è sufficiente. La persistenza della colonizzazione del biofilm causa il ristagno della guarigione della ferita. Indipendentemente dalla terapia locale, tuttavia, la malattia di base che ha portato alla cronicizzazione della ferita deve sempre essere trattata in modo causale. Di conseguenza, una ferita popolata da biofilm e fortemente essudante non costituisce una controindicazione alla terapia compressiva indicata dal medico (ad esempio nella CVI, nel linfedema o nel lipoedema).
Messaggi da portare a casa
- La diagnosi e il trattamento della condizione di base sono sempre essenziali nei pazienti con ferite croniche.
- Circa il 78% di tutte le ferite croniche è colonizzato da microrganismi patogeni sotto forma di biofilm.
- Le specie batteriche principali nei biofilm delle ferite sono S. aureus e P. aeruginosa.
- Le soluzioni di irrigazione delle ferite e le medicazioni antimicrobiche affrontano e uccidono i batteri. Tuttavia, spesso non riescono a penetrare l’EPS del biofilm, che consiste principalmente di polisaccaridi e proteine, e quindi non possono agire efficacemente.
- Il debridement tagliente o chirurgico costante è attualmente l’unico trattamento efficace e sostenibile del biofilm della ferita raccomandato dal consenso degli esperti.
Letteratura:
- Noskin GA, Rubin RJ, Schentag JJ, et al: Tendenze nazionali nei tassi di infezione da Staphylococcus aureus: impatto sul carico economico e sulla mortalità in un periodo di 6 anni (1998-2003). Clin Infect Dis 2007; 45(9): 1132-1140.
- James GA, Swogger E, Wolcott R, et al: Biofilm nelle ferite croniche. Wound Repair Regen 2008; 16(1): 3-44.
- Heyer K, Herberger K, Protz K, et al: Epidemiologia delle ferite croniche in Germania: analisi dei dati dell’assicurazione sanitaria obbligatoria. Wound Repair Regen 2016; 24(2): 434-442.
- Hachenberg T, Senturk M, Jannasch O, Lippert H: [Infezioni della ferita postoperatoria. Fisiopatologia, fattori di rischio e concetti di prevenzione]. Anaesthesist 2010; 59(9): 851-866; quiz 867-858.
- Augustin M SrE, Dissemond J, Gerber V, et al.: Raccomandazioni per migliorare la struttura dell’assistenza alle persone con ferite croniche in Germania. Gestione delle ferite 2020; 14: 357-365.
- Malone M, Bjarnsholt T, McBain AJ, et al: La prevalenza dei biofilm nelle ferite croniche: una revisione sistematica e una meta-analisi dei dati pubblicati. J Wound Care 2017; 26(1): 20-25.
- Jockenhofer F, Gollnick H, Herberger K, et al.: Spettro patogeno batteriologico delle ulcere croniche delle gambe: risultati di uno studio multicentrico in centri di cura delle ferite dermatologiche differenziati per regioni. J Dtsch Dermatol Ges 2013; 11(11): 1057-1063.
- Flemming HC, Wingender J.: La matrice del biofilm. Nat Rev Microbiol 2010; 8(9): 623-633.
- Rembe JD, Stuermer EK: La moderna antisepsi delle ferite – indicazioni e limiti, tra conoscenza, desiderio e incertezza. Chirurgia vascolare 2020; 25: 272-276.
- Stuermer EK, Besser M, Debus ES, et al: Infiltrazione batterica nelle ferite colonizzate da biofilm: analisi nel modello di ferita ex vivo hpBIOM e possibile impatto sul tamponamento e sullo sbrigliamento. Int Wound J 2022 (in revisione).
- Thurlow LR, Hanke ML, Fritz T, et al.: I biofilm di Staphylococcus aureus impediscono la fagocitosi dei macrofagi e attenuano l’infiammazione in vivo. J Immunol 2011; 186(11): 6585-6596.
- Cowan T: Biofilm e loro gestione: dal concetto alla realtà clinica. J Wound Care 2011; 20(5): 220, 222-226.
- Larsen T, Fiehn NE.: Resistenza dei biofilm di Streptococcus sanguis agli agenti antimicrobici. APMIS 1996; 104(4): 280-284.
- Percival SL, Salisbury AM, Chen R: Argento, biofilm e ferite: resistenza rivisitata. Crit Rev Microbiol 2019; 45(2): 223-237.
- Besser M, Dietrich M, Weber L, et al.: Efficacia degli antisettici in un nuovo modello di biofilm plasmatico umano tridimensionale (hpBIOM). Sci Rep 2020; 10(1): 4792.
- Williams P, Winzer K, Chan WC, Camara M: Senti chi parla: comunicazione e quorum sensing nel mondo batterico. Philos Trans R Soc Lond B Biol Sci 2007; 362(1483): 1119-1134.
- Johani K, Malone M, Jensen SO, et al.: Valutazione di brevi tempi di esposizione di soluzioni antimicrobiche per ferite contro i biofilm microbici: da in vitro a in vivo. J Antimicrob Chemother 2018; 73(2): 494-502.
- Rembe JD, Huelsboemer L, Plattfaut I, et al: Le soluzioni antimicrobiche ipoclorose per l’irrigazione delle ferite dimostrano una minore efficacia anti-biofilm contro il biofilm batterico in un modello complesso di biofilm plasmatico umano in-vitro (hpBIOM) rispetto ai comuni antimicrobici per ferite. Front Microbiol 2020; 11: 564513.
- Rembe JD, Fromm-Dornieden C, Stuermer EK: L’influenza del liquido delle ferite acute umane (AWF) sull’efficacia antibatterica di diverse medicazioni antisettiche in schiuma di poliuretano: un’analisi in vitro. Wound Repair Regen 2018; 26: 27-35.
- Schwarzer S, James GA, Goeres D, et al: L’efficacia degli agenti topici utilizzati nelle ferite per gestire le infezioni croniche da biofilm: una revisione sistematica. J Infect 2020; 80(3): 261-270.
- Stuermer EK, Plattfaut I, Dietrich M, et al: Attività in vitro delle medicazioni antimicrobiche per ferite sul biofilm della ferita di P. aeruginosa. Front Microbiol 2021; 12: 664030.
- Dissemond J, Bültemann A, Gerber V, et al.: Documento di posizione dell’Initiative Chronische Wunde (ICW) e.V. sulla nomenclatura dello sbrigliamento delle ferite croniche. Hautarzt 2022; 24 [Online ahead of print].
- Schwarzer S, Radzieta M, Jensen SO, Malone M: Efficacia di un agente topico per ferite, l’acido metano-solfonico e il dimetilsulfossido, sui biofilm in vitro. Int J Mol Sci 2021; 22: 9471.
- Cogo A, Quint BJ, Bignozzi CA: Riavviare il processo di guarigione delle ferite croniche utilizzando un nuovo essiccante: una serie di casi prospettici. Ferite 2021; 33: 1-8.
PRATICA DERMATOLOGICA 2022; 32(2): 6-11













