Il carcinoma ovarico epiteliale è un gruppo eterogeneo di carcinomi che hanno un’eziologia, una genetica e quindi una prognosi biologica diverse. Negli stadi avanzati (IIB-IV), la terapia standard rimane la terapia citoriduttiva massimale, pesando la morbilità e continuando rapidamente la chemioterapia con carboplatino/paclitaxel. La chemioterapia adiuvante rimane carboplatino e paclitaxel (q3w o q1w). Nella situazione R1 o nello stadio IV, il bevacizumab dovrebbe essere somministrato anche durante la terapia e continuato come terapia di mantenimento, in quanto ha dimostrato un beneficio di sopravvivenza di circa nove mesi. L’individualizzazione della terapia in base alla biologia di base è essenziale, pertanto è necessario il coinvolgimento di tutti gli esperti e di un team interprofessionale e interdisciplinare in un centro tumori.
Circa 200.000 donne in tutto il mondo sviluppano un tumore ovarico epiteliale (EOC). Circa il 60-70% dei pazienti viene diagnosticato in uno stadio avanzato (stadio FIGO III-IV). Di questi pazienti, circa il 70% soffre di una recidiva, che di solito significa una situazione controllabile ma non più curativa. La prognosi negli stadi avanzati è modesta, con un tasso di sopravvivenza a 5 anni del 50%. Negli stadi iniziali (FIGO I-IIA), i pazienti di solito guariscono dopo un’adeguata stadiazione chirurgica e una terapia adiuvante con sistema contenente platino (studio ACTION). Tuttavia, i tassi di incidenza e di mortalità europei standardizzati per età sono cambiati solo leggermente negli ultimi 40 anni, nonostante il miglioramento della sottospecializzazione chirurgica e i nuovi farmaci di seconda linea.
Sintomatologia
I sintomi dell’EOC sono solitamente aspecifici e compaiono tardivamente. I sintomi più frequentemente lamentati sono spesso di origine gastrointestinale: meteorismo, cambiamento delle abitudini delle feci, difficoltà di minzione e aumento della circonferenza addominale. Il segno clinicamente più importante è un tumore solido, irregolare e fisso nella pelvi, che può essere delineato all’esame ginecologico.
Sottotipi istologici
I sottotipi istologici del carcinoma ovarico sono morfologicamente ben delineati: sieroso (75-80%), endometrioide (10%), mucinoso (10%), a cellule chiare (1%), a cellule transizionali (1%) e indifferenziato (1%). Non solo questi istotipi differiscono puramente morfologicamente, ma mostrano anche un modello biologico comportamentale diverso, che è rappresentato, tra l’altro, da una chiara distinzione genetica a livello di mRNA [1]. Anche il decorso clinico varia a seconda dei sottotipi biologici. Pertanto, la prognosi dell’EOC endometrioide è significativamente migliore rispetto a quella dell’EOC mucinoso [2]. In futuro, la terapia dovrà essere sempre più orientata verso i sottotipi biologici, per ottenere prognosi migliori.
Per molto tempo, si è pensato che il carcinoma ovarico fosse più probabile che si verificasse sporadicamente e che fosse ereditario solo nel 10-15% dei casi. Le mutazioni ereditarie rilevanti per il cancro ovarico sono nei geni BRCA1 (chr. 17,60%) e BRCA2 (chr. 13,30%), così come le mutazioni nei geni di riparazione dei mismatch del DNA MLH1, MSH2, MSH6, PMS1, PMS2 (5%), che causano anche il “cancro del colon umano non poliposico” (HNPCC) o la sindrome di Lynch [3]. Un recente studio australiano ha dimostrato che il 20% di tutti i carcinomi sierosi presenta una mutazione nel gene BRCA1 o -2 [4]. Nei carcinomi sierosi indifferenziati, sappiamo che esiste il cosiddetto fenotipo “BRCAness”. Poiché sia BRCA che PARP svolgono un ruolo nella modificazione della resistenza tumorale, il trattamento con i cosiddetti inibitori di PARP è centrale e probabilmente aumenterà in futuro.
Le nostre conoscenze sullo sviluppo del cancro ovarico sono state rivoluzionate nel 2007, quando sono stati asportati gli annessi di portatori di mutazioni BRCA1/2 e sono stati scoperti carcinomi tubarici in situ precoci. Questo ha portato alla consapevolezza che una percentuale significativa di carcinomi ovarici sierosi probabilmente ha origine dalla tuba. In precedenza, si era ipotizzato che l’epitelio superficiale monostrato che ricopre l’ovaio fosse alterato dall’ovulazione costante e producesse cisti di inclusione metaplastiche alterate [5, 6].
Terapia del cancro ovarico
La terapia del tumore ovarico è multimodale e comprende la chirurgia e la chemioterapia o la terapia target, oltre alla radioterapia in passato.
Già negli anni ’40 è stato postulato per la prima volta che la resezione completa di tutti i residui tumorali è essenziale per la prognosi. Ma è solo con la sottospecializzazione di ginecologi speciali come oncologi ginecologici che è stato possibile eseguire la chirurgia di debulking al di sotto dei 2 cm. In questo caso, se possibile, si dovrebbe puntare a una citoriduzione completa piuttosto che ottimale [7, 8]. Secondo il vecchio GCIG (Gynecological Cancer Intergroup) Consensus condotto nel 2010, un debulking ottimale è un focus tumorale residuo <1 cm (ottenibile nel 47%) [9]. Nella nuova definizione di consenso del GCIG, tuttavia, il debulking ottimale corrisponde all’assenza di tumore residuo macroscopicamente visibile (ottenibile solo nel 34%) [10].
Diversi studi hanno dimostrato che la sopravvivenza dipende in modo significativo dal volume del tumore residuo. Una meta-analisi di Bristow con oltre 6000 pazienti del 2002 ha mostrato chiaramente la correlazione lineare tra l’estensione della citoriduzione e il numero di pazienti.
Sopravvivenza su [8]. Gli attuali temi di discussione riguardano il grado di aggressività del debulking, ad esempio dell’addome superiore [11] o dei linfonodi. Nello studio di un grande centro tumori statunitense, è stato dimostrato che la citoriduzione completa era possibile nell’85,3% e la citoriduzione ottimale (<1 cm) in un ulteriore 13,5%. Tuttavia, questo è stato possibile solo con un aumento massiccio della morbilità dovuto a procedure aggiuntive estese, ad esempio resezioni rettosigmoidee (52,1%), stripping del diaframma (40,5%), ablazione di impianti peritoneali (89%) o splenectomie, resezioni epatiche e pancreatectomie distali (19%) [7]. Poiché la terapia dell’EOC non comprende solo il debulking chirurgico, ma anche la pronta continuazione della terapia con la chemioterapia, sembra discutibile l’utilità di un debulking prolungato con un’elevata morbilità e il ritardo di diversi mesi della successiva chemioterapia, soprattutto nei pazienti di età avanzata.
Al momento, non ci sono studi che abbiano dimostrato un beneficio della linfonodectomia. Questo è particolarmente vero nel caso di un tumore residuo, indipendentemente dal volume. Un’analisi retrospettiva di pazienti di vari studi AGO-OVAR (n=3388) ha mostrato un piccolo beneficio in termini di sopravvivenza globale nel 51,3% dei pazienti con riduzione ottimale del tumore, quando è stata eseguita una linfonodectomia pelvica/paraortica sistematica [12]. A parte questa osservazione retrospettiva, tuttavia, non ci sono dati prospettici che dimostrino la situazione di fatto.
Terapia chirurgica
Il trattamento chirurgico dell’EOC deve sempre essere eseguito con una laparatomia longitudinale, se si sospetta urgentemente una malignità. La laparascopia non ha alcun valore nel trattamento primario dell’EOC e aumenta il rischio di rottura del tumore o della cisti. Se si verifica una rottura iatrogena intraoperatoria del tumore, la prognosi peggiora con un “upstaging” a uno stadio IC. Il trattamento del tumore deve sempre includere una stadiazione completa in fase iniziale e un debulking in fase avanzata, poiché questo è anche prognostico. Si possono fare dei compromessi nella chirurgia di conservazione della fertilità con un’adenectomia unilaterale. Tuttavia, in caso di stadiazione incompleta, nel 30% dei casi si verifica un “upstaging” nella seconda operazione. La Tabella 1 mostra i requisiti per la terapia chirurgica, compresa la chirurgia di conservazione della fertilità nella fase iniziale. Poiché i carcinomi mucinosi avanzati sono di solito di origine non ovarica, si deve sempre eseguire un’appendicectomia e un’esplorazione estesa dell’intestino/stomaco [13].

A differenza del trattamento dell’EOC precoce, il trattamento dell’EOC avanzato è progettato per massimizzare la chirurgia citoriduttiva. Dopo lo stadio FIGO, il resto del tumore dopo la resezione massima è il secondo fattore prognostico più importante.
Fattore. Tutte le lesioni tumorali visibili devono essere rimosse. Una resezione completa è chiaramente migliore di una resezione <di 1 cm (1-10 mm). Una meta-analisi dell’AGO ha mostrato che la resezione completa prolunga la sopravvivenza di 30 mesi nello stadio IV, di 47 mesi nello stadio IIIC e di 60 mesi nello stadio IIB-IIIB [14].
Anche la resezione intestinale, la resezione del diaframma e la resezione parziale del fegato possono migliorare l’esito, ma causano anche una corrispondente morbilità e mortalità e dovrebbero essere eseguite solo da oncologi ginecologi esperti.
Radioterapia
Negli anni ’80, la radioterapia è stata utilizzata come terapia adiuvante, perché ha mostrato un beneficio rispetto alla chemioterapia con ciclofosfamide. Tuttavia, oggi è stata messa in secondo piano dall’introduzione della chemioterapia contenente platino e, nonostante la sua buona efficacia, viene utilizzata solo raramente. Nella situazione palliativa, tuttavia, la radioterapia per il controllo dei sintomi ha ancora un ruolo importante e può anche essere presa in considerazione dopo una citoriduzione secondaria ottimale nella recidiva localizzata.
Chemioterapia
Oggi, la chemioterapia contenente platino è lo standard nel trattamento adiuvante del carcinoma ovarico e nella situazione di recidiva, con un intervallo appropriato (>6 mesi). Negli anni ’80, sono state valutate diverse terapie di combinazione, in particolare la combinazione di platino con ciclofosfamide o doxorubicina. Sono state studiate anche combinazioni triple, ma nel complesso hanno portato più tossicità che benefici ai pazienti.
Il secondo pilastro principale della chemioterapia è costituito dai taxani, inizialmente estratti dal tasso del Pacifico (Taxus brevifolia). La combinazione di carboplatino e paclitaxel è ancora lo standard nella chemioterapia adiuvante per il tumore ovarico ed è stata testata in diversi studi (GOG111, OV10, ICON3). Dal 2004 la combinazione di carboplatino/paclitaxel i.v. è stata lo standard mondiale basato sui dati dello studio. Questo è stato raccomandato anche in un documento di consenso [9].
Diversi studi hanno esaminato l’uso della chemioterapia nei gruppi a basso rischio rispetto a quelli ad alto rischio (GOG, ICON 1, ACTION). Le discussioni attuali ruotano intorno alla somministrazione della chemioterapia neoadiuvante (EORTC55971,
Studio CHORUS), la chemioterapia intraperitoneale (SWOG, GOG172), la somministrazione settimanale di paclitaxel (JGOG3016, MITO7, ICON8), la somministrazione aggiuntiva di terapie target, in particolare bevacizumab (ICON7, GOG218, AURELIA, OCEANS), nonché il cosiddetto “paclitaxel” in corso dopo la chemioterapia. “Mantenimento” – cioè chemioterapia di mantenimento con bevacizumab.
Gli studi di fase III che hanno preannunciato un cambiamento di paradigma nella terapia standard per il tumore ovarico avanzato nel corso dei decenni sono stati:
- GOG111 (n=386) e OV10 (n=680), che hanno confrontato cisplatino/ciclofosfamide con cisplatino/paclitaxel e hanno mostrato un vantaggio in termini di sopravvivenza per la combinazione paclitaxel.
- GOG158 (n=792) e OVAR3 (n=883), che hanno confrontato cisplatino/paclitaxel con carboplatino/paclitaxel e hanno mostrato un’efficacia simile con una migliore tollerabilità per il carboplatino.
- GOG172 (n=429), che ha confrontato la somministrazione di cisplatino/paclitaxel per via endovenosa con la somministrazione intraperitoneale e ha osservato una migliore efficacia, ma un aumento della tossicità e una riduzione della qualità di vita nei pazienti.
- JGOG3016 (n=637), che ha confrontato la combinazione carboplatino/paclitaxel come regime settimanale rispetto a un regime trisettimanale con taxolo e ha mostrato un vantaggio in termini di sopravvivenza per il regime settimanale con paclitaxel.
- GOG218 (n=1873) e ICON7 (n=1528), che hanno studiato carboplatino/paclitaxel con placebo rispetto a carboplatino/paclitaxel con e senza bevacizumab continuato e hanno mostrato un significativo beneficio di sopravvivenza per i pazienti che avevano un carcinoma avanzato (FIGO III/IV) e non potevano essere operati in modo ottimale (ICON7).
Bevacizumab è il primo farmaco nell’elenco delle terapie elencate che è stato sviluppato come una nuova “terapia mirata” nel contesto dei test genetici nel cancro ovarico. Attacca i vasi tumorali legandosi al “fattore di crescita endoteliale vascolare” (VEGF), che a sua volta si lega all’omonimo recettore. Il VEGF è responsabile della sopravvivenza delle cellule endoteliali, delle anomalie vascolari, della stimolazione della crescita di nuovi vasi e dell’aumento della permeabilità vascolare [15]. È stato uno dei candidati principali nell’analisi dei geni disregolati nel cancro ovarico [16]. Il VEGF svolge un ruolo centrale nella normale ovulazione, l’angiogenesi stimolata dal VEGF è essenziale per la crescita tumorale e svolge un ruolo importante nello sviluppo del cancro ovarico, promuovendo i cambiamenti da crescita benigna a maligna e contribuendo alla formazione di metastasi peritoneali e alla produzione di ascite [17]. Non sorprende quindi che alti livelli di VEGF nel sangue siano associati a una prognosi peggiore. Attualmente esistono quattro studi di fase III sull’inibitore VEGF bevacizumab nel carcinoma ovarico, sia adiuvante (GOG-0218 e ICON7 [18, 19]) che palliativo di prima linea in situazioni sensibili e refrattarie al platino (OCEANS e AURELIA [20, Pujade-Lauraine ASCO 2012]).
Il trattamento degli stadi precoci (FIGO IA G1-FIGO IIA) del carcinoma ovarico comprende la chemioterapia contenente platino; questa migliora la prognosi di sopravvivenza di circa l’8% dopo cinque anni. I tumori di stadio IA G1 non dovrebbero ricevere la chemioterapia, poiché hanno una prognosi eccellente con la sola chirurgia. Tutti gli altri stadi precoci ricevono una chemioterapia con carboplatino/paclitaxel ogni tre settimane per un totale di quattro-sei cicli.
Nella terapia combinata carboplatino/paclitaxel, il paclitaxel può essere facoltativamente somministrato settimanalmente in modo “denso”. I dati giapponesi (JGOG3016) sono eccellenti, ma non è ancora chiaro in che misura i dati siano trasferibili ai pazienti europei, anche se non sono stati i carcinomi a cellule chiare ma quelli sierosi a mostrare la risposta. Lo studio europeo MITO7 non ha mostrato alcun beneficio in termini di PFS (sopravvivenza libera da progressione) con carboplatino e paclitaxel settimanali, ma una migliore tollerabilità.
I dati dello studio ICON8, che sta testando anche il concetto di dose-densa in un braccio, sono ora molto attesi.
Trattamento ricorrente
Circa il 70% delle pazienti con diagnosi di stadio avanzato FIGO III/IV subirà una recidiva nel corso dei primi cinque anni dopo la terapia adiuvante. Poi, purtroppo, c’è una situazione palliativa che di solito non ha alcuna possibilità di cura. A differenza degli ultimi decenni, tuttavia, la situazione delle recidive è caratterizzata dal fatto che le opzioni terapeutiche sono aumentate e spesso si può ottenere una situazione di recidiva stabile per anni.
Gli obiettivi della terapia delle ricadute devono includere il controllo dei sintomi, il prolungamento della sopravvivenza libera da sintomi e il mantenimento/miglioramento della qualità di vita. La gestione di questi pazienti sta diventando sempre più complessa, in quanto sono disponibili più dati, e la scelta del trattamento o della cauta attesa dipende da fattori individuali. Tuttavia, le decisioni terapeutiche dovrebbero essere basate sull’evidenza e provenire da studi randomizzati. Un nuovo intervento chirurgico ha senso solo per alcuni pazienti selezionati, cioè se, ad esempio, il paziente non è in grado di gestire un’emergenza.
- Il paziente è libero da recidive da più di due anni.
- Il tumore sembra completamente resecabile
- È presente un coinvolgimento linfonodale isolato
- Non sono presenti ascite o carcinomatosi peritoneale
- Il paziente mostra una buona performance.
I dati prospettici sulla riresezione sono attualmente in fase di generazione nello studio DESKTOP-III. Questo studio esamina in modo casuale il valore della riresezione per la recidiva sensibile al platino. L’esperienza è già stata acquisita nello studio DESKTOP-II ed è stato sviluppato un punteggio predittivo per l’operabilità [21].
Le nuove opzioni chemioterapiche per il carcinoma ovarico recidivato, sia nella situazione sensibile al platino che in quella refrattaria al platino, possono essere la somministrazione aggiuntiva di bevacizumab o la somministrazione settimanale di paclitaxel. La Tabella 2 mostra gli attuali sviluppi nel campo dell’anti-angiogenesi nella terapia iniziale e nella terapia delle recidive.
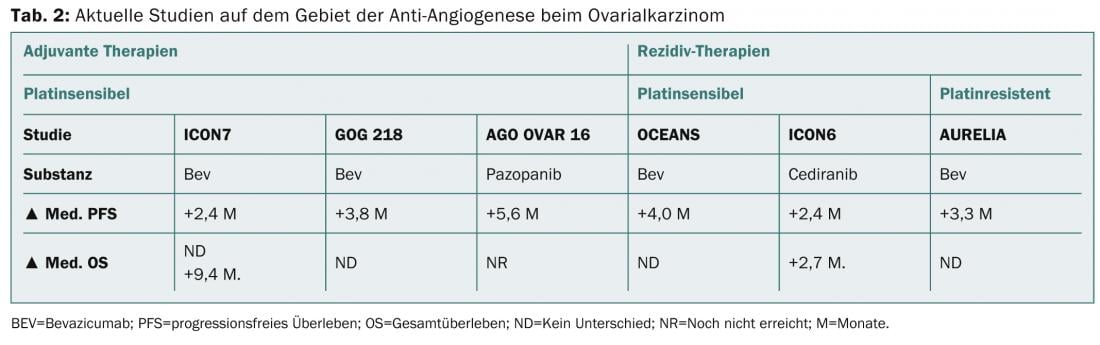
Nel caso di pazienti refrattari alla terapia, è necessaria anche una buona assistenza palliativa, che è già stata inclusa nelle decisioni terapeutiche precedenti. La prognosi in questa situazione è solitamente molto scarsa (<sopravvivenza a 1 anno) e il controllo dei sintomi è quindi la priorità.
In generale, nella scelta di un agente chemioterapico palliativo si devono considerare attentamente i seguenti cofattori: Tempo alla recidiva, agenti chemioterapici adiuvanti ricevuti, sintomi attuali, desideri e comfort del paziente (alopecia?), condizioni generali, comorbidità, tolleranza della chemioterapia precedente, tossicità residua (polineuropatia) e funzione degli organi. Se lo stato ECOG dei pazienti con tumori sensibili al platino è buono, è indicata una combinazione contenente platino con un taxano/antraciclina, in quanto vi è un miglioramento della prognosi rispetto alla terapia singolare con platino [22]. In genere si raccomanda l’inclusione di questi pazienti in un eventuale studio clinico.
A causa della crescente complessità, una paziente con tumore ovarico dovrebbe sempre essere trattata in un team interdisciplinare interprofessionale nell’ambito di un centro di tumori ginecologici. Questo ha il vantaggio non solo di una maggiore esperienza con questi pazienti, ma anche, in particolare, della stretta connessione delle singole discipline e del coordinamento ottimale delle misure di supporto e terapeutiche.
Marcus Vetter, MD
Prof. Dr. med. Viola Heinzelmann-Schwarz
Letteratura:
- Heinzelmann-Schwarz VA, et al: Br J Cancer 2006; 94(6): 904-913.
- Winter III WE, et al: JCO 20 agosto 2007; 25(24): 3621-3627.
- Burke W, et al: JAMA 1997; 277(12): 997-1003.
- Alsop K, et al: J Clin Oncol 2012; 30(21): 2654-2663.
- Auersperg N, et al: Endocr Rev 2001; 22(2): 255-288.
- Jarboe E, et al: Int J Gynecol Pathol 2008; 27(1): 1-9.
- Eisenkop SM, Friedman RL, Wang HJ: Gynecol Oncol 1998; 69(2): 103-108.
- Bristow RE, et al: Gynecol Oncol 2002; 86(2): 163-170.
- du Bois A, et al. (Intergruppo Cancro Ginecologico; AGO-OVAR; ANZGOG; EORTC; GEICO; GINECO; GOG; JGOG; MRC/NCRI; NCIC-CTG; NCI-US; NSGO; RTOG; SGCTG; IGCS; Team organizzativo dei due precedenti OCCC internazionali): Ann Oncol 2005; 16(8): viii7-viii12.
- Stuart GC, et al. (Partecipanti alla4ª Conferenza di consenso sul cancro ovarico (OCCC); Intergruppo sul cancro ginecologico): Int J Gynecol Cancer 2011; 21(4): 750-755.
- Barlin JN, et al: Gynecol Oncol 2013; 130(2): 284-288.
- du Bois A, et al. (Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens. Ruolo potenziale della linfoadenectomia nel carcinoma ovarico avanzato): J Clin Oncol 2010; 28(10): 1733-1739.
- Schilder JM, et al: Gynecol Oncol 2002; 87(1): 1-7.
- du Bois A, et al: Cancer 2009 Mar 15; 115(6): 1234-1244.
- Ferrara N: Endocr Rev 2004; 25(4): 581-611.
- Jacob F, et al: Biomark Med 2009; 3(6): 743-756.
- Belotti D, et al: Cancer Res 2003; 63(17): 5224-5229.
- Burger RA, et al. (Gruppo di Oncologia Ginecologica): N Engl J Med 2011; 365(26): 2473-2483.
- Perren TJ, et al. (Investigatori ICON7): N Engl J Med 2011; 365(26): 2484-2496.
- Aghajanian C, et al: J Clin Oncol 2012; 30(17): 2039-2045.
- Harter P, et al: Int J Gynecol Cancer 2011 Feb; 21(2): 289-295.
- Raja FA, et al: Ann Oncol 2013 Dec; 24(12): 3028-3034.
InFo Oncologia & Ematologia 2014; (2)1: 8-13











