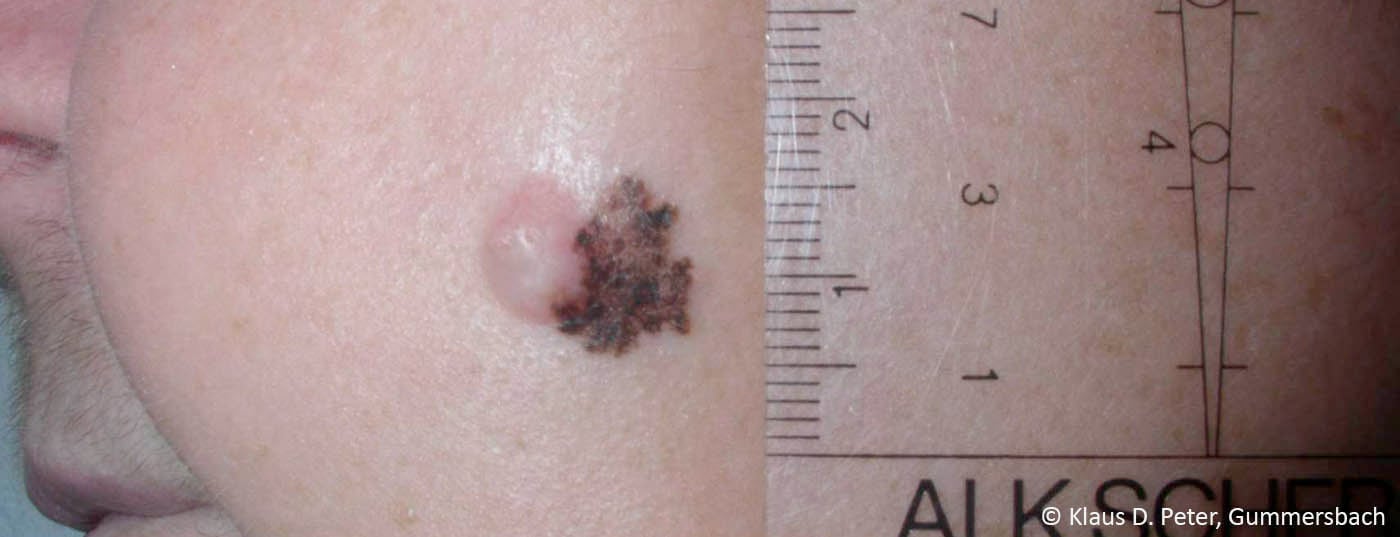
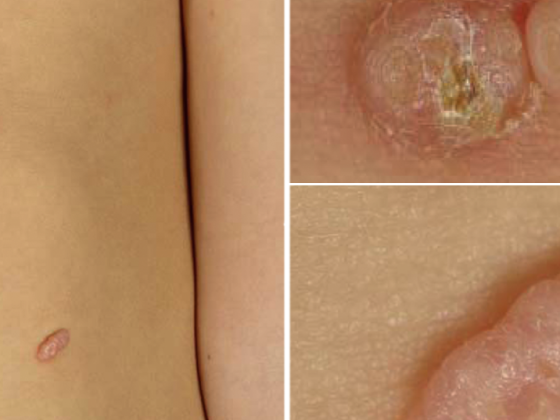
Le nuove scoperte nella biologia e nell’immunologia del tumore, così come nella patologia molecolare, hanno rapidamente spinto lo sviluppo di anticorpi immunomodulatori e dei cosiddetti farmaci “mirati” [1]. Ciò rende la terapia del melanoma avanzato una sfida interdisciplinare. Il trattamento moderno del melanoma avanzato è quindi sempre più personalizzato e si basa anche sullo stato di mutazione del tumore.
La resezione chirurgica rimane un’opzione valida per le metastasi d’organo solitarie e, come la gravosa perfusione degli arti con citostatici e interferone-α, può fornire una sopravvivenza libera da recidiva a lungo termine. Diverse chemioterapie, soprattutto per i melanomi senza una mutazione da indirizzare terapeuticamente, includono ad esempio dacarbacina, vinblastina, cisplatino, taxolo e bleomicina, occasionalmente anche il tamoxifene come terapia ormonale. I tassi di risposta moderati sono a scapito della tossicità, senza incidere significativamente sulla sopravvivenza globale. La temozolomide, un alchilano con un tasso di risposta paragonabile alla dacarbazina, può essere spesso utilizzata per le metastasi cerebrali grazie alla sua penetrabilità nel liquido cerebrospinale (CSF), sebbene meno del 10% dei pazienti abbia una risposta oggettiva a questa terapia.
Immunoterapie
A causa della natura antigenica e immunogenica del melanoma maligno, da tempo sono stati fatti vari tentativi terapeutici con sostanze immunomodulanti. Oltre ai vaccini peptidici (spesso con l’adiuvante oligonucleotide CpG), si stanno testando le citochine (ad esempio, l’IL-2 ricombinante) e si stanno sviluppando procedure di immunoterapia come il trasferimento adottivo di cellule T con i TIL (linfociti che infiltrano il tumore) e i linfociti del sangue periferico (PBL) o le cellule T “ingegnerizzate” geneticamente modificate (“recettore chimerico dell’antigene” e TCR). L’IL-2 ad alte dosi (e la combinazione IL-2 con gp100) ha portato a remissioni di lunga durata in un piccolo numero di pazienti, ma si è affermata soprattutto negli Stati Uniti [2]. Attualmente sono in corso diversi studi sul trasferimento adottivo di cellule T e sulle cellule modificate dal TCR, nonché sui blocchi del checkpoint.
Anticorpi CTLA-4: il metodo del blocco del checkpoint (ad esempio il blocco del CTLA-4) ha permesso di individuare nuovi bersagli per la terapia immunomodulante. L’antigene 4 associato ai linfociti T citotossici (CTLA-4) compete con il CD28 per il legame con le cellule presentanti l’antigene, portando all’inibizione dei segnali costimolatori per l’attivazione delle cellule T. Tuttavia, quando il CTLA-4 viene bloccato da un anticorpo monoclonale umano IgG1 specifico, come l’ipilimumab, viene rilasciato un “freno” delle cellule di difesa dell’organismo e la risposta tumorale mediata dalle cellule T viene potenziata. Ipilimumab (Yervoy®) è stato il primo anticorpo diretto contro CTLA-4 a mostrare una sopravvivenza significativamente prolungata in combinazione con un vaccino con peptide gp100 (sopravvivenza mediana 10,1 vs. 6,4 monte del vaccino di controllo) ed è stato approvato dall’EMA per il trattamento del melanoma metastatico dal 2011 [3]. Allo stesso modo, la combinazione di dacarbacina con blocco CTLA-4 ha portato a remissioni complete e durature (tasso di sopravvivenza a 3 anni circa 20%) e, nonostante un basso tasso di risposta (circa 15%), offre per la prima volta la prospettiva di una sopravvivenza a lungo termine. Poiché una risposta all’ipilimumab può verificarsi solo dodici settimane dopo l’inizio della terapia e il farmaco talvolta induce gravi effetti collaterali immuno-mediati, è uno svantaggio che nessun marcatore prognostico abbia ancora reso possibile la selezione dei pazienti. Pertanto, sono importanti la diagnosi precoce e la gestione tempestiva degli effetti collaterali delle comuni enterocoliti, epatiti, tiroiditi, ipofisiti, neuriti e dermatiti autoimmuni (tab. 1).
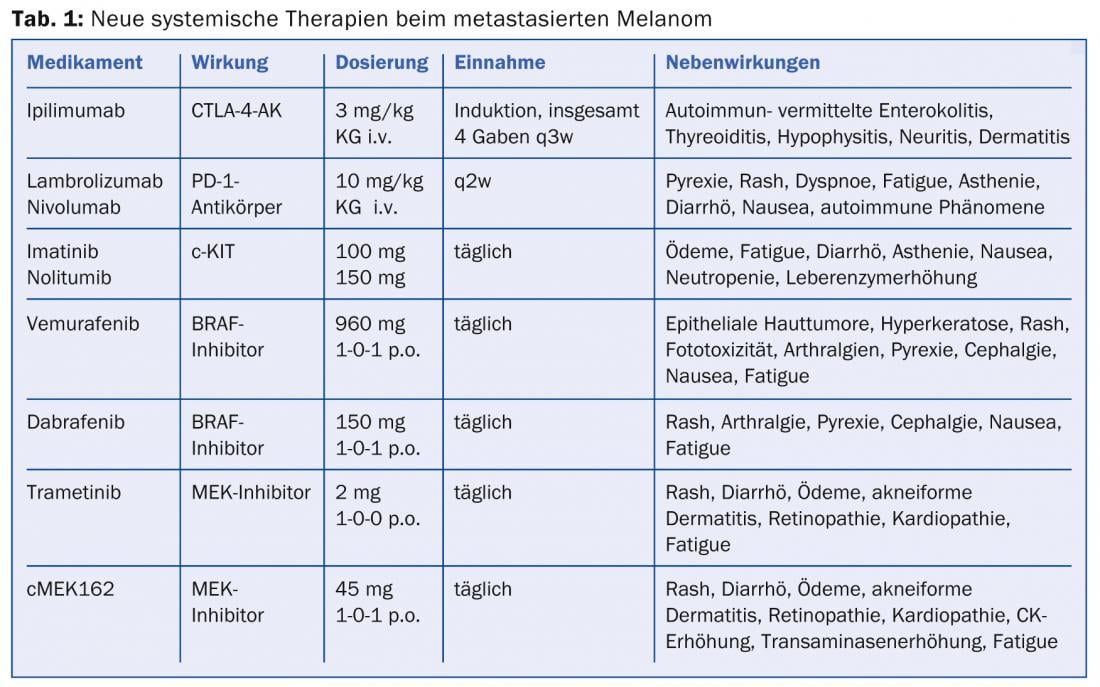
Anticorpi PD-1 e PD-L1 (PD-1 e PD-L1-AK): con l’obiettivo di ottimizzare ulteriormente la risposta immunitaria endogena contro le cellule tumorali, sono stati recentemente sviluppati anticorpi che inibiscono il recettore inibitorio “Programmed Death 1” (PD-1) sulla superficie delle cellule T attivate. Se la proliferazione delle cellule T è inibita dal legame del ligando PD-1 al recettore PD-1 della cellula T, gli anticorpi anti-PD-1 lambrolizumab e nivolumab, in fase di sperimentazione dal 2013, possono invertire questa restrizione della “fase effettrice”. I risultati degli studi iniziali con nivolumab hanno mostrato una risposta notevole nel 31% dei pazienti con melanoma pretrattati [4]. Analogamente al blocco del CTLA-4, anche gli anticorpi anti-PD-1 inducono remissioni stabili con un numero significativamente inferiore di effetti collaterali correlati all’autoimmunità. Inoltre, di solito si osserva una risposta poche settimane dopo l’inizio della terapia, e l’espressione del ligando PD-1 sulla superficie delle cellule tumorali è sospettata di essere un possibile biomarcatore predittivo. Il lambrolizumab e gli anticorpi diretti contro il ligando PD-1 (PD-L1-AK) sono attualmente in fase di sperimentazione clinica. Anche l’uso contemporaneo di anticorpi bloccanti CTLA-4 e PD-1 mostra effetti sinergici.
Terapia mirata basata sullo stato di mutazione
I metodi molecolari e le analisi mutazionali hanno rivelato diverse interfacce per il trattamento innovativo del melanoma metastatico nell’ultimo decennio. La mutazione più comune (circa il 50%) nelle cellule di melanoma è una mutazione puntiforme nel gene codificante la chinasi BRAF. BRAF è una chinasi importante nella via di segnalazione MAPK (“Mitogen-Activated Protein Kinase”) ed è in parte responsabile della proliferazione e della crescita delle cellule tumorali. Le mutazioni attivanti del gene BRAF V600 portano a un’iperattivazione di questa via di segnalazione, con conseguente crescita eccessiva delle cellule. Anche le mutazioni di NRAS, una chinasi situata a valle di BRAF, sono presenti fino al 20% dei pazienti con melanoma e, come BRAF, causano un peggioramento della prognosi. Un’altra mutazione piuttosto rara con conseguenze terapeutiche riguarda la tirosin-chinasi c-KIT, che si verifica prevalentemente nei melanomi mucosi e acrali. I pazienti con una mutazione c-KIT nell’esone 11 o 13 rispondono meglio al trattamento con un inibitore della chinasi c-KIT, come imatinib o nilotinib (studio TEAM). Gli effetti collaterali comuni della terapia sono edema, affaticamento, diarrea, perdita di appetito, nausea, neutropenia ed elevazioni degli enzimi epatici.
Inibitori BRAF
Anche la cosiddetta mutazione V600 BRAF è stata identificata come predittiva dal punto di vista terapeutico nel 40-50% dei tumori. Il primo inibitore BRAF clinicamente testato, vemurafenib (Zelboraf®), ha dato luogo a tassi di risposta elevati, pari a 5,6 responder completi nei pazienti naïve al trattamento con una mutazione V600E confermata. 51,3% di remissioni parziali e una sopravvivenza globale mediana di 13,2 mesi (aggiornamento dello studio BRIM-3) [5]. La risposta clinica di solito si presenta come una rapida riduzione del tumore, anche se mesi dopo si sviluppa spesso una resistenza dovuta alla riattivazione della via MAPK o all’upregulation di vie alternative.
Un altro inibitore di BRAF è dabrafenib (Tafinlar®), che ora è stato approvato (studio BREAK-3) per il trattamento di prima linea nel melanoma non resecabile o metastatico BRAF V600E-positivo [6,7]. Il fatto che si osservi una risposta tumorale efficace con dabrafenib in un’ampia percentuale di pazienti colpiti, per una media di otto mesi, migliora sia la qualità di vita che il tempo di sopravvivenza previsto e rappresenta una nuova esperienza nel trattamento del melanoma avanzato. Lo studio BREAK-MB ha anche dimostrato che i pazienti con metastasi cerebrali sperimentano almeno un raddoppio del tempo di sopravvivenza, altrimenti molto breve, grazie al trattamento con dabrafenib. I rischi derivanti dall’uso degli inibitori di BRAF includono talvolta la recidiva di tumori cutanei, pertanto i pazienti devono essere monitorati regolarmente per individuare tali tumori. Altri effetti collaterali, come tossicità cutanea e mucosa, infezioni, alterazioni dell’ECG e degli elettroliti e alterazioni della glicemia, possono richiedere l’interruzione della terapia. La cautela è indicata anche in combinazione con farmaci che influenzano l’attività enzimatica CYP3A4 o CYP2C8 e il pH gastrico, oltre alla somministrazione concomitante di warfarin o digossina.
Inibitori MEK
Essendo uno dei siti di commutazione centrali nella catena di segnalazione MAPK e trovandosi a valle di RAS-RAF, la chinasi MEK (isoforme MEK1/2) può essere attivata da mutazioni o da fattori di crescita autocrini. L’inibitore MEK1/2 altamente selettivo trametinib ha dimostrato di migliorare significativamente la sopravvivenza libera da progressione (PFS: 4,8 vs. 1,5 mesi) e la sopravvivenza globale nei pazienti con una mutazione BRAF V600E o V600K rispetto alla chemioterapia (studio METRIC) [8]. Finora non sono stati osservati carcinomi a cellule squamose con trametinib, come spesso accade con gli inibitori BRAF. In un altro studio, trametinib ha mostrato un effetto efficace anche sui melanomi con rare mutazioni BRAF [9]. Un altro inibitore potente e selettivo di MEK1/2, cMEK162, è attualmente in fase di sperimentazione II. I risultati iniziali di cMEK162 nei pazienti non trattati con melanoma BRAF o NRAS-mutato hanno mostrato risultati comparabilmente buoni per entrambi i gruppi (PFS 3,7 vs. 3,6 mesi), per cui per la prima volta sembra possibile un approccio terapeutico anche per i pazienti i cui tumori presentano una mutazione NRAS [10].
Combinazione di inibitori BRAF e MEK
A causa dello sviluppo osservato della resistenza, la combinazione di un inibitore BRAF con un inibitore MEK è stata testata in uno studio di fase I/II. Dopo uno studio iniziale di ricerca della dose, ai pazienti con una mutazione V600 è stato somministrato dabrafenib 150 mg 2× al giorno. più trametinib 1 mg o 2 mg al giorno. o, per confronto, dabrafenib come monoterapia (150 mg 2× al giorno) [11]. La combinazione con la dose più alta di trametinib ha mostrato una PFS significativamente prolungata di 3,6 mesi rispetto alla monoterapia con dabrafenib, con il 41% dei pazienti nel braccio di combinazione ancora liberi da progressione dopo 12 mesi. Gli effetti collaterali più frequenti (71%) sono stati piressia (38,5°) e brividi con la combinazione ad alto dosaggio (tabella 1) . Questi effetti collaterali si sono verificati il 66% in meno con la monoterapia con dabrafenib. Come si sperava, con la terapia combinata si sono formati anche meno tumori cutanei secondari.
PD Dr. med. Andreas Trojan
Letteratura:
- Dummer R, et al: Melanoma cutaneo: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up; Gruppo di lavoro Linee guida ESMO. Ann Oncol 2012 Oct; 23 Suppl 7.
- Smith FO, et al: Trattamento del melanoma metastatico con interleuchina-2 da sola o in combinazione con vaccini. Clin Cancer Res 2008; 14(17): 5610-5618.
- Hodi FS, et al: Miglioramento della sopravvivenza con ipilimumab nei pazienti con melanoma metastatico. N Engl J Med 2010; 363(8): 711-723.
- Topalian SL, et al: Sopravvivenza, remissione duratura del tumore e sicurezza a lungo termine nei pazienti con melanoma avanzato che ricevono nivolumab. J Clin Oncol 2014 Apr 1; 32(10): 1020-1030.
- McArthur GA, et al: Sicurezza ed efficacia di vemurafenib nel melanoma positivo alla mutazione BRAF(V600E) e BRAF(V600K) (BRIM-3): follow-up esteso di uno studio di fase 3, randomizzato, in aperto. Lancet Oncol 2014 Mar; 15(3): 323-332.
- Ascierto PA, et al: Studio di fase II (BREAK-2) dell’inibitore BRAF dabrafenib (GSK2118436) nei pazienti con melanoma metastatico. J Clin Oncol 2013 Sep 10; 31(26): 3205-3211.
- Hauschild A, et al: Dabrafenib nel melanoma metastatico BRAF-mutato: uno studio randomizzato controllato di fase 3, multicentrico, in aperto. Lancet 2012 Jul 28; 380(9839): 358-365.
- Flaherty KT, et al: Miglioramento della sopravvivenza con l’inibizione di MEK nel melanoma BRAF-mutato. N Engl J Med 2012; 367(2): 107-114.
- Kim KB, et al: Studio di Fase II dell’inibitore MEK1/MEK2 trametinib nei pazienti con melanoma cutaneo metastatico BRAF-mutante, precedentemente trattati con o senza un inibitore BRAF. J Clin Oncol 2013; 31(4): 482-489.
- Ascierto PA, et al: MEK162 per i pazienti con melanoma avanzato portatore di mutazioni NRAS o Val600 BRAF: uno studio di fase 2 non randomizzato, in aperto. Lancet Oncol 2013; 14(3): 249-256.
- Flaherty KT, et al: Inibizione combinata di BRAF e MEK nel melanoma con mutazioni BRAF V600. N Engl J Med 2012; 367(18): 1694-1703.
CONCLUSIONE PER LA PRATICA
- Con l’approvazione di ipilimumab (Yervoy®) e vemurafenib (Zelboraf®), la ricerca immunologica e molecolare è stata tradotta con successo nella clinica.
- L’ipilimumab spesso porta a remissioni di lunga durata con un tasso di risposta significativamente più basso.
- Promettenti nel campo delle sostanze immunomodulanti, gli anticorpi anti-PD-1 e le combinazioni di anticorpi anti-CTLA-4 e anti-PD-1 sono in fase di sperimentazione clinica.
- Nonostante la rapida insorgenza dell’azione e gli alti tassi di risposta, gli inibitori di BRAF spesso sviluppano resistenza, contro la quale in futuro potrebbero essere utilizzate con successo le combinazioni con, ad esempio, gli inibitori di MEK.
A RETENIR
- Con l’autorizzazione alla commercializzazione di ipilimumab (Yervoy®) e vémurafénib (Zelboraf®), la ricerca immunologica e molecolare è stata applicata con successo alla clinica.
- L’ipilimumab permette delle remissioni spesso prolungate con un tasso di risposta molto più basso.
- Nel campo delle sostanze immunomodulanti, gli anticorpi anti-PD-1 e le combinazioni di anticorpi anti-CTLA-4 e anti-PD-1 sono in fase di sperimentazione clinica con grandi aspettative.
- Nonostante un’apparizione rapida dell’effetto e dei tassi di risposta elevati, una resistenza si sviluppa frequentemente con gli inibitori di BRAF, contro i quali le combinazioni, ad esempio con gli inibitori di MEK, possono essere utilizzate efficacemente in futuro.
PRATICA DERMATOLOGICA 2014; 24(3): 16-20