Molti tumori al polmone vengono ancora diagnosticati solo in uno stadio avanzato o tardivo e quindi sintomatico. Sulla base dei dati degli studi più recenti, diverse società professionali hanno formulato raccomandazioni positive per lo screening polmonare, per il quale, tuttavia, rimangono alcune domande senza risposta. Nel caso di un carcinoma polmonare di nuova diagnosi, è necessario eseguire immediatamente una stadiazione preoperatoria accurata e non invasiva per garantire la corretta classificazione TNM, soprattutto perché questa fornisce il quadro per individuare la terapia o il trattamento appropriato. la gestione ulteriore del paziente. La conoscenza dei vantaggi e degli svantaggi, nonché dei limiti delle varie modalità di imaging non invasivo, gioca un ruolo importante in questo caso.
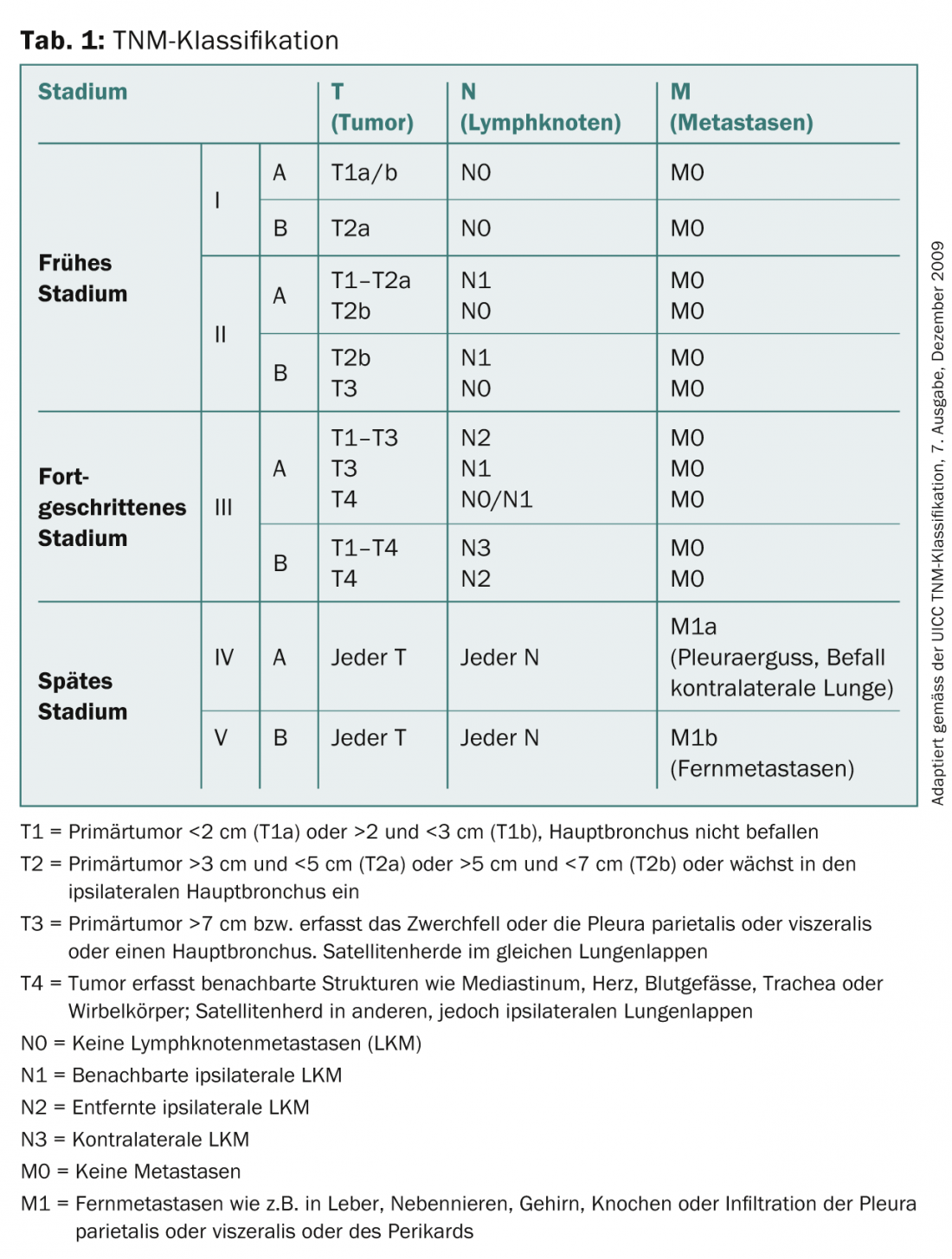
Il cancro ai polmoni è la causa più comune di morte per cancro in Svizzera tra gli uomini e la seconda causa più comune tra le donne. Mentre i nuovi casi e i tassi di mortalità tra gli uomini sono diminuiti negli ultimi anni, continuano ad aumentare tra le donne. Nonostante i progressi significativi nella diagnostica e nella terapia, la sopravvivenza a 5 anni ristagna, indipendentemente dallo stadio della malattia. È circa il 14% nel cancro al polmone di nuova diagnosi. Quando si manifestano i sintomi clinici, la diagnosi iniziale viene solitamente effettuata mediante radiografia convenzionale e tomografia computerizzata (TC), prima di eseguire una procedura bioptica per la tipizzazione dei tessuti e la stadiazione. Le procedure di imaging come la TAC, la risonanza magnetica (RM), la tomografia a emissione di positroni integrata/ tomografia computerizzata (PET/TC) e la scintigrafia ossea sono utilizzate per la classificazione del tumore secondo la classificazione TNM (Tab. 1), in base alla quale viene determinata la procedura terapeutica successiva. Questo articolo valuta i diversi strumenti di diagnostica radiologica e di stadiazione, compresi i loro vantaggi, svantaggi e limiti.
Dopo la pubblicazione dei dati del National Lung Screening Trial [1], che ha dimostrato che un programma di screening mirato con la TAC può ridurre la mortalità, diverse società professionali hanno formulato raccomandazioni positive per lo screening polmonare. Tuttavia, ci sono ancora diverse preoccupazioni e domande senza risposta, ad esempio per quanto riguarda la gestione e le conseguenze dei risultati falsi positivi, la raccomandazione e la durata degli intervalli di controllo, il rischio di esposizione cumulativa alle radiazioni, le conseguenze economiche per il sistema sanitario e la regolamentazione del finanziamento [2].
Diagnostica radiologica e stadiazione
Radiografia del torace: la radiografia del torace in due piani svolge un ruolo subordinato nella diagnostica a causa della sua bassa sensibilità, in quanto il carcinoma polmonare non può essere escluso nel caso di un risultato negativo. Tuttavia, altre cause di disturbi toracici possono essere escluse o confermate da una radiografia. Spesso, la scansione serve anche come esame di base prima dell’intervento chirurgico o della terapia ed è quindi utile per differenziare le complicazioni della terapia o le malattie non correlate al tumore durante il follow-up (Fig. 1).

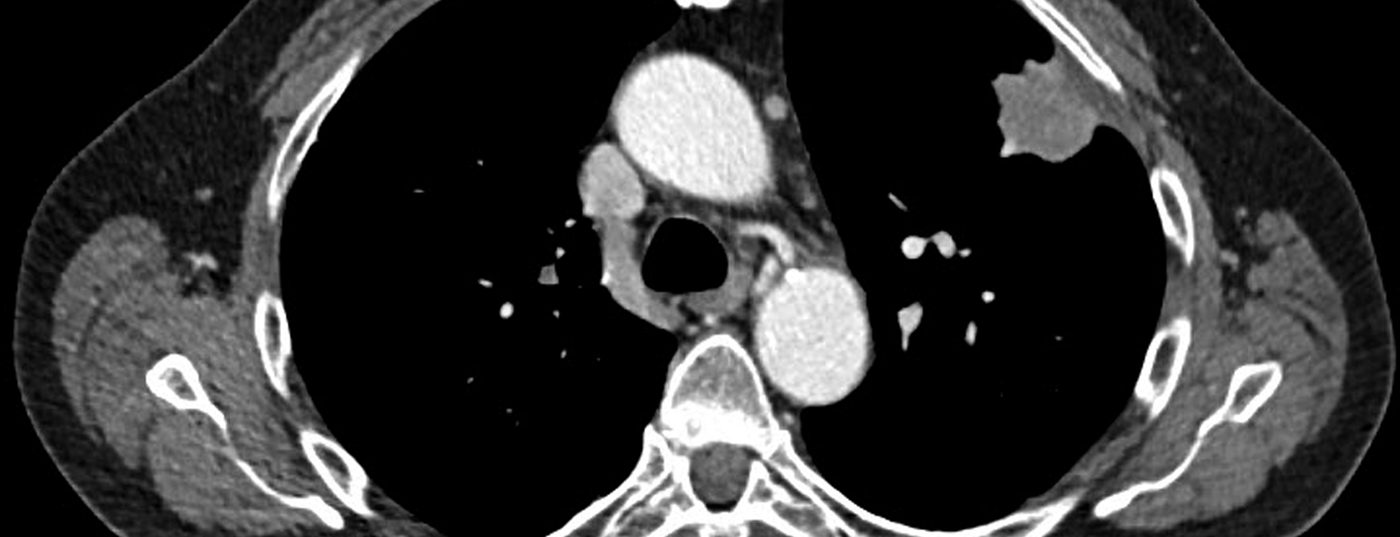
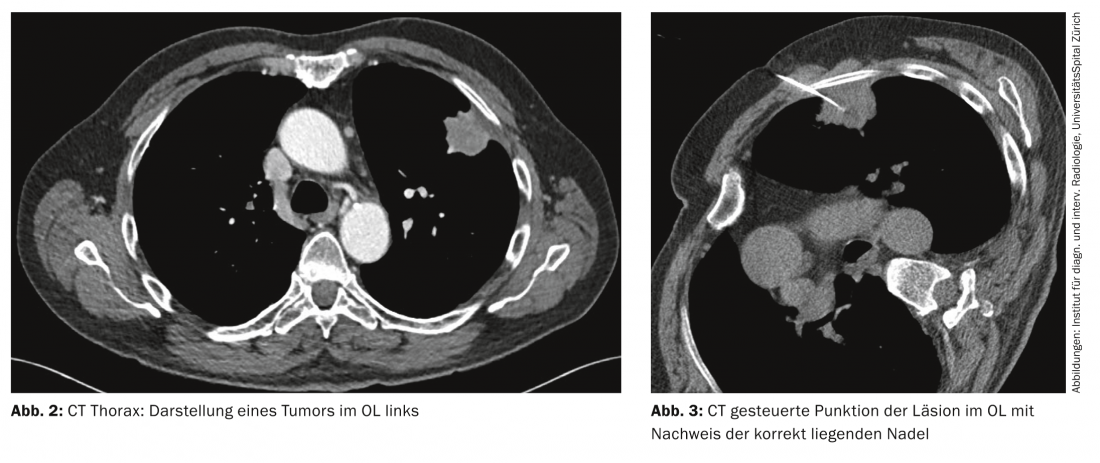
Tomografia computerizzata: oggi, la TAC ad alta risoluzione del torace è la modalità di imaging di scelta per la diagnosi primaria del sospetto carcinoma polmonare, soprattutto grazie alla sua rapida disponibilità (Fig. 2) .
La differenziazione tra uno stadio tumorale T1 e T2, che si basa principalmente sulle dimensioni del tumore, è facilmente possibile mediante la TAC, ma difficilmente influenza la strategia terapeutica successiva, mentre l’accuratezza nella differenziazione tra uno stadio T3 operabile e uno stadio T4 non operabile è solo bassa [3].
Nella stadiazione linfonodale, la TAC ha un’accuratezza diagnostica limitata, con una sensibilità del 51% e una specificità dell’86% [4], soprattutto perché si basa solo su criteri morfologici come la forma e le dimensioni, per cui un linfonodo con un diametro sull’asse corto >di 1 cm è considerato metastatico. Pertanto, i criteri puramente morfologici, come le dimensioni e la forma, possono essere applicati per le metastasi linfonodali, anche se in definitiva sono insufficienti per una diagnosi precisa delle metastasi linfonodali mediastiniche e richiedono ulteriori metodi di imaging più sensibili, come la PET/CT.
In caso di sospetto carcinoma polmonare, si raccomanda un esame tomografico computerizzato aggiuntivo dell’addome superiore come parte dell’imaging primario, utilizzando la TC del torace con contrasto per valutare le metastasi surrenali o epatiche [4].
La biopsia guidata dalla TAC viene utilizzata per ottenere il materiale tumorale per l’elaborazione istologica e immunoistochimica. È particolarmente indicato per i tumori più periferici (Fig. 3).
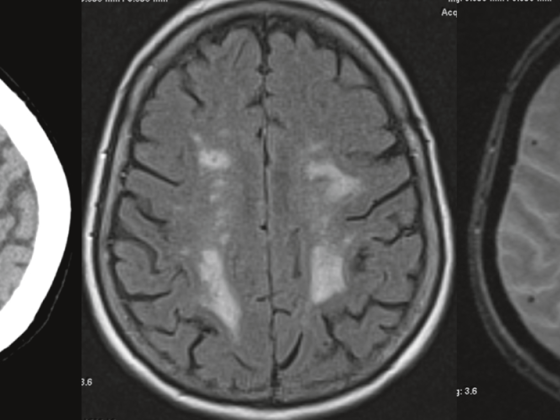
Risonanza magnetica (RM ): la RM può essere utilizzata insieme alla TAC per valutare l’estensione locale del tumore o per determinare l’estensione del tumore. essere utilizzato per l’infiltrazione tumorale del mediastino, della parete toracica, del diaframma, dei neuroforamina e del canale spinale, nonché del plesso brachiale nei tumori di Pancoast. La tecnica della diffusione RM permette anche di caratterizzare ulteriormente il carcinoma polmonare e consente di differenziare tra tumori centrali e atelettasie o consolidamenti polmonari poststenotici.
Nella stadiazione nodale del mediastino e degli hili polmonari, la risonanza magnetica svolge un ruolo secondario e viene utilizzata principalmente come imaging per risolvere i problemi nei casi poco chiari [5].
Tuttavia, la risonanza magnetica è una modalità di imaging efficace nel work-up delle metastasi cerebrali o epatiche [6]. La risonanza magnetica dell’encefalo è raccomandata nei pazienti con sintomi neurologici o, secondo le linee guida NCCN [7], già nei pazienti con un tumore T2 (stadio Ib) che sono programmati per una terapia curativa, ma dovrebbe essere eseguita in modo sicuro dallo stadio IIIA in poi.
La tomografia ad emissione di positroni/ tomografia computerizzata integrata: PET/CT con il tracciante 18-fluoro-deossi-glucosio (FDG) fornisce importanti informazioni aggiuntive nella stadiazione preoperatoria del carcinoma polmonare, grazie alle sue informazioni metabolico-funzionali e anatomiche. L’uso della PET/TC serve da un lato a confermare la stadiazione tomografica computerizzata iniziale e dall’altro a trovare metastasi linfonodali toraciche false negative alla tomografia computerizzata o metastasi toraco-addominali occulte a distanza (Fig. 4).
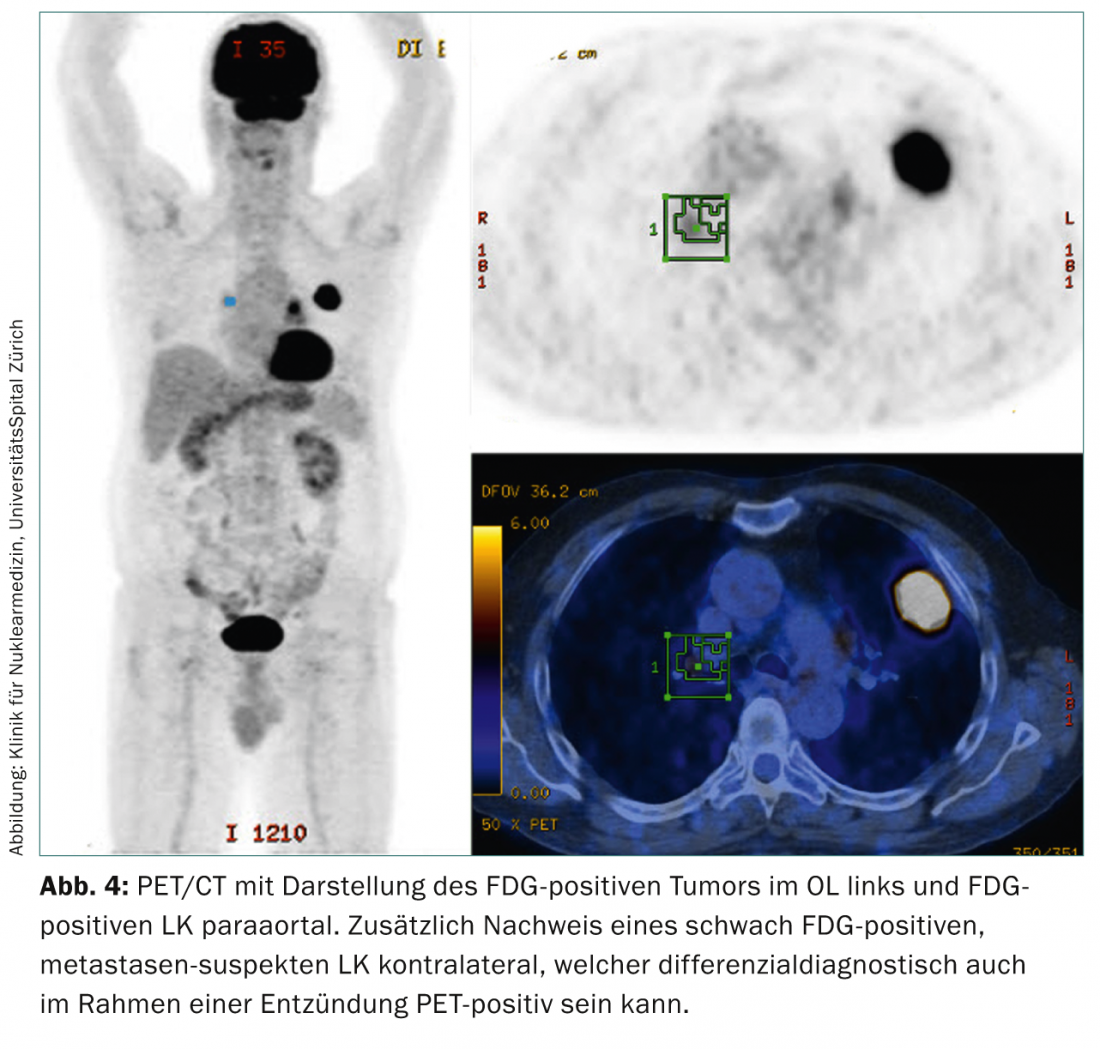
Con il suo elevato valore predittivo negativo di >90% [8], porta a una stadiazione nodale più accurata rispetto alla sola TAC o PET. Tuttavia, i falsi positivi possono essere causati da infiammazione, infezione o infarto. Possono anche verificarsi risultati falsi negativi, che devono poi essere ulteriormente chiariti dalla diagnostica invasiva, per confermare la stadiazione tomografica computerizzata dei linfonodi toracici ingrossati.
Nel contesto della ricerca di metastasi, la PET/CT consente di rilevare metastasi a distanza toraco-addominali inaspettate e può quindi ridurre il tasso di metastasi inutili o non necessarie. toracotomie terapeuticamente non indicate fino al 20% [9]. La FDG-PET/CT non è adatta per chiarire eventuali metastasi cerebrali a causa del metabolismo del glucosio fisiologicamente elevato del cervello e in questo caso è chiaramente superiore alla risonanza magnetica.
Scintigrafia ossea: gli studi attuali dimostrano che la FDG-PET/CT ha una sensibilità e un’accuratezza paragonabili a quelle della scintigrafia ossea, ma con una specificità migliore grazie al tasso significativamente inferiore di risultati falsi positivi, che arriva al 40% per la scintigrafia ossea. Pertanto, la scintigrafia ossea ha un ruolo minore nella stadiazione preoperatoria del carcinoma polmonare.
Stadiazione non invasiva
Stadio T: la TAC è il metodo principale utilizzato. Permette una chiara differenziazione tra T1 e T2, ma presenta dei punti deboli nella differenziazione tra T3 e T4. In questo caso, la risonanza magnetica dovrebbe essere considerata come un metodo alternativo.
Stadio N: la PET/CT è il metodo di scelta. Ha un’elevata sensibilità, ma non è in grado di distinguere tra tumore e infiammazione/infezione. La TAC ha un’alta specificità ma una bassa sensibilità.
Stadio M: in questa fase, la PET/CT è il metodo di scelta. A partire dallo stadio tumorale T3, si raccomanda di eseguire una risonanza magnetica dell’encefalo per escludere metastasi cerebrali. La scintigrafia ossea ha un ruolo minore nel rilevamento delle metastasi ossee.
Cura successiva
Attualmente, non esiste ancora una procedura chiara per il follow-up dei tumori trattati in modo curativo. Le linee guida dell’ACCP (“American College of Chest Physicians”) prevedono un esame di follow-up mediante TAC del torace ogni sei mesi per i primi due anni in caso di tumore al polmone non a piccole cellule e successivamente esami di follow-up annuali [10]. Per i pazienti che non hanno ricevuto un trattamento curativo primario per il loro tumore, le raccomandazioni dipendono dal tipo di terapia, ma di solito prevedono un ciclo di tre mesi.
PD Thomas Frauenfelder, MD
Stephan Baumüller, MD
Letteratura:
- Aberle DR, et al: National Lung Screening Trial Research T: Riduzione della mortalità per cancro ai polmoni con lo screening tomografico computerizzato a basso dosaggio. N Engl J Med 2011; 365(5): 395-409.
- Bach PB, et al: Benefici e danni dello screening con TAC per il cancro al polmone: una revisione sistematica. JAMA 2012; 307(22): 2418-2429.
- Quint LE, et al: Stadiazione preoperatoria del carcinoma polmonare non a piccole cellule: metodi di imaging. AJR Am J Roentgenol 1995; 164(6): 1349-1359.
- Ravenel JG, et al: Criteri di appropriatezza ACR(R) per la stadiazione clinica non invasiva del carcinoma broncogeno. J Thorac Imaging 2010; 25(4): W107-111.
- Imai K, et al: Diagnostica per immagini nella gestione preoperatoria del cancro al polmone. Surg Today 2013.
- Tsim S, et al: Stadiazione del carcinoma polmonare non a piccole cellule (NSCLC): una revisione. Respir Med 2010; 104(12): 1767-1774.
- Linee guida di pratica clinica in oncologia del National Comprehensive Cancer Network. Cancro del polmone non a piccole cellule , versione 1.20142014. Disponibile all’indirizzo: www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Vansteenkiste J, et al: Tomografia ad emissione di positroni nella valutazione prognostica e terapeutica del cancro al polmone: revisione sistematica. Lancet Oncol 2004; 5(9): 531-540.
- van Tinteren H, et al: Efficacia della tomografia ad emissione di positroni nella valutazione preoperatoria dei pazienti con sospetto tumore al polmone non a piccole cellule: lo studio multicentrico randomizzato PLUS. Lancet 2002; 359(9315): 1388-1393.
- Rubins J, et al: Follow-up e sorveglianza del paziente con cancro al polmone dopo la terapia con intento curativo: linea guida di pratica clinica basata sull’evidenza dell’ACCP (2a edizione). Chest 2007; 132(3): 355-367.
InFo ONCOLOGIA EMATOLOGIA 2014; 2(4): 6-9