Se la colonizzazione da biofilm persiste nelle ferite croniche, nonostante il miglior trattamento possibile della malattia di base, la guarigione della ferita ristagna. Lo sbrigliamento meccanico è molto importante, ma non è sufficiente come unica misura e in alcuni casi non è nemmeno pratico. Affinché le soluzioni di irrigazione delle ferite e le medicazioni antimicrobiche siano efficaci contro il biofilm, è fondamentale che riescano a penetrare la sostanza polimerica extracellulare. Di conseguenza, l’efficacia dei diversi preparati varia.
Le ferite ancora aperte dopo 30 giorni sono considerate croniche, indipendentemente dalla loro causa, e sono soggette a infezioni a causa di una serie di fattori [1]. Quindi, l’ambiente caldo e umido della ferita è un terreno di coltura ideale per batteri e funghi e la chiusura ritardata della ferita aumenta il rischio di esposizione continua ai patogeni con il rischio di formazione di biofilm. In occasione del Wound Congress di quest’anno a Norimberga, la Prof.ssa Dr. med. Ewa Klara Stürmer, Direttore Medico Comprehensive Wound Center e Responsabile della Ricerca Traslazionale sulle Ferite, University Medical Center Hamburg-Eppendorf, ha parlato della pratica clinica e delle nuove scoperte nel trattamento del biofilm delle ferite [2].

Il biofilm si trova in oltre tre quarti di tutte le ferite croniche.
Un biofilm si sviluppa quando la colonizzazione batterica nella ferita porta a colonie o associazioni batteriche in cui i batteri maturano e si diffondono (box) [16]. Secondo una meta-analisi, circa il 78% di tutte le ferite croniche è colonizzato da microrganismi patogeni sotto forma di biofilm [3]. Il biofilm della ferita fornisce una risposta immunitaria duratura, più o meno pronunciata, o un’infiammazione a livello locale [4]. Se il biofilm non viene rotto ed eliminato, la guarigione della ferita ristagna, con conseguente persistenza della cronicizzazione della ferita – nonostante il miglior trattamento possibile della malattia di base [2,4,5]. Le specie batteriche principali nei biofilm delle ferite, prendendo come esempio le ulcere delle gambe, sono (Panoramica 1): Staphylococcus aureus, la sua variante resistente alla meticillina (MRSA), Pseudomonas aeruginosa, Enterobacteriaceae e Proteus mirabilis [6].

La sostanza polimerica extracellulare come punto critico di adesione
La comunità simbiotica e interspecie di microrganismi da cui si formano i biofilm produce una sostanza polimerica extracellulare (EPS) in cui si “murano” [2,4]. L’EPS è costituito essenzialmente da polisaccaridi e da una varietà di proteine, lipidi, glicoproteine e glicolipidi, che lo fanno aderire saldamente al letto della ferita [7]. Questa miscela di zuccheri e proteine rappresenta uno “scudo protettivo” batterico contro gli antisettici e gli antibiotici [2]. Dopo 2-4 giorni, si parla di “biofilm maturo”. Un biofilm della ferita o una forte colonizzazione batterica della ferita possono essere resi visibili all’occhio umano con la luce UV-near (ad esempio, MolecuLight®, MolecuLight Corp., Toronto, Canada) [4].
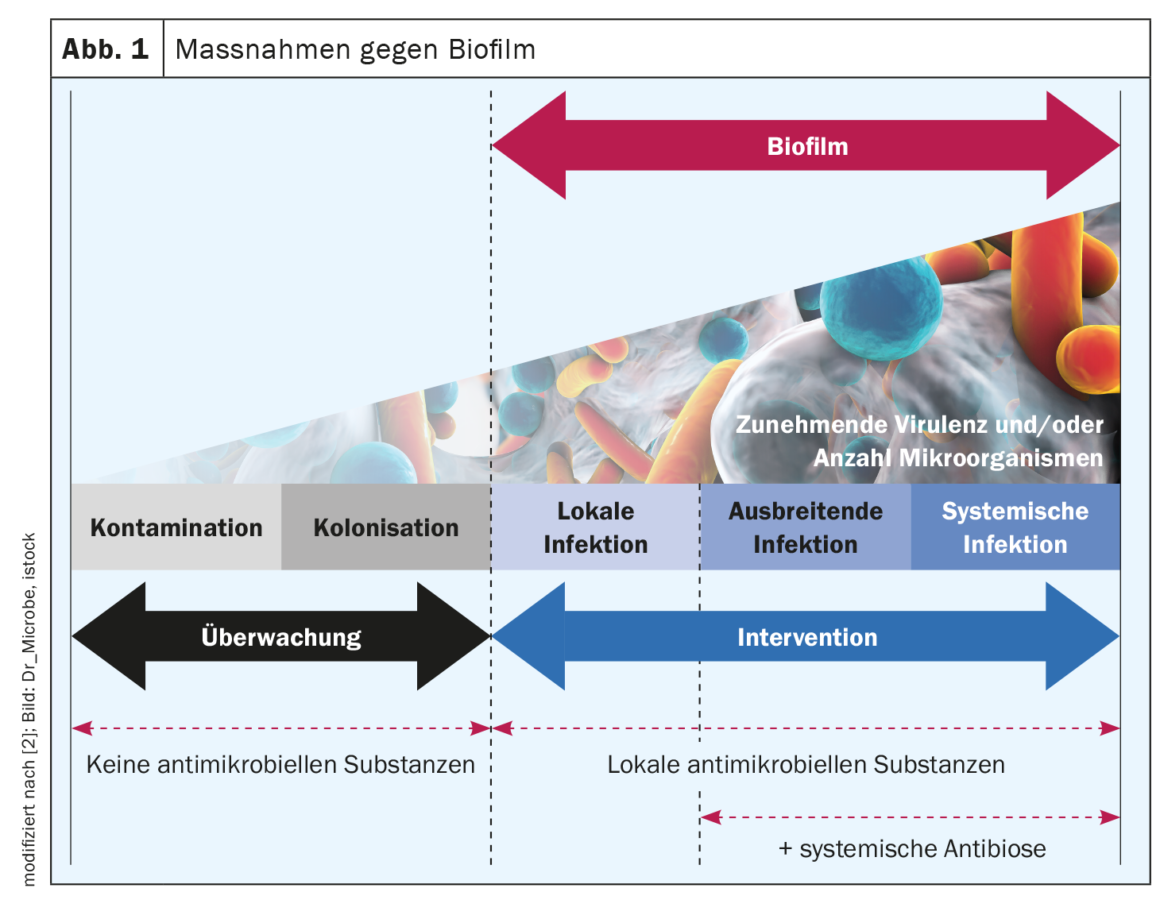
Efficienza delle irrigazioni e delle medicazioni antimicrobiche per le ferite
Lo sbrigliamento meccanico è attualmente l’unico trattamento per il biofilm della ferita raccomandato dal consenso degli esperti, ma da un lato lo sbrigliamento da solo non rimuove tutto il biofilm e dall’altro non è sempre un’opzione praticabile nel contesto dell’assistenza domiciliare (ad esempio, igiene limitata, pazienti in anticoagulazione terapeutica con farmaci) [4,8]. Le soluzioni antimicrobiche per l’irrigazione delle ferite affrontano e distruggono le pareti, le membrane e le proteine di trasporto batteriche o ne inibiscono la funzione [4]. Se non riescono a sfondare l’EPS – che funziona come una barriera biochimica contro il sistema immunitario dell’ospite e soprattutto contro gli agenti antimicrobici – non possono funzionare in modo efficace. Di conseguenza, l’efficacia delle diverse soluzioni di irrigazione delle ferite contro i biofilm batterici varia [4]. I test traslazionali sistematici condotti sul modello di biofilm umano hpBIOM dimostrano che Octenisept® è in grado di rompere i biofilm e di uccidere i batteri al loro interno entro 72 ore [4,9,10,17]. Il PHMB riesce in misura limitata nello stesso periodo, ma l’eradicazione completa non viene raggiunta nemmeno dopo 72 ore. Le soluzioni ipoclorose per l’irrigazione delle ferite e la clorexidina non riescono a eliminare efficacemente i batteri nel biofilm [4,10].

Per quanto riguarda l’importanza delle medicazioni per le ferite, è piuttosto difficile ricavare raccomandazioni terapeutiche differenziate dall’esigua base di prove di studi clinici comparativi con medicazioni (antimicrobiche) per le ferite, dal momento che non solo variano i principi attivi (ioni d’argento, argento nanocristallino, PHMB, derivati dello iodio, ecc. [4,11]. Ma molteplici test in vitro, utilizzando un modello di biofilm umano, hanno dimostrato che un prodotto combinato di iodio e amido (Cadexomer iodine) era in grado di eliminare completamente i batteri nel biofilm entro sei giorni [2,4]. Altre medicazioni per ferite contenenti PHMB o argento hanno ridotto solo la carica batterica [12]. Le analisi corrispondenti sono state effettuate dopo un periodo di sei giorni senza cambio di medicazione e si può ritenere che si possa ottenere un’efficacia maggiore per tutte le medicazioni testate con cambi giornalieri o ogni due giorni [4].
Il meccanismo d’azione del prodotto combinato di iodio e amido (Iodosorb™) si basa sulle microsfere di Cadexomer, che distruggono la struttura del biofilm o la sostanza polimerica extracellulare batterica mediante disidratazione, come prerequisito affinché lo iodio possa eliminare facilmente i batteri così esposti nel biofilm [12,18].
Congresso: Congresso sulle ferite di Norimberga
Letteratura:
- Hunt S, Elg F: L’efficacia clinica dell’emoglobina spray come terapia aggiuntiva nel trattamento delle ferite croniche. J Wound Care 2017; 26(9): 558-568.
- “Biofilm – Die Herausforderung des Jahrzehntes in der Wundversorgung – Wundbiofilm erkennen, verstehen und nachhaltig beseitigen”, Prof. Dr. med. Stürmer, Industriesymposium Smith & Nephew GmbH, Wundkongress Nürnberg, 1.12.2022.
- Malone M, et al: La prevalenza dei biofilm nelle ferite croniche: una revisione sistematica e una meta-analisi dei dati pubblicati. J Wound Care 2017; 26(1): 20-25.
- Stürmer EK, Rembe J-D: Riconoscere e comprendere il biofilm della ferita: Possibilità terapeutiche e loro limiti. Formazione continua ECM, DERMATOLOGIE PRAXIS 2/2022, 6-11.
- James GA, et al: Biofilm nelle ferite croniche. Wound Repair Regen 2008; 16(1): 3-44.
- Jockenhofer F, et al.: Spettro patogeno batteriologico delle ulcere croniche delle gambe: risultati di uno studio multicentrico in centri di cura delle ferite dermatologiche differenziati per regioni. J Dtsch Dermatol Ges 2013; 11(11): 1057-1063.
- Flemming HC, Wingender J: La matrice del biofilm. Nat Rev Microbiol 2010; 8(9): 623-633.
- Schwartz JA, et al: Il debridement chirurgico da solo non riduce adeguatamente il bioburden planctonico nelle ferite croniche degli arti inferiori. J Wound Care. 2014 Sep; 23(9): S4, S6, S8 passim. doi: 10.12968/jowc.2014.23.Sup9.S4.
- Besser M, et al.: Efficacia degli antisettici in un nuovo modello di biofilm plasmatico umano tridimensionale (hpBIOM). Sci Rep 2020; 10(1): 4792.
- Rembe JD, et al: Le soluzioni antimicrobiche ipoclorose per l’irrigazione delle ferite dimostrano una minore efficacia anti-biofilm contro il biofilm batterico in un modello complesso di biofilm plasmatico umano in-vitro (hpBIOM) rispetto ai comuni antimicrobici per ferite. Front Microbiol 2020; 11: 564513.
- Schwarzer S, et al: L’efficacia degli agenti topici utilizzati nelle ferite per gestire le infezioni croniche da biofilm: una revisione sistematica. J Infect 2020; 80(3): 261-270.
- Stuermer EK, et al: Attività in vitro delle medicazioni antimicrobiche per ferite sul biofilm della ferita di P. aeruginosa. Front Microbiol 2021; 12: 664030.
- Stuermer EK, et al: Infiltrazione batterica nelle ferite colonizzate da biofilm: analisi nel modello di ferita ex vivo hpBIOM e possibile impatto sul tamponamento e sullo sbrigliamento. Int Wound J 2022 (in revisione)
- 14. “Principi di cura delle ferite, tecniche di pulizia/debridazioni delle ferite”, www.bk-trier.de/media-bkt/docs/Bildung/Handouts-Wundmanagement/Basisseminar-Handouts/03_Debridement.pdf,(ultimo accesso 20.01.2023).
- Rembe JD, Stürmer EK: La moderna antisepsi delle ferite – indicazioni e limiti, tra conoscenza, desiderio e incertezza. Chirurgia vascolare 2020; 25, 272-276.
- Percival SL, McCarty SM, Lipsky B: Biofilm e ferite: una panoramica delle prove. In: Advances in wound care 2015; 4(7): 373-381.
- Compendio svizzero dei farmaci,
https://compendium.ch,(ultimo accesso 20.01.2023) - Medicazione Iodosorb™, www.smith-nephew.com/switzerland/fachgebiete/wundmanagement/iodosorb-dressing,(ultimo accesso 20.01.2023).
DERMATOLOGIE PRAXIS 2023; 33(1): 32-33 (pubblicato il 16.2.23, prima della stampa).











