Attualmente sono stati identificati diversi fattori di rischio che predispongono allo sviluppo di un coinvolgimento articolare in presenza di psoriasi. I dermatologi svolgono un ruolo chiave nella diagnosi precoce. Una terapia sistemica adeguata in una “finestra di opportunità” può avere un impatto positivo in termini di esiti a lungo termine. Sebbene le opzioni di trattamento siano migliorate, la risposta alla terapia non è soddisfacente per tutti i pazienti con PsA. La ricerca continua quindi a ritmo serrato e vengono sperimentate nuove strategie terapeutiche.
La minima attività di malattia ( MDA) è considerata una terapia di successo per l’artrite psoriasica (PsA). I progressi nella decifrazione delle relazioni patogenetiche della PsA hanno guidato lo sviluppo di moderni sistemi terapeutici, per cui sono ora disponibili biologici e “piccole molecole” diretti contro vari bersagli: TNF, interleuchina (IL)-12/23, IL-17, IL-23, JAK-STAT, PDE-4. I risultati terapeutici sono stati elevati a un nuovo livello (Tab. 1) [1]. Mentre i farmaci antireumatici sintetici convenzionali che modificano la malattia (csDMARDs**) hanno raggiunto una MDA nel 17% dei pazienti con PsA, secondo una revisione sistematica pubblicata nel 2020, il trattamento con i biologici (bDMARDs) ha raggiunto una MDA nel 57% [2]. Sebbene si tratti di un salto di qualità, riflette anche una percentuale significativa di non rispondenti.
** csDMARDs: in particolare metotrexato, anche sulfasalazina o leflunomide; in contrasto con i sintetici mirati (tsDMARDs) come apremilast e i biologici (bDMARDs)
Raccomandazioni GRAPPA e EULAR
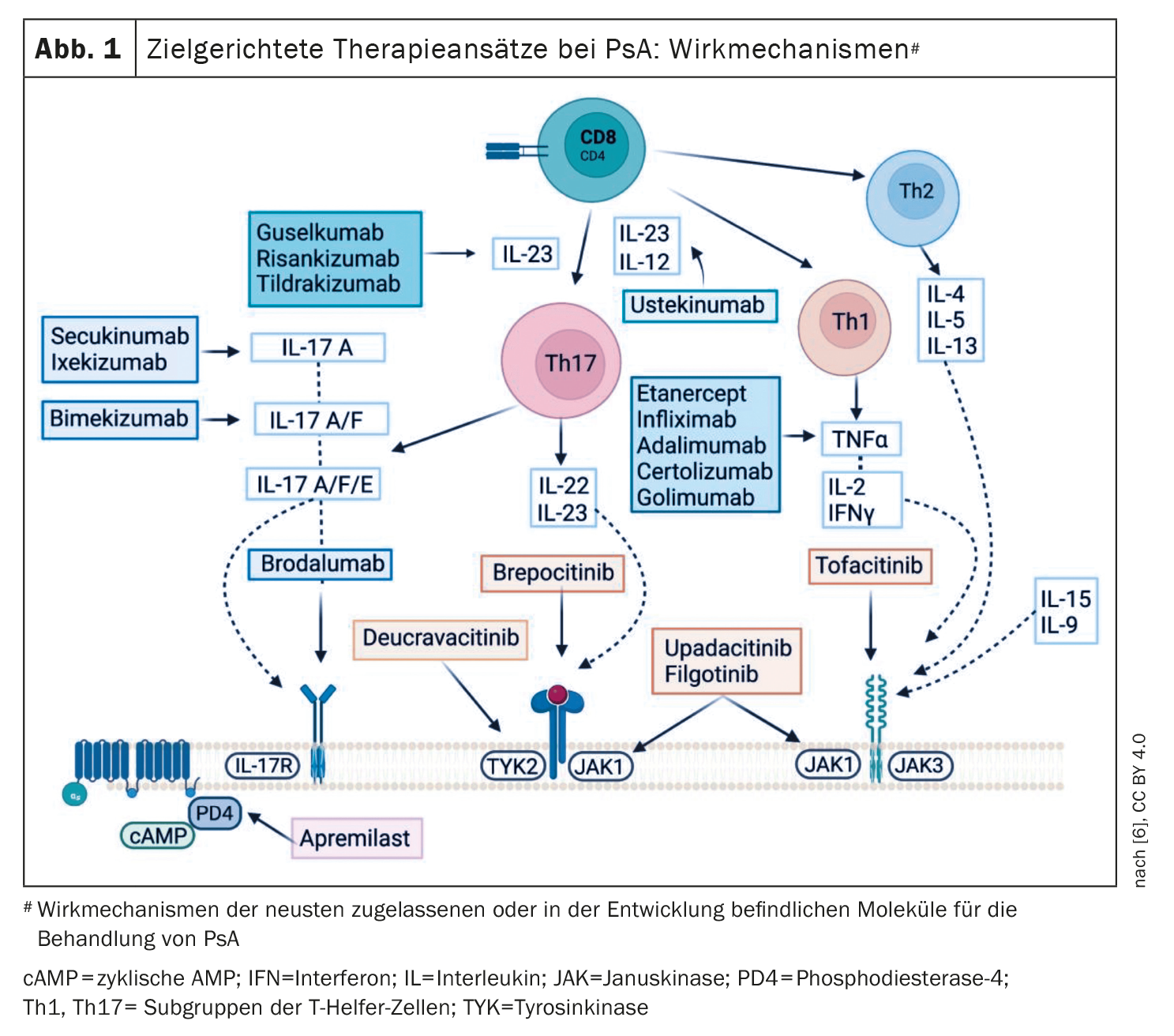
In considerazione dell’eterogeneità della PsA, una strategia di trattamento personalizzata sta diventando sempre più importante. Le attuali raccomandazioni del Gruppo per la Ricerca e la Valutazione della Psoriasi e dell’Artrite Psoriasica (GRAPPA) e della Lega Europea contro il Reumatismo (EULAR) suggeriscono di affrontare tutti i domini di malattia attiva e le comorbidità rilevanti per la PsA di un determinato paziente [3,4]. L’attuale linea guida S3 sulla psoriasi raccomanda che i dermatologi effettuino la diagnosi e la selezione del trattamento per la PsA su base interdisciplinare, in collaborazione con un reumatologo [5]. Secondo l’algoritmo di trattamento EULAR e GRAPPA, i csDMARD sono considerati un trattamento di prima linea, seguito dall’inibitore della PDE-4 apremilast, dai biologici (bDMARD) o dall’uso di DMARD sintetici mirati, come gli inibitori della Janus chinasi (JAK) [3,4]. I DMARDs attualmente autorizzati in Svizzera nell’area di indicazione dell’artrite psoriasica sono mostrati nella Figura 1.
Apremilast e TNF-α-i sono opzioni terapeutiche provate e testate.
Apremilast è una “piccola molecola” somministrata per via orale che inibisce la fosfodiesterasi 4 (PDE-4). L’inibizione della PDE-4 promuove un aumento dell’AMP ciclico intracellulare, che impedisce la sintesi di citochine pro-infiammatorie e aumenta le citochine anti-infiammatorie (IL-10) [6]. Le linee guida raccomandano apremilast in particolare per la psoriasi con coinvolgimento ungueale, la PsA periferica, l’entesite e la dattilite. Gli studi ESTEEM hanno dimostrato l’efficacia nella psoriasi a placche e nel coinvolgimento delle unghie e gli studi PALACE hanno fornito prove di efficacia nella PsA [7,8]. Inoltre, in diversi studi randomizzati e controllati (RTC), una risposta ACR20 è stata raggiunta significativamente più frequentemente alla settimana 16 con entrambe le dosi di apremilast (20 mg o 30 mg, 2 volte al giorno) rispetto al placebo [9–12].
Gli inibitori del TNF-α sono un’opzione di trattamento biologico comprovata per la PsA, per la quale esistono prove di efficacia in tutti i domini della PsA [6]. Secondo una meta-analisi, adalimumab, etanercept e infliximab sono equivalenti in termini di risposta ACR20 [13].
“Colpire duro e presto” con biologici altamente efficaci?
Un approccio per ottimizzare i risultati del trattamento consiste nell’intervenire il più precocemente possibile con biologici altamente efficaci, in modo da ritardare o addirittura prevenire lo sviluppo della PsA [14]. I pazienti affetti da psoriasi ad alto rischio di sviluppare la PsA (artralgia, psoriasi delle unghie o della testa o PASI>6) hanno ricevuto il trattamento con l’inibitore dell’IL-17A secukinumab nello studio IVEPSA. Dopo un periodo di trattamento di 24 settimane, le lesioni cutanee e i punteggi dell’artralgia e della sinovite (valutati mediante TAC e risonanza magnetica) erano migliorati [15]. E in un altro studio, l’inibitore dell’IL12/23 ustekinumab ha portato a una riduzione dell’entesopatia periferica subclinica in 23 pazienti con psoriasi a placche da moderata a grave dopo 12 settimane, con un effetto che è durato fino alla settimana 52 [16]. E ci sono anche risultati di studi sull’inibitore dell’IL-23 guselkumab che puntano in una direzione simile [17].
Studi testa a testa sugli inibitori dell’IL-17A
Negli ultimi decenni, è diventato chiaro che le cellule Th17, IL-23 e IL-17 svolgono un ruolo immunopatologico centrale [1]. Di conseguenza, gli antagonisti del TNF-α non sono più la prima scelta tra i biologici per la PsA; stanno invece guadagnando terreno l’ustekinumab e gli inibitori dell’IL-17A. Nei pazienti con PsA che avevano risposto in modo inadeguato ai csDMARD, l’IL-17A-i ixekizumab si è dimostrato superiore all’adalimumab in uno studio testa a testa, sia in termini di miglioramento dell’entesite che di lesioni cutanee [18]. E in uno studio testa a testa di McInnes et al. Il secukinumab è stato efficace almeno quanto l’inibitore del TNF-α per gli endpoint muscoloscheletrici, ma ha ottenuto risultati migliori in termini di miglioramento delle lesioni cutanee [19]. Secondo Sundanum et al. 2023, che dimostrano che l’IL-17A-i nella PsA ha una crescente base di prove in termini di efficacia e sicurezza [1]. L’inibitore dell’IL-17A/F bimekizumab è attualmente autorizzato solo in Svizzera per la psoriasi a placche, ma si è dimostrato superiore al placebo nello studio BE COMPLETE in termini di risposta ACR50 nei pazienti che avevano precedentemente ricevuto una terapia con TNF-α-i [20].
IL-23-i – due rappresentanti approvati per la PsA
Risankizumab e guselkumab sono attualmente autorizzati nell’area di indicazione della PsA in Svizzera. Negli studi KEEPsAKE, un numero significativamente maggiore di pazienti trattati con risankizumab ha ottenuto una risposta ACR-20 alla settimana 24 rispetto a quelli trattati con placebo [21,22]. L’estensione dell’indicazione di guselkumab si basa sugli studi DISCOVER. Sia i pazienti naïve al trattamento che quelli precedentemente trattati con TNF-α-i hanno mostrato una risposta ACR20 significativamente più elevata con guselkumab alla settimana 24 rispetto al placebo [23–25]. Tildrakizumab, un altro IL-23-i approvato per la psoriasi a placche, ha ottenuto risultati positivi da uno studio di fase II nella PsA; il programma di studi di fase III INSPIRE non è ancora stato completato [26–28].
E la via di segnalazione JAK/STAT?
La famiglia JAK è composta da quattro membri: Janus chinasi (JAK)-1, JAK-2, JAK-3 e tirosin chinasi (TYK)-2. Gli effetti immunomodulatori e proinfiammatori sono mediati dalla via di segnalazione JAK/STAT. Tofacitinib inibisce specificamente JAK1 e JAK3. In uno studio di fase III, è stata dimostrata l’efficacia di tofacitinib rispetto al placebo sia nei pazienti PsA naïve al trattamento sia nei pazienti dopo il fallimento del trattamento con TNF-α-i [30,31]. Upadacitinib inibisce JAK1 e ha dimostrato di essere superiore al placebo nello studio di Fase III SELECT-PsA 1 in termini di risposta ACR20. Inoltre, upadacitinib 15 mg non era inferiore ad adalimumab, mentre JAK-i era superiore ad adalimumab alla dose di 30 mg, anche se si sono verificati più eventi avversi gravi con upadacitinib [32]. E in SELECT-PsA, i pazienti con PsA in cui il TNF-α-i non era efficace o che non potevano tollerarlo hanno ottenuto una risposta ACR20 significativamente più elevata e un tasso di MDA più alto con upadacitinib (15 mg o 30 mg al giorno) [33]. In uno studio di fase II, il deucravacitinib, un inibitore di TYK2, si è dimostrato superiore al placebo a entrambe le dosi (6 mg e 12 mg/die) nell’artrite, nell’entesite e nella dattilite [34].
Per quanto riguarda la sicurezza dei membri della famiglia JAK, lo studio di sorveglianza ORAL ha rilevato che i pazienti con artrite reumatoide trattati con tofacitinib avevano un rischio maggiore di eventi cardiovascolari rispetto a quelli trattati con TNF-α-i [35]. Di conseguenza, sia l’Agenzia Europea dei Medicinali (EMA) che la Food and Drug Administration (FDA) degli Stati Uniti hanno emesso un’avvertenza sull’uso di JAK-i in pazienti di età superiore ai 65 anni, fumatori e in presenza di fattori di rischio cardiovascolare, eventi tromboembolici o una storia di malattia maligna [6].
Letteratura:
- Sundanum S, Orr C, Veale D: Terapie mirate nell’artrite psoriasica: un aggiornamento. Int J Mol Sci 2023 Mar 28; 24(7):6384
- Zardin-Moraes M, et al: Prevalenza di pazienti affetti da artrite psoriasica che raggiungono l’attività minima della malattia negli studi del mondo reale e negli studi clinici randomizzati: revisione sistematica con metaanalisi. J Rheumatol 2020; 47: 839.
- Gossec L, et al: Raccomandazioni EULAR per la gestione dell’artrite psoriasica con terapie farmacologiche: aggiornamento 2019. Ann Rheum Dis 2020; 79: S700-S712.
- Coates LC, et al: Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): Raccomandazioni di trattamento aggiornate per l’artrite psoriasica 2021 Nat Rev Rheumatol 2022; 18: 465-479.
- Nast A e altri. Linea guida S3 tedesca sul trattamento della psoriasi vulgaris, adattata da EuroGuiDerm, register.awmf.org/assets/guidelines/013-001l_S3_Therapie-Psoriasis-vulgaris_2021-07-verlaengert.pdf, (ultimo accesso 23 gennaio 2024)
- Azuaga AB, Ramírez J, Cañete JD: Artrite psoriasica: patogenesi e terapie mirate. Int J Mol Sci 2023; 24(5): 4901. doi: 10.3390/ijms24054901. www.mdpi.com/1422-0067/24/5/4901#,(ultimo accesso 23.01.2024)
- Papp K, et al: Apremilast, un inibitore orale della fosfodiesterasi 4 (PDE4), nei pazienti con psoriasi a placche da moderata a grave: risultati di uno studio di fase III, randomizzato e controllato (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). JAAD 2015; 73: 37-49.
- Paul C, et al. Efficacia e sicurezza di Apremilast, un inibitore orale della fosfodiesterasi 4, nei pazienti con psoriasi a placche da moderata a grave per 52 settimane: uno studio di fase III, randomizzato e controllato (ESTEEM 2). Br J Dermatol 2015; 173: 1387-1399.
- Kavanaugh A, et al: Rapporto esteso: trattamento dell’artrite psoriasica in uno studio di fase 3 randomizzato, controllato con placebo, con Apremilast, un inibitore della fosfodiesterasi 4 orale. Ann Rheum Dis 2014; 73: 1020.
- Cutolo M, et al: Uno studio di fase III, randomizzato e controllato di Apremilast nei pazienti con artrite psoriasica: i risultati dello studio PALACE 2. J Rheumatol 2016; 43: 1724-1734.
- Edwards CJ, et al: Rapporto esteso: Apremilast, un inibitore orale della fosfodiesterasi 4, nei pazienti con artrite psoriasica e coinvolgimento cutaneo attuale: uno studio di fase III, randomizzato e controllato (PALACE 3). Ann Rheum Dis 2016; 75: 1065.
- Wells AF, et al: Monoterapia con Apremilast in pazienti con artrite psoriasica senza DMARD: risultati dello studio PALACE 4, randomizzato e controllato con placebo. Reumatologia 2018; 57: 1253.
- Fénix-Caballero S, et al: Confronto diretto e indiretto dell’efficacia e della sicurezza di Adalimumab, Etanercept, Infliximab e Golimumab nell’artrite psoriasica. J Clin Pharm Ther 2013; 38: 286-293.
- Kimak A, et al: Artrite psoriasica: sviluppo, individuazione e prevenzione: una revisione approfondita. J Clin Med 2023; 12(11): 3850
- 15 Kampylafka E, et al. Intercettazione della malattia con l’inibizione dell’interleuchina-17 nei pazienti con psoriasi ad alto rischio con infiammazione articolare subclinica – dati dello studio prospettico IVEPSA. Arthritis Res 2019; 21: 178.
- Savage L, et al: Regressione dell’entesopatia periferica subclinica nei pazienti senza terapia trattati con Ustekinumab per la psoriasi cronica a placche da moderata a grave: uno studio di fattibilità in aperto, prospettico, della durata di cinquantadue settimane. Arthritis Rheumatol 2019; 71 : 626-631.
- Haberman RH, et al: Efficacia di guselkumab, un inibitore selettivo di IL-23, in Preventing Arthritis in a Multicentre Psoriasis At-Risk cohort (PAMPA): Protocollo di uno studio multicentrico randomizzato, in doppio cieco, controllato con placebo. BMJ Open 2022; 12:e063650.
- Mease PJ, et al: Un confronto testa a testa dell’efficacia e della sicurezza di ixekizumab e adalimumab in pazienti naïve al biologico con artrite psoriasica attiva: risultati a 24 settimane di uno studio randomizzato, in aperto, con valutatore in cieco. Ann Rheum Dis 2020;79: 123-131.
- McInnes IB, et al: Secukinumab versus adalimumab per il trattamento dell’artrite psoriasica attiva (EXCEED): uno studio di fase 3b, in doppio cieco, a gruppi paralleli, randomizzato, con controllo attivo. Lancet 2020; 395: 1496-1505.
- Merola JF, et al: Bimekizumab in pazienti con artrite psoriasica attiva e precedente risposta inadeguata o intolleranza agli inibitori del fattore di necrosi tumorale-α: uno studio randomizzato, in doppio cieco, controllato con placebo, di fase 3 (BE COMPLETE). Lancet 2023; 401: 38-48.
- Kristensen LE, et al: Efficacia e sicurezza di Risankizumab per l’artrite psoriasica attiva: risultati a 24 settimane dello studio randomizzato, in doppio cieco, di fase 3 KEEPsAKE 1. Ann Rheum Dis 2022; 81: 225-231.
- Östör A, et al: Efficacia e sicurezza di Risankizumab per l’artrite psoriasica attiva: risultati a 24 settimane dello studio randomizzato, in doppio cieco, di fase 3 KEEPsAKE 2. Ann Rheum Dis 2022; 81: 351-358.
- Deodhar A, et al: Guselkumab in pazienti con artrite psoriasica attiva che erano biologicamente naïve o avevano ricevuto in precedenza un trattamento con inibitore del TNFα (DISCOVER-1): Uno studio di fase 3 in doppio cieco, randomizzato, controllato con placebo. Lancet 2020: 395: 1115-1125.
- Mease PJ, et al: Guselkumab in pazienti biologicamente naïve con artrite psoriasica attiva (DISCOVER-2): Uno studio di fase 3 in doppio cieco, randomizzato e controllato con placebo. Lancet 2020; 395: 1126-1136.
- Coates LC, et al: Efficacia e sicurezza di Guselkumab nei pazienti con artrite psoriasica attiva che rispondono in modo inadeguato agli inibitori del fattore di necrosi tumorale: risultati a un anno di uno studio di fase IIIb, randomizzato e controllato (COSMOS). Ann Rheum Dis 2022; 81: 359-369.
- ClinicalTrials.Gov. Identificatore: NCT04314544, https://clinicaltrials.gov,(ultimo accesso 23/01/2024)
- ClinicalTrials.Gov. Identificatore: NCT04314531, https://clinicaltrials.gov,(ultimo accesso 23/01/2024)
- Mease PJ, et al: Efficacia e sicurezza del tildrakizumab nei pazienti con artrite psoriasica attiva: risultati di uno studio randomizzato, in doppio cieco, controllato con placebo, a dosi multiple, di fase IIb della durata di 52 settimane Ann Rheum Dis 2021; 80: 1147-1157.
- Swissmedic: Informazioni sui medicinali, https://swissmedicinfo.ch,(ultimo accesso 23.01.2024)
- 30 Gladman D, et al: Tofacitinib per l’artrite psoriasica nei pazienti con una risposta inadeguata agli inibitori del TNF. NEJM 2017; 377: 1525-1536.
- Mease P, et al. Tofacitinib o Adalimumab contro placebo per l’artrite psoriasica. NEJM 2017; 377: 1537-1550.
- McInnes IB, et al: Upadacitinib nei pazienti con artrite psoriasica e risposta inadeguata alla terapia non biologica: dati a 56 settimane dello studio di fase 3 SELECT-PsA 1. RMD Open 2021; 7: e00183
- Mease PJ, et al: Upadacitinib per l’artrite psoriasica refrattaria ai biologici: SELECT-PsA 2 Ann Rheum Dis 2021; 80: 312-320.
- Mease PJ, et al: Efficacia e sicurezza dell’inibitore selettivo di TYK2, Deucravacitinib, in uno studio di fase II nell’artrite psoriasica. Ann Rheum Dis 2022; 81: 815-822.
- Ytterberg SR, et al: Rischio cardiovascolare e di cancro con Tofacitinib nell’artrite reumatoide. NEJM 2022; 386: 316-326.
PRATICA DERMATOLOGICA 2024; 34(1): 40-41