La sindrome delle gambe senza riposo è una delle malattie neurologiche più comuni, con una prevalenza di circa il 7% – un aggiornamento.
La sindrome delle gambe senza riposo (RLS) è una delle malattie neurologiche più comuni, con una prevalenza di circa il 7%. La prima descrizione convincente dei disturbi è attribuita all’anatomista inglese Thomas Willis (1672). Una tipizzazione più dettagliata del complesso di sintomi della RLS è stata fatta nel 19° secolo da Theodor Wittmaack, tra gli altri, che ha introdotto il termine “Anxietas tibiarum” dovuto all’impulso di muoversi. Nella prima metà del XX secolo sono stati riconosciuti il raggruppamento familiare e l’esacerbazione con la gravidanza, ma solo nel 1944-1945 Karl-Axel Ekbom ha riassunto tutte le caratteristiche cliniche e ha coniato il nome ormai comune di RLS [1]. La RLS è spesso chiamata anche “malattia di Willis-Ekbom” (WED) (Fig. 1). Poiché la RLS può colpire non solo le gambe, ma anche le braccia, recentemente è stato riproposto il nome WED o RLS/WED.

Reclami e diagnostica
I pazienti affetti hanno spesso difficoltà a descrivere i sintomi della RLS. I sintomi sensoriali includono disestesia, bruciore, trazione, formicolio, elettrificazione o prurito. La metà dei pazienti prova dolore. La caratteristica decisiva, tuttavia, è l’impulso a muoversi, che non deve necessariamente essere accompagnato da un disagio. La RLS è una diagnosi clinica; oltre all’impulso a muoversi, le caratteristiche essenziali della RLS includono la comparsa a riposo, il peggioramento la sera e la notte e il miglioramento con il movimento (vedere il riquadro “Criteri diagnostici della RLS”).

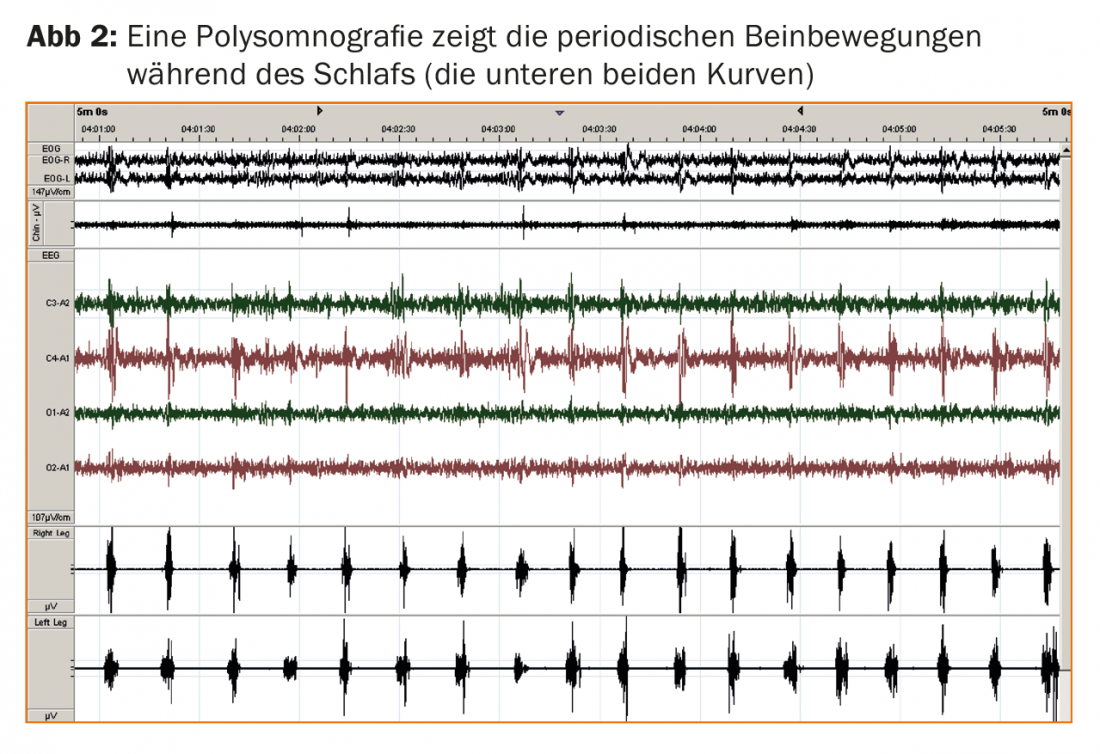
La polisonnografia è un complemento diagnostico opzionale ma utile. La polisonnografia consente di rilevare i movimenti periodici delle gambe durante il sonno (PLMS; fig. 2) in quasi tutti i pazienti RLS e di registrare gli effetti sulla qualità del sonno notturno, tipicamente sotto forma di latenza prolungata per addormentarsi e frammentazione del sonno a causa delle risposte di eccitazione corticale indotte dai PLMS. La risposta immediata alla levodopa a basso dosaggio e l’anamnesi familiare positiva in oltre il 50% dei pazienti RLS confermano la diagnosi. L’assenza di una grave sonnolenza diurna è ora elencata anche come caratteristica diagnostica non essenziale, il che è sorprendente a prima vista, ma corrisponde all’esperienza che i pazienti RLS sono più propensi a lamentare altri sintomi diurni, come la stanchezza o i disturbi della concentrazione, nonostante il sonno notturno disturbato.
La scala internazionale di gravità della RLS (Fig. 3) consente una valutazione semi-quantitativa dei sintomi della RLS. Il test di immobilizzazione cerca di oggettivare l’incapacità di mantenere le gambe immobili in una posizione fissa; tuttavia, il test non è riuscito a imporsi come esame diagnostico di routine.

Diagnostica differenziale
Ci sono diverse condizioni che sembrano soddisfare alcuni o addirittura tutti i criteri diagnostici essenziali della RLS, e la loro delimitazione può essere piuttosto difficile. Questi includono, tra l’altro, parestesia da lesioni circoscritte alle gambe, crampi alle gambe, polineuropatia periferica, radicolopatia, ansia, acatisia, dolori muscolari, posizioni scomode, battito abituale del piede, edema della parte inferiore della gamba o infiammazione articolare.
Genetica e fisiopatologia
La predisposizione genetica gioca un ruolo importante nella RLS. I gemelli identici mostrano una maggiore concordanza di RLS rispetto ai gemelli fraterni. La malattia è per lo più ereditata in modo autosomico-dominante, con un’alta penetranza. Il fenomeno dell’anticipazione è tipico anche della RLS, ossia si osserva un esordio più precoce della malattia e un decorso più grave nella generazione successiva. Gli studi di associazione genome-wide hanno identificato diverse mutazioni geniche (PTPRD, BTBD9, MEIS1) che sono associate a un aumento del rischio di RLS [2].
La causa della RLS è ancora in gran parte inspiegabile, non è stato possibile dimostrare l’esistenza di una neurodegenerazione. I disturbi del metabolismo del ferro e della dopamina svolgono un ruolo centrale. La carenza di ferro è una causa comune e trattabile di RLS, ad esempio in gravidanza, nell’anemia perniciosa o nell’insufficienza renale e nella dialisi. I sintomi della RLS passeggera possono manifestarsi nel periodo post-operatorio a causa della perdita di sangue. La risonanza magnetica e gli esami post-mortem hanno mostrato una diminuzione delle concentrazioni di ferro nella substantia nigra, nel talamo e nei gangli basali [3,4]. Oltre alla risposta terapeutica alla levodopa, gli studi di imaging hanno dimostrato una densità ridotta del recettore D2 della dopamina nello striato e una riduzione del trasportatore della dopamina.
RLS secondaria
La causa più comune di RLS secondaria è rappresentata dalle malattie associate alla carenza di ferro. Inoltre, la prevalenza della RLS è aumentata in diverse malattie neurologiche, ad esempio la sclerosi multipla, la malattia di Huntington, la sclerosi laterale amiotrofica o il morbo di Parkinson. Anche l’ipo- e l’ipertiroidismo e la malattia polmonare cronica sembrano essere associati a un aumento del rischio di RLS. Inoltre, molti farmaci possono scatenare o aggravare la RLS, soprattutto i triciclici e altri antidepressivi, il litio, gli antistaminici, i neurolettici e l’alcol. Per definizione, la forma secondaria di RLS scompare dopo la rimozione del fattore scatenante.
Terapia della RLS
Nel trattamento della RLS, le cause potenzialmente reversibili devono essere affrontate prima di iniziare la terapia farmacologica. Questo include la sostituzione del ferro, della vitamina B12 o dell’acido folico, nonché l’identificazione e l’interruzione (se possibile) dei farmaci che possono scatenare la RLS. Poiché la sonnolenza diurna può peggiorare l’intensità della RLS, è importante anche mantenere una buona igiene del sonno. L’aumento del consumo di caffeina e di alcol non è consigliabile. La farmacoterapia distingue diverse classi di sostanze:
- Levodopa e agonisti della dopamina
- Leganti A2δ
- Gli oppioidi
- Benzodiazepine
Nella terapia dopaminergica, gli agonisti della dopamina sono oggi preferiti alla levodopa per il minor rischio di aumento (vedere il riquadro “Aumento”). I due agonisti della dopamina più comunemente utilizzati sono i seguenti: pramipexolo (Sifrol®), iniziando con 0,125 mg la sera e aumentando gradualmente fino a 0,5 mg o 0,75 mg; rotigotina (Neupro®) cerotti, 1-3 mg/24h. Gli effetti collaterali più comuni sono nausea, vertigini, ipotensione ortostatica, sonnolenza e disturbi del controllo degli impulsi. L’efficacia e il profilo favorevole degli effetti collaterali del pregabalin, un ligando A2δ, sono stati dimostrati in uno studio accuratamente randomizzato e in doppio cieco [5]. La dose iniziale è di 50-75 mg e in genere viene aumentata a 300 mg/d. Gli effetti collaterali sono vertigini e sonnolenza; il rischio di aumento è inferiore rispetto agli agonisti della dopamina. Nella RLS grave e nella risposta inadeguata ai ligandi A2δ e/o agli agonisti della dopamina, può essere utile la somministrazione aggiuntiva di oppioidi, in particolare di ossicodone (Oxycontin®) 5-10 mg o diidrocodeina (Codicontin®) 30-90 mg. Con gli oppioidi, c’è il rischio di un aumento delle apnee centrali. Infine, anche le benzodiazepine, in particolare il clonazepam (Rivotril®) 0,5-1 mg, possono alleviare la sofferenza. A differenza delle altre sostanze, le benzodiazepine agiscono aumentando la soglia di eccitazione, ma senza ridurre il numero di PLMS.

Messaggi da portare a casa
- La sindrome delle gambe senza riposo è una delle malattie neurologiche più comuni, con una prevalenza di circa il 7%.
- Le caratteristiche essenziali della RLS includono l’impulso a muoversi e il suo verificarsi a riposo, il peggioramento la sera e la notte e il miglioramento con il movimento.
- Le diagnosi differenziali importanti comprendono l’estesia da lesioni circoscritte alle gambe, i crampi alle gambe, la polineuropatia periferica, la radicolopatia, l’ansia, l’acatisia, il dolore muscolare, le posizioni scomode, il battito abituale del piede, l’edema della parte inferiore della gamba o l’infiammazione articolare.
- La malattia è per lo più ereditata in modo autosomico-dominante, con un’alta penetranza. I disturbi del metabolismo del ferro e della dopamina svolgono un ruolo centrale.
- Nella farmacoterapia si distinguono diverse classi di sostanze: (1) agonisti della levodopa e della dopamina, (2) leganti A2δ, (3) oppioidi e (4) benzodiazepine. Nella terapia dopaminergica, gli agonisti della dopamina sono oggi preferiti alla levodopa per il minor rischio di aumento.
Letteratura:
- Ekbom KA: Astenia crurum paraesthetica (gambe irritabili). Acta Med Scand 1944; 118: 197.
- Jiménez-Jiménez FJ, et al: Genetica della sindrome delle gambe senza riposo: un aggiornamento. Sleep Med Rev 2018; 39: 108-121.
- Connor JR, et al. : L’esame neuropatologico suggerisce un’alterata acquisizione di ferro nel cervello nella sindrome delle gambe senza riposo. Neurologia 2003; 61: 304309.
- Godau J, et al: Carenza di ferro cerebrale multiregionale nella sindrome delle gambe senza riposo. Mov Disord 2008; 23: 11841187.
- Allen RP, et al: Confronto tra pregabalin e pramipexolo per la sindrome delle gambe senza riposo. N Engl J Med 2014; 370: 621-631.
- Garcia-Borreguero D, et al: Linee guida per il trattamento di prima linea della sindrome delle gambe senza riposo/malattia di Willis-Ekbom, prevenzione e trattamento dell’aumento dopaminergico: una task force combinata dell’IRLSSG, dell’EURLSSG e della RLS-foundation. Sleep Med 2016; 21: 1-11.
InFo NEUROLOGIA & PSICHIATRIA 2018; 16(4): 12-15.