La sindrome, descritta per la prima volta dai due medici John Crigler e Victor Najjar nel 1952, è caratterizzata da un disturbo congenito del metabolismo della bilirubina. Le opzioni terapeutiche esistenti mirano a ridurre la quantità di bilirubina non coniugata nel sangue. Tuttavia, questo richiede talvolta procedure relativamente complesse. Le alternative includono il trapianto di fegato o eventualmente un trapianto di epatociti. Ma c’è una luce all’orizzonte: una terapia genica ha ottenuto risultati promettenti in una sperimentazione clinica.
La bilirubina è un prodotto di degradazione del pigmento rosso del sangue emoglobina e si forma quando i globuli rossi si rompono. [1–3]Normalmente, l’enzima UGT1A1 (UDP-glucuronosiltransferasi 1 polipeptide A1) catalizza la formazione del diglukuronide idrosolubile della bilirubina nel reticolo endoplasmatico liscio del fegato, che viene poi espulso nell’intestino attraverso i dotti biliari. Tuttavia, le persone affette dalla sindrome di Crigler-Najjar mancano di questo enzima, causando un accumulo di bilirubina nell’organismo che, senza trattamento, può portare a danni neurologici significativi o addirittura alla morte [1]. Nella sindrome di Crigler-Najjar di tipo 1, l’enzima UGT è completamente inattivo, mentre nel tipo 2 è fortemente ridotto [4]. Entrambe le forme sono causate da difetti genetici nel gene UGT1A1, sul cromosoma 2. A causa della natura genetica della malattia, entrambi i genitori devono essere portatori della mutazione affinché il figlio sia affetto da questa malattia [2]. Si stima che meno di 1 su 1 milione di neonati in tutto il mondo sia affetto dalla sindrome di Crigler-Najjar.
Aspetto clinico
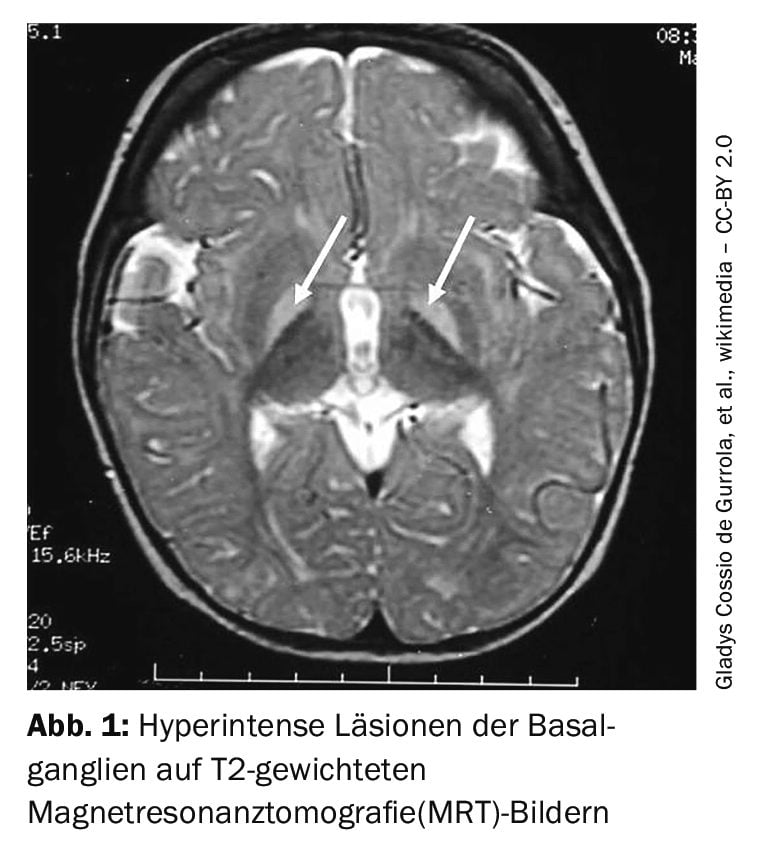
La sindrome di Crigler-Najjar di tipo 1 di solito si manifesta subito dopo la nascita con un’iperbilirubinemia eccessiva che, se non trattata, di solito porta al kernicterus con gravi danni neurologici. Di conseguenza, i pazienti affetti spesso muoiono nella prima infanzia se non vengono trattati. [11]I neonati sono particolarmente suscettibili ai danni neurologici causati dall’iperbilirubinemia, in quanto il fegato ancora in via di sviluppo è fortemente sollecitato dalla rottura dell’emoglobina fetale nei primi giorni di vita e la barriera emato-encefalica non è ancora ben sviluppata. Livelli di bilirubina sierica leggermente elevati e ittero non sono rari nei neonati, ma i livelli di bilirubina devono essere monitorati attentamente in caso di segni di aumento.
La sindrome di Crigler-Najjar di tipo 2 è meno grave del tipo 1, dove il kernicterus è raro, ma i sintomi fastidiosi con ingiallimento della pelle e prurito esteso possono compromettere gravemente la qualità della vita [4]. In alcune persone, la diagnosi non viene fatta fino all’età adulta, come nel caso riportato nel riquadro [5]. Il kernicterus è raro nel tipo 2, ma può verificarsi soprattutto quando la persona colpita è malata, non mangia o è sotto anestesia [2]. Se l’ittero grave a pochi giorni dalla nascita possa essere la sindrome di Crigler-Najjar può essere confermato dalla valutazione clinica, dall’anamnesi familiare e dagli esami genetici e di laboratorio. Un dato classico è, ad esempio, un livello elevato di bilirubina non coniugata nel sangue o la mancanza di bilirubina coniugata nella bile. I test genetici per identificare le mutazioni nel gene UGT1A1 possono confermare la diagnosi [2].
Caso clinico: diagnosi di CNS di tipo 2 in età adulta Un uomo di 21 anni è stato tormentato da episodi ricorrenti di ittero fin dalla prima infanzia. Negli ultimi 6 mesi, è stato particolarmente disturbato da un ittero persistente, accompagnato da vomito occasionale. |
| Anamnesi: la sua nascita non ha avuto complicazioni, c’è stato ittero neonatale e non è stato necessario fare trasfusioni di sangue. Ha raggiunto i traguardi di sviluppo previsti per la sua età e non c’era motivo di preoccuparsi. All’età di 5 anni, i genitori hanno notato per la prima volta una strana colorazione giallastra degli occhi, che non era accompagnata da febbre, prurito, dolore addominale o feci color argilla, ma l’urina era fortemente scolorita. Il paziente si è quindi sottoposto a vari trattamenti alternativi e complementari. Purtroppo, nessuna di queste misure ha portato a una guarigione completa della sua condizione. Secondo i ricordi dei genitori del paziente, il livello più alto di bilirubina sierica mai misurato era di 12 mg/dL. |
| Indagini diagnostiche attuali: L’esame attuale ha rivelato ittero senza organomegalia. Anche altre indagini cliniche hanno mostrato risultati normali e non hanno offerto una spiegazione immediata per l’ittero persistente. Tuttavia, le indagini di routine hanno rivelato un’iperbilirubinemia indiretta con enzimi epatici normali. L’esame ecografico dell’addome era irrilevante. È stato quindi eseguito un esame emolitico completo, ma tutti i test erano negativi. In base all’esordio, al decorso e alla presenza di iperbilirubinemia non coniugata, è stata fatta una diagnosi provvisoria di iperbilirubinemia non emolitica non coniugata. Con il sospetto di una sindrome di bilirubinaemia indiretta congenita, è stata avviata un’analisi per le mutazioni UGT1A1, che è risultata positiva e ha indicato la presenza di un deficit enzimatico parziale. Ciò ha portato alla diagnosi definitiva della sindrome di Crigler-Najjar di tipo 2. |
| Terapia: per gestire i sintomi del paziente e migliorare la sua qualità di vita, gli è stato somministrato del fenobarbital orale alla dose di 5 mg/kg. In modo notevole, è stata osservata una riduzione significativa dei livelli di bilirubina sierica del paziente in sole due settimane dall’inizio del trattamento. Pertanto, la terapia si è dimostrata efficace. |
| secondo [5] |
Le opzioni terapeutiche attualmente disponibili
L’obiettivo principale del trattamento dei pazienti con la sindrome di Crigler-Najjar è quello di ridurre la quantità di bilirubina non coniugata nel sangue nel modo più rapido e costante possibile. Questo è raccomandato per la sindrome di Crigler-Najjar di tipo 1 (CNS I) e di tipo 2 (SNC II) in modi diversi [2].
Il trattamento conservativo del SNC I si basa su tre pilastri [4]:
- Fototerapia quotidiana costante con luce blu (rende la bilirubina idrosolubile).
- Somministrazione di tinprotoporfirina, un inibitore dell’emossigenasi (riduce gli aumenti di bilirubina).
- Somministrazione di carbonato di calcio e fosfato di calcio (aumenta la secrezione di bilirubina non coniugata nell’intestino)
Questa terapia può prolungare l’aspettativa di vita e ritardare l’insorgenza di complicazioni neurologiche. Un’altra opzione terapeutica, il trapianto di fegato, deve essere perseguita il prima possibile. Il trapianto allogenico di epatociti è attualmente in fase sperimentale.
La SNC II viene trattata con la somministrazione di fenobarbital una volta al giorno [4]. In alternativa, è possibile anche la rifampicina. Inducendo l’attività enzimatica, la concentrazione di bilirubina nel plasma può essere ridotta a livelli sicuri.
Studio sulla terapia genica: opportunità e rischi D’Antiga et al. [6,7]ha studiato la sicurezza e l’efficacia di una singola infusione endovenosa di un vettore AAV codificante UGT1A1 in 5 pazienti con sindrome di Crigler-Najjar. |
| In tre dei pazienti trattati con una dose più elevata, i livelli di bilirubina sono scesi al di sotto di 30 µmol per litro (17,5 mg/dl), in modo da poter interrompere la fototerapia per i successivi 18 mesi di follow-up [7]. Tuttavia, la normalizzazione completa del livello di bilirubina non è stata raggiunta in nessun caso. |
| Secondo Di Dato et al. [6,8]la durata dell’efficacia di una singola infusione del vettore AAV è attualmente ancora poco chiara. Inoltre, è stato riportato che nei pazienti con emofilia, la terapia genica può portare allo sviluppo di anticorpi neutralizzanti AAV persistenti, ad alto titolo e cross-reattivi, che potrebbero escludere la possibilità di ulteriori somministrazioni del vettore [9]. [10]Le infusioni multiple di vettori AAV possono anche comportare un rischio di genotossicità. |
La terapia genica come potenziale metodo di trattamento alternativo
L’uso di vettori AAV (Adeno-Associated Virus), ad esempio, è stato approvato dalla Food and Drug Administration (FDA) statunitense per la terapia genica sostitutiva per i pazienti con atrofia muscolare spinale e cecità congenita. [1,7]I risultati iniziali di uno studio clinico sulla sindrome di Crigler-Najjar suggeriscono che la terapia genica basata su AAV potrebbe servire come potenziale trattamento alternativo per questa malattia potenzialmente letale. Il trattamento, attualmente in fase di sperimentazione, è stato sviluppato dai ricercatori di Généthon**. Si tratta di fornire alle cellule epatiche una copia del gene UGT1A1, che codifica un enzima che facilita la rimozione della bilirubina. Le osservazioni iniziali dello studio CureCN (“Adeno-Associated Virus Vector-Mediated Liver Gene Therapy for Crigler-Najjar Syndrome”) suggeriscono che la terapia genica potrebbe essere un potenziale trattamento alternativo. [Adeno-assoziiertes Virus] “Siamo molto entusiasti dei risultati ottenuti finora in questa sperimentazione della terapia genica mediata da AAV per il trattamento della sindrome di Crigler-Najjar”, ha osservato il dottor D’Antiga [1]. “Il trattamento ha dimostrato di essere sicuro a dosi appropriate e di essere in grado di colpire la malattia a tal punto che la prima paziente ha potuto interrompere la fototerapia quotidiana, eliminando il rischio di danni neurologici. Il grado di miglioramento della seconda paziente suggerisce che anche lei potrebbe presto essere in grado di interrompere la fototerapia” [1].
** Genethon fa parte dell’Istituto di Bioterapie per le Malattie Rare (BIRD).
Un articolo pubblicato nel 2024 da Di Dato et al. [6] valuta anche la terapia genica come una promettente alternativa di trattamento, anche se gli autori sottolineano che ci sono ancora alcune domande senza risposta riguardo all’efficacia e alla sicurezza di questo approccio terapeutico, che sono oggetto di indagini in corso (riquadro).
Letteratura:
- «Klinische Studie verschafft Menschen Hoffnung, die an einer seltenen genetischen Lebererkrankung leiden», https://cordis.europa.eu/article/id/430456-clinical-trial-gives-hope-to-sufferers-of-rare-genetic-liver-disease/de, (último acesso em 29.08.2024).
- «Crigler-Najjar-Syndrom», https://liverfoundation.org, (último acesso em 29.08.2024).
- «UDP-Glukuronyltransferase-Mutation (UGT1A1*28)», www.labor-duesseldorf.de/examination/view/udp-glukuronyltransferase-mutation-ugt1a128, (último acesso em 29.08.2024).
- «Crigler-Najjar-Syndrom», https://flexikon.doccheck.com, (letzter Abruf 29.08.2024).
- Rijal D, et al.: A rare case of Crigler-Najjar syndrome type 2: A case report and literature review. Clin Case Rep 2023; Nov 13; 11(11): e8176.
- Di Dato F, D’Uonno G, Iorio R: Crigler-Najjar syndrome: looking to the future does not make us forget the present. Orphanet J Rare Dis. 2024 Mar 7; 19(1): 102.
- D’Antiga L, et al.: Gene Therapy in patients with the Crigler-Najjar Syndrome. NEJM 2023; 389(7): 620–631.
- Aronson SJ, Ronzitti G, Bosma PJ: What’s next in gene therapy for Crigler-Najjar syndrome? Expert Opin Biol Ther 2023; 23(2): 119–121.
- George LA, et al.: Long-term Follow-Up of the First in Human Intravascular Delivery of AAV for Gene transfer: AAV2-hFIX16 for severe Hemophilia B. Mol Ther 2020; 28(9): 2073–2082.
- Sabatino DE, et al.: Evaluating the state of the science for adeno-associated virus integration: an integrated perspective. Mol Ther 2022; 30(8): 2646–2663.
- Wikipedia: Kernicterus, https://en.wikipedia.org, (ultimo accesso 29/08/2024).
HAUSARZT PRAXIS 2024; 19(9): 44–45