Oltre alla clamidia e ai gonococchi, ci sono numerosi agenti patogeni che possono causare l’uretrite. Occasionalmente, le caratteristiche cliniche possono indicare il germe responsabile, come la dolorabilità marcata e la meatite negli adeno- e negli herpesvirus o la balanopostite concomitante nel Mycoplasma genitalium. La diagnosi al microscopio del fluoro permette di differenziare la gonorrea dalla NGU, consente una terapia immediata e può inoltre fornire indicazioni sull’uretrite virale. Soprattutto nelle forme croniche o ricorrenti, è necessario effettuare un’ampia chiarificazione dei patogeni, prendendo in considerazione Mycoplasma genitalium e Trichomonas vaginalis. Nei casi di fallimento del trattamento con la terapia standard (soprattutto per M. genitalium e U. urealyticum), si deve ricorrere all’azitromicina prolungata.
Dopo aver escluso un’infezione delle vie urinarie, è necessario distinguere tra una forma non infettiva e una infettiva di uretrite (tab. 1). Le cause tipiche dell’uretrite non infettiva sono cause meccaniche-traumatiche; anche cause chimiche (ad esempio disinfettanti, saponi) o locali come anomalie congenite, fimosi, neoplasie possono essere accompagnate da uretrite non infettiva. Tradizionalmente, l’uretrite infettiva si divide in due gruppi: L’uretrite gonococcica (GU) e la cosiddetta uretrite non gonococcica (NGU). Questa classificazione è nata storicamente per distinguere la NGU – un gruppo di infezioni dalla sintomatologia simile con un’eziologia, all’epoca, poco chiara, eterogenea e difficile da determinare – dall’uretrite gonorroica, molto più studiata e più grave. La NGU, un tempo chiamata uretrite aspecifica, era relativamente rara insieme alla gonorrea, ma oggi supera di gran lunga la sua incidenza e non di rado è asintomatica. Di seguito, tuttavia, vengono discussi solo l’uretrite infettiva non gonorroica e il suo spettro patogeno, le fasi di chiarimento necessarie e le misure terapeutiche.

La prevalenza dello spettro patogeno causale è riportata in modo diverso a seconda delle regioni (Tab. 1). La percentuale di pazienti in cui non è stato possibile isolare alcun agente patogeno dipende dalla diagnostica eseguita e dal fatto che, ad esempio, le uretriti virali sono più frequenti di quanto si pensasse in precedenza, ma vengono raramente ricercate. La NGU è presente se la preparazione dello striscio colorato dell’uretra contiene più di cinque leucociti polimorfonucleati.
per campo visivo (ingrandimento totale 400x) in assenza di diplococchi intracellulari.
Clamidia
La Chlamydia trachomatis comprende un totale di 15 sierotipi definiti da diversi antigeni proteici, designati dalle lettere A-C, D-K e L1-L3, che causano diverse malattie. I sierovari D-K sono causativi di uretrite, cervicite, endometrite e salpingite. I patogeni non infettano l’epitelio squamoso, ma solo quello cilindrico e hanno una prevalenza del 4-5% nelle donne in Europa.
La C. trachomatis si trova nel 15-41% di tutti i casi di uretrite negli uomini. Tuttavia, nella letteratura degli ultimi dieci anni, la frequenza della clamidia come agente patogeno non è riportata in modo coerente. La trasmissione avviene attraverso contatti sessuali non protetti, con l’età inferiore ai 20 anni, la promiscuità e il mancato o errato uso del preservativo come fattori di rischio. Si raccomanda uno screening annuale per le pazienti sessualmente attive di età inferiore ai 25 anni, nonché per le donne di età superiore ai 25 anni con fattori di rischio (partner multipli, nuovi partner). Tuttavia, le infezioni genitali da clamidia colpiscono tutti i gruppi sociali allo stesso modo.
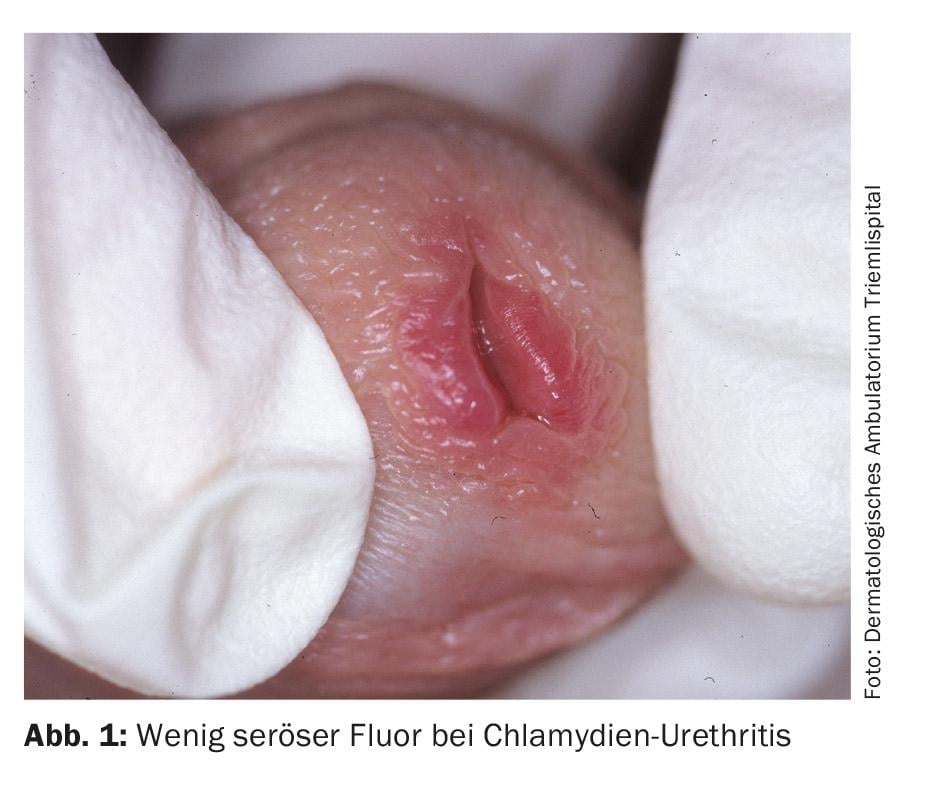
L’infezione da clamidia negli uomini si nota dopo un periodo di incubazione da sette giorni a tre settimane, con perdite sierose. Inoltre, sono state segnalate una sensazione di bruciore e alguria. All’esame, a parte un discreto arrossamento dell’orifizio uretrale e l’adesione dell’orifizio uretrale, di solito non ci sono altri reperti (Fig. 1) . Nel 30-50% di tutti gli uomini infetti, l’infezione è asintomatica. Il sito più comune di infezione da clamidia nelle donne è la cervice, con un’infezione asintomatica fino al 70%. Se non viene trattata, un’infezione genitale da clamidia nelle donne persiste in media per due anni. Questa infezione cronica asintomatica sembra essere la causa principale dell’occlusione tubarica bilaterale, che è la causa più comune di infertilità nelle donne e si stima che colpisca oltre 100.000 donne in Germania. Le manifestazioni cliniche sono perdite genitali biancastre-giallastre con prurito e bruciore all’introito vaginale. Non di rado le infezioni faringee sembrano essere presenti anche in modo asintomatico, ma non richiedono una terapia diversa.
Diagnosi: nelle donne, gli agenti patogeni vengono rilevati mediante esami dello striscio della cervice o della vagina o analisi delle urine (un po’ meno sensibili) utilizzando la PCR. Negli uomini, può essere eseguito anche un esame delle urine o uno striscio dell’uretra.
A causa delle loro dimensioni ridotte e della bassa affinità per il colorante, le clamidie non possono essere viste in modo nativo o tramite colorazione. Essendo batteri intracellulari obbligati, anche la coltivazione è difficile, motivo per cui la coltura non viene quasi più effettuata.
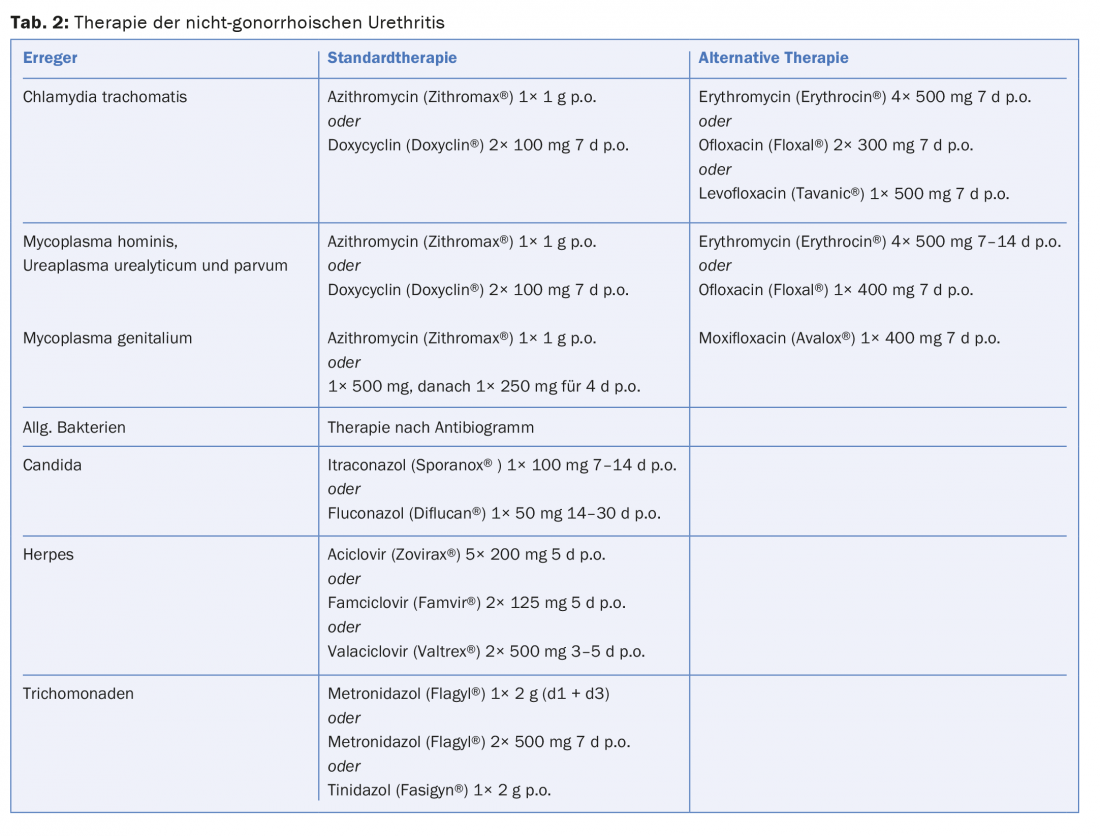
Terapia: le infezioni urogenitali non complicate possono essere trattate con doxiciclina 2× 100 mg per sette giorni o azitromicina 1 g una volta. L’efficacia dei due antibiotici è quasi equivalente, con una risposta leggermente migliore con la doxiciclina, ma una migliore compliance con l’azitromicina. Come documentato di recente, i tassi di guarigione nella NGU sembrano in qualche modo diminuire con queste terapie standard, ma il passaggio ad altri farmaci non è raccomandato. Sulla base dei dati attuali, l’azitromicina, come l’eritromicina, può essere considerata sicura in gravidanza. In alternativa, l’amoxicillina può essere somministrata 3× 500 mg/d per sette giorni durante la gravidanza.
Micoplasma
I micoplasmi sono batteri gram-negativi immobili. Si distinguono dagli altri batteri per le dimensioni ridotte delle cellule, il genoma piccolo e la mancanza di parete cellulare. Su terreni di coltura speciali, si possono distinguere gli ureaplasmi (Ureaplasma urealyticum) e i micoplasmi non-ureaplasma (Mycoplasma hominis). In seguito, U. urealyticum è stato suddiviso in Biovar 1 e Biovar 2. Nel 1999, la Biovar 1 è stata classificata come una nuova specie batterica indipendente con il nome di U. parvum, mentre la Biovar 2 è stata designata U. urealyticum. Nel 1981, è stata scoperta un’altra variante – Mycoplasma genitalium – che è stata successivamente descritta in diversi studi come agente causale dell’uretrite acuta e sempre più spesso anche come agente causale dell’uretrite cronica, ma anche della cervicite, dell’endometrite e dell’infertilità femminile.
L’importanza dei micoplasmi genitali per lo sviluppo delle malattie a trasmissione sessuale è controversa. M. hominis non sembra essere responsabile della NGU nei maschi, nonostante il rilevamento nel tratto urogenitale. U. urealyticum (Biovar 2) può anche essere frequentemente isolato dal tratto genitale di donne e uomini sani; sono state ipotizzate possibili manifestazioni cliniche in pazienti più giovani, con un’alta concentrazione batterica, con il sierotipo specifico Biovar 2 e con infezione iniziale. L’importanza di U. parvum rimane poco chiara.
Le infezioni da micoplasma possono causare sintomi clinici di uretrite negli uomini, oltre a decorsi silenziosi. Le infezioni da U. urealyticum e M. genitalium, in particolare, si manifestano sotto forma di uretrite acuta, ma anche cronica, con disuria e fluoro. Una caratteristica clinica particolare dell’uretrite causata da M. genitalium è l’associazione significativamente frequente con balanite e/o postite, che non si osserva con la clamidia e l’ureaplasma.
Diagnostica: a causa delle loro dimensioni e della bassa affinità con i coloranti, non è possibile rilevare i micoplasmi nei preparati Gram. U. urealyticum, U. parvum e M. hominis vengono rilevati tramite PCR o coltura, M. genitalium esclusivamente tramite PCR. I test sierologici non sono significativi per la diagnosi delle infezioni da micoplasmi nella pratica clinica quotidiana.
Terapia: le tetracicline, gli antibiotici macrolidi e i chinoloni sono i farmaci di scelta. Doxiciclina 2× 100 mg/d per sette giorni o azitromicina 1× 1 g sono considerati la terapia standard per M. hominis, U. parvum e U. urealyticum (Tab.2). Nelle forme croniche di uretrite, può essere necessaria una durata più lunga della terapia. L’azitromicina è raccomandata per il trattamento dell’uretrite genitale, perché il suo effetto è chiaramente superiore a quello delle tetracicline. I fallimenti del trattamento sono stati osservati sempre più di recente, ed è per questo che, in caso di mancata risposta di 1 g di azitromicina, è preferibile un trattamento di diversi giorni. (Tab.2). La moxifloxacina è considerata il farmaco di riserva assoluta; tuttavia, recentemente sono stati descritti anche fallimenti del trattamento iniziale in casi di resistenza ai macrolidi e ai chinoloni. Con l’aumento dello sviluppo della resistenza, l’importanza di altri farmaci, come la sitafloxacina o la gatifloxacina, deve essere ulteriormente studiata per scongiurare la minaccia che la M. genitalis diventi non trattabile.
Batteri della flora orale e anale
Gli uretriti possono essere causati da numerosi altri batteri. Lo stafilococco aureo può causare uretrite, cistite o prostatite, soprattutto nei pazienti con cateteri uretrali. Anche gli streptococchi e soprattutto gli enterococchi possono causare l’uretrite. L’E. coli può raramente causare uretrite, cistite, prostatite o epididimite e pielonefrite negli uomini dopo un rapporto anale. Raramente, un’infezione da Pseudomonas può anche presentarsi con un’uretrite.
Gli agenti patogeni della flora orale, come l’haemophilus influenzae e il parainfluenzae, ma anche i meningococchi, possono non di rado essere causali, soprattutto perché oggi il sesso orale è considerato da molti come presumibilmente non problematico per quanto riguarda la trasmissione di infezioni e di conseguenza pochi preservativi vengono utilizzati durante il sesso orale. La prevalenza effettiva degli uretriti causati da Haemophilus è sconosciuta perché, da un lato, non c’è l’obbligo di segnalazione e, dall’altro, l’agente patogeno di solito non viene incluso nel work-up.
Diagnosi: per stabilire la diagnosi, si deve sempre cercare l’evidenza batteriologica dell’agente patogeno mediante una coltura.
Terapia: la terapia dipende dall’agente patogeno e dall’antibiogramma.
Candida
La Candida albicans può portare all’uretrite secondaria alla balanite o alla vulvovaginite, soprattutto in presenza di diabete mellito o immunodeficienza.
Diagnostica: il rilevamento viene effettuato nella preparazione diretta e tramite coltura micologica.
Terapia: per la terapia si utilizzano derivati dell’imidazolo come l’itraconazolo 100 mg/d per 7-14 giorni o il fluconazolo 50 mg/d per 14-30 giorni (Tab. 2).
I virus
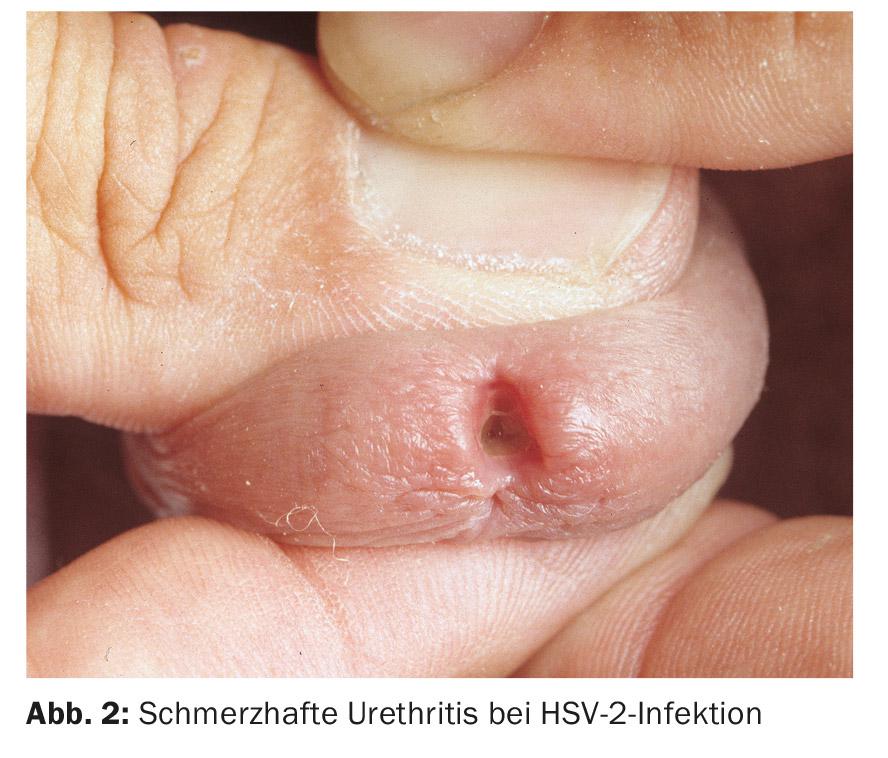
L’uretrite virale deve essere sospettata se i chiarimenti batteriologici sono stati improduttivi. Nell’uretrite da virus herpes simplex (HSV), si verifica uno scarico sieroso doloroso, spesso accompagnato da eruzioni erpetiformi sui genitali esterni. Più raramente, si verifica un’infezione da HSV esclusivamente intrauretrale (Fig. 2).
Studi recenti hanno dimostrato che l’HSV di tipo 1 causa la NGU più frequentemente dell’HSV di tipo 2. La percentuale di HSV nella NGU è riportata in modo diverso, ma in uno studio ha rappresentato fino al 12%. Anche gli adenovirus possono causare l’uretrite. Di solito è caratterizzata da una marcata meatite e da dolore (Fig. 3); nella maggior parte dei casi è anche accompagnata da una congiuntivite altamente contagiosa (Fig. 4) . I cumuli di cellule mononucleari nella preparazione diretta possono essere diagnosticamente rivoluzionari. Soprattutto dopo un contatto orale non protetto, i virus dell’adeno- e dell’herpes simplex devono essere considerati come la causa in assenza di rilevamento di agenti patogeni, di dolorabilità pronunciata e di carneite. Anche i virus di Epstein-Barr sembrano avere un ruolo.
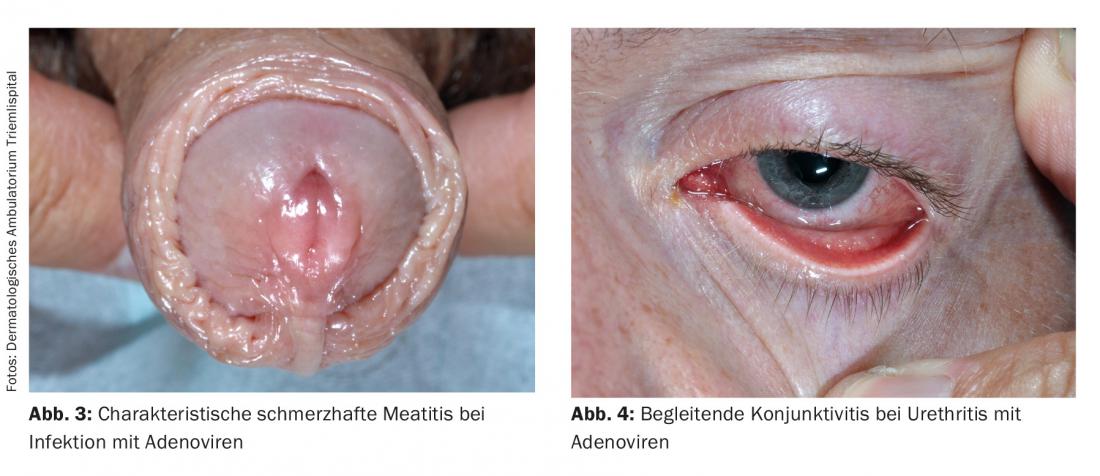
Diagnostica: nel caso di infezioni da herpes, si raccomanda un test di striscio. Il rilevamento culturale dell’HSV richiede circa 48 ore. I virus possono essere ottenuti solo da lesioni fresche per la coltivazione. Il materiale dello striscio può essere analizzato entro poche ore mediante PCR. Sia la coltura che la PCR possono essere effettuate anche dall’urina. Anche la rilevazione dell’antigene mediante immunofluorescenza è adatta alla diagnosi. La rilevazione degli adenovirus mediante PCR può essere effettuata da uno striscio o dall’urina.
Terapia: la terapia dell’uretrite erpetica viene effettuata con analoghi nucleosidici, se necessario.
Trichomonadi
Il Trichomonas vaginalis è un flagellato di forma ovale con quattro flagelli e una membrana ondulata. La tricomoniasi è un’infezione a trasmissione sessuale che si verifica in tutto il mondo e la sua prevalenza dipende dal comportamento sessuale a rischio. Nelle statistiche, ci sono notevoli differenze nei tassi di infezione tra i singoli gruppi di popolazione e tra i Paesi industrializzati e quelli in via di sviluppo. In Svizzera, ad esempio, questa infezione gioca un ruolo minore, a differenza di Seattle, dove fino al 20% dei casi di NGU negli uomini è causato da questo patogeno.
Diagnosi: l ‘esame microscopico della preparazione nativa con NaCl 0,9% della volta vaginale, della cervice e dell’uretra produce tassi di successo fino al 75%. La polarizzazione o la microscopia in campo oscuro aumentano il tasso di successo.
È disponibile una gamma di terreni di coltura adatti con una sensibilità di circa il 95%. La coltura viene offerta solo in pochissimi laboratori. Anche la PCR, che ha la sensibilità più elevata, non è ancora molto diffusa.
Terapia: la tricomoniasi può essere trattata con metronidazolo 1× 2 g con eventuale ripetizione dopo due giorni o con 2× 500 mg/d per sette giorni, ma si noti l’effetto antabuse-like. Raramente, si può osservare una resistenza al metronidazolo. Anche il tinidazolo 1× 2 g può essere utilizzato come opzione di trattamento. Il tinidazolo ha un’emivita più lunga, minori effetti collaterali e un tasso di guarigione leggermente superiore.
Un esempio di un possibile approccio all’uretrite è elencato nella tabella 3.

Letteratura dell’autore
PRATICA DERMATOLOGICA 2015; 25(4): 5-10