La brachiterapia (BT) è una forma di radioterapia in cui una sorgente radioattiva viene collocata con precisione nel tumore o nel letto tumorale, di solito solo per un breve periodo. È indicato per un ampio spettro di entità tumorali. Questa forma di radiazione altamente precisa è limitata alla regione a rischio e consente di ottenere una dose elevata risparmiando i tessuti circostanti.
La brachiterapia (BT) è una forma di radioterapia in cui una sorgente radioattiva viene collocata con precisione nel tumore o nel letto tumorale, di solito solo per un breve periodo. È indicato per un ampio spettro di entità tumorali [1]. La dose di radiazioni focalmente elevata con una bassa esposizione simultanea del tessuto sano circostante spiega i successi del trattamento. La prima parte dell’articolo di revisione spiegherà gli aspetti fisici e pratici generali della BT. La seconda parte metterà in evidenza l’uso basato sull’evidenza della BT per le indicazioni più importanti e il rispettivo processo di trattamento.
Terminologia
Il prefisso “brachy” deriva dal greco e significa “breve”, come la radiazione a corto raggio che caratterizza questa forma di trattamento. Nei Paesi di lingua francese, si utilizza il termine “Curiethérapie”, dal nome di Marie e Pierre Curie, che hanno gettato importanti basi per la BT con la scoperta del radio e la proposta, intorno al 1901, di introdurre una fonte di radiazioni in un tumore. La BT deve essere distinta dalle terapie con radionuclidi della medicina nucleare (ad esempio, la terapia con lutezio-PSMA); a differenza di queste forme di terapia, la radio-oncologia utilizza sorgenti chiuse (e non aperte) e le applica in modo localmente controllato (e non sistemico).
Irradiazione “dall’interno vs. esterno” – BT vs. EBRT
Schematicamente, si possono distinguere due forme di applicazione della dose in radio-oncologia: l’irradiazione percutanea (radioterapia a fasci esterni, EBRT) e la BT. Con le tecniche EBRT (come la radioterapia a intensità modulata, la radiazione stereotassica o la protonterapia), il fascio terapeutico viene generato all’esterno del paziente e il dispositivo di radiazione può essere acceso e spento. Nella BT, una sorgente radioattiva di pochi millimetri viene introdotta nel tumore o nel letto tumorale, di solito solo per un breve periodo. Qui la sorgente è continuamente attiva, può essere estesa e ritratta, ma non accesa o spenta. L’intensità delle radiazioni diminuisce nel tempo in base al decadimento naturale del radionuclide selezionato (nel caso dell’iridio-192, la metà dell’attività originale è ancora presente dopo circa 2,5 mesi). Per poter mantenere il tempo di trattamento costantemente basso, la clinica per l’Iridio-192, ad esempio, utilizza un metodo di trattamento speciale. un cambio di sorgente viene effettuato ogni 3-4 mesi.
In radioterapia, le incertezze di posizionamento o dovute ai movimenti intrinseci degli organi vengono compensate con un margine di sicurezza aggiuntivo, in genere di 3-5 millimetri, intorno al volume di trattamento desiderato (il cosiddetto “margine PTV”). Poiché l’applicatore o la sorgente di radiazioni si muove con il tumore (letto) durante la BT, questo margine di sicurezza viene omesso – il volume di irradiazione è quindi più piccolo. L’influenza del margine di sicurezza sul volume totale può essere ben illustrata dall’esempio spesso citato di un’arancia [2]. Se si toglie la buccia di un’arancia di pochi millimetri, il suo volume si dimezza (il volume della sfera si riduce con la terza potenza del raggio). Con il BT, si può fare a meno del margine di sicurezza (cioè la ‘buccia d’arancia’), limitando così il volume di irradiazione alla regione effettivamente a rischio.
Forme di BT
A seconda del tipo di applicazione scelta, degli strumenti utilizzati o del tasso di dose, la BT può essere classificata in modo diverso. Per quanto riguarda la posizione del tessuto tumorale da coprire con l’applicatore, si distingue tra brachiterapia di contatto, BT intracavitaria e BT interstiziale:
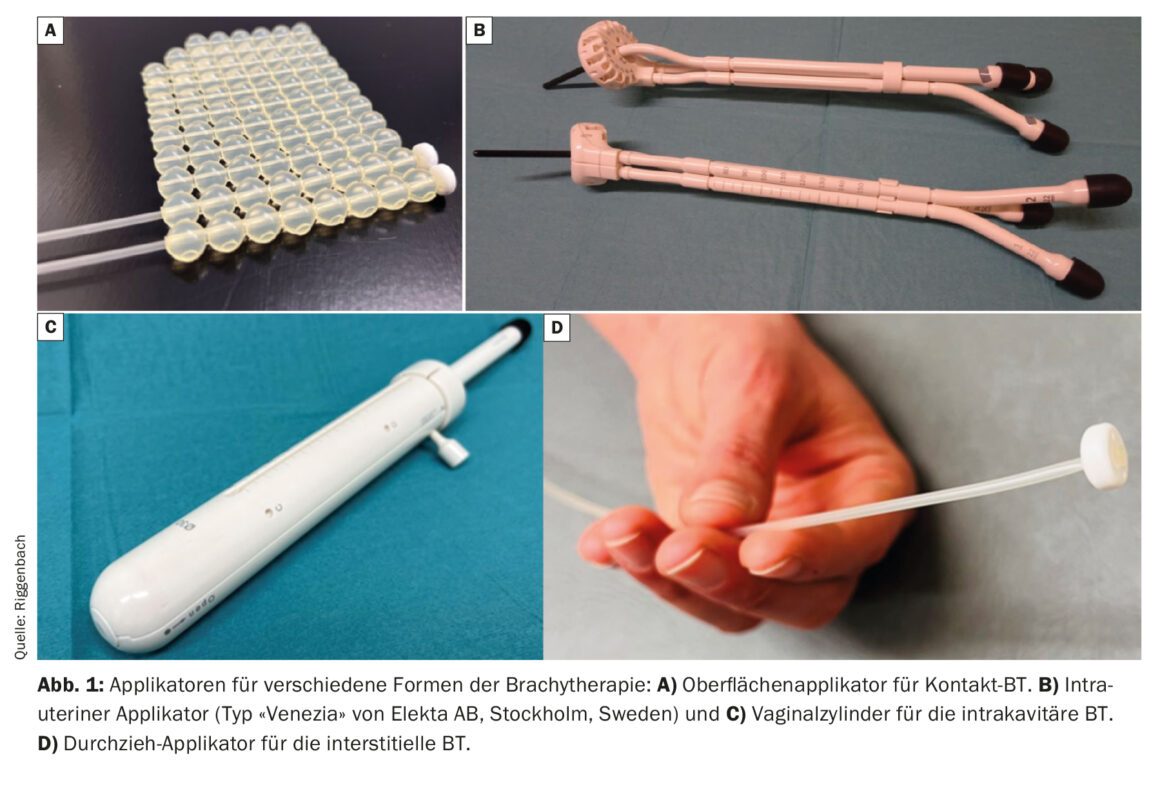
Con la brachiterapia di contatto, si possono applicare alla pelle dei moulage su misura. I cateteri sono integrati in questi moulage, che sono distanziati di circa 1 cm l’uno dall’altro e di circa 5 mm dalla pelle [3]. Una forma speciale di terapia di contatto è la radioterapia intraoperatoria; in questo caso il sito chirurgico da cui il tumore è stato precedentemente resecato può essere trattato come una superficie tumorale ancora microscopica (Fig. 1) [4,5].
Con la BT intracavitaria, la sorgente di radiazioni viene avvicinata al volume bersaglio attraverso le cavità naturali del corpo. Le indicazioni comuni sono i tumori del tratto genitale femminile (inserimento di un cilindro vaginale per il trattamento della cupola vaginale nel carcinoma endometriale operato o inserimento di un applicatore intrauterino nella radioterapia definitiva del carcinoma cervicale) [6,7]. Per la BT di cavità allungate (esofago [8], bronco, rinofaringe o retto) esistono applicatori speciali di diversi diametri e lunghezze.
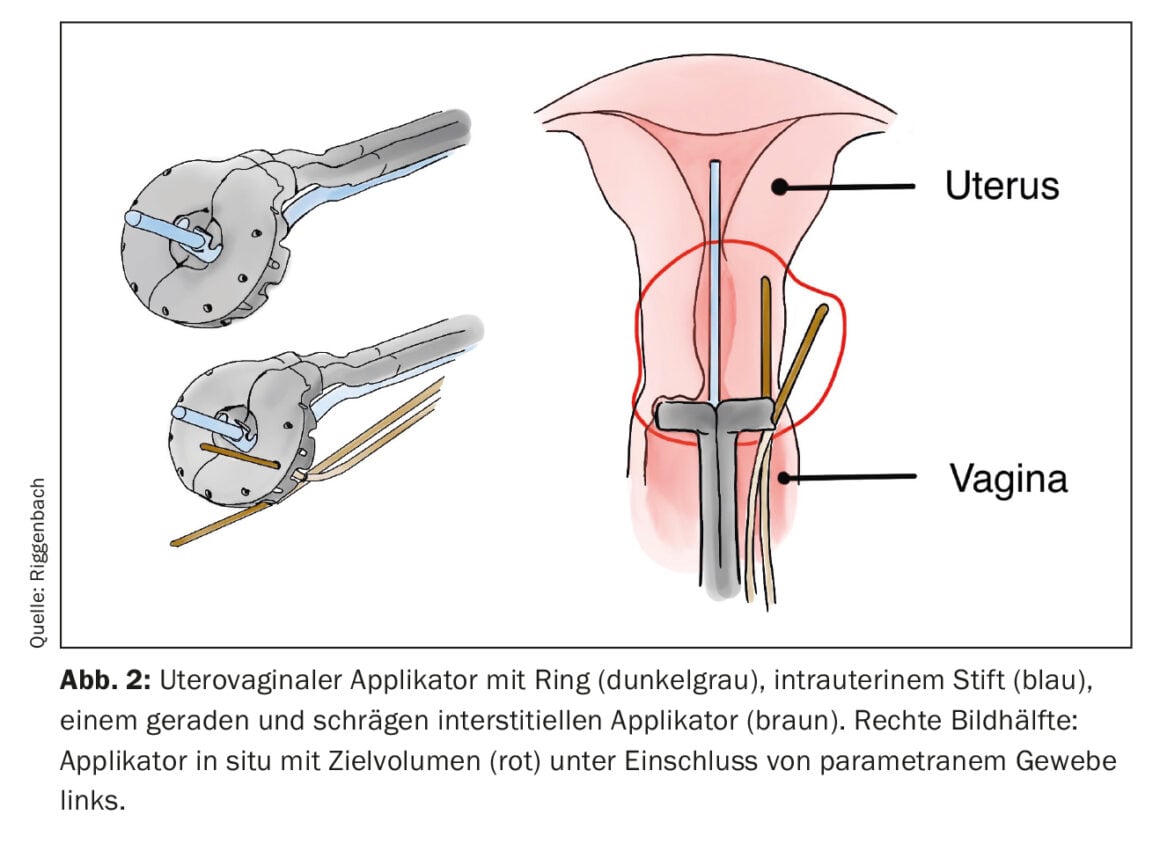
Se la regione target da trattare è più lontana dalla pelle o dalla mucosa, o se il tumore supera un certo spessore, la BT interstiziale è più adatta. A tale scopo, i tubi di plastica flessibili vengono inseriti direttamente nel tumore o nel letto tumorale attraverso guide di metallo o di plastica rigida (i cosiddetti cribbing). Esempi comuni di utilizzo della BT interstiziale sono l’irradiazione parziale del seno o il trattamento aggiuntivo dei parametrici tramite aghi interstiziali nel carcinoma cervicale. Con una disposizione parallela ed equidistante degli applicatori inseriti interstizialmente, è possibile una distribuzione della dose più omogenea. Per la disposizione regolare, il lancing può essere supportato da disposizioni di fori prodotte industrialmente (ad esempio, sulla superficie anulare degli applicatori uterovaginali) (Fig. 2) . In alternativa, l’inserimento è guidato dall’immagine con la tecnica a mano libera.
Classificata in base all’intensità della dose (numero di raggi per volta), l’irradiazione continua a lungo termine (LDR, low-dose rate BT) può essere distinta dall’irradiazione frazionata a breve termine (HDR, high-dose rate BT). Determina il radionuclide selezionato. Nella LDR-BT, che viene ancora utilizzata principalmente per il trattamento della prostata, di solito si utilizza lo iodio-125 come sorgente radioattiva. I semi incapsulati di iodio-125 vengono posizionati in modo permanente a livello interstiziale.
Per l’HDR-BT temporaneo, l’emettitore più comunemente utilizzato è l’Iridium-192. Grazie all’elevata velocità di dose, la sorgente ha già depositato la dose desiderata nel tumore (o nel letto) dopo poco tempo e viene rimossa subito dopo. Affinché l’inserimento e la rimozione siano precisi al secondo e al millimetro, occorre prima posizionare un applicatore, un ago o un catetere, attraverso la cui cavità si può guidare la sorgente nella procedura di post-caricamento.
Una forma speciale di HDR BT è la PDR (pulsed dose rate) BT, in cui una sorgente HDR viene tipicamente utilizzata per erogare un impulso terapeutico ogni ora, ad esempio tramite un generatore di impulsi. una settimana di trattamento in regime di ricovero. Anche se biologicamente favorevole al tumore, la PDR viene sempre più spesso sostituita dalla HDR-BT a livello internazionale per motivi logistici e attualmente non viene offerta in nessun centro in Svizzera.
Principi fisici
Il motivo fisico per cui le radiazioni utilizzate nella BT sono chiamate a corto raggio è la legge del quadrato della distanza: se la distanza dalla sorgente viene raddoppiata, la dose si riduce a un quarto. Poiché nella BT la sorgente si trova direttamente accanto all’area da irradiare (cioè la distanza è ridotta), questa legge è molto più importante rispetto all’irradiazione percutanea con l’acceleratore lineare (dove la distanza tra il tumore e la “sorgente” o testa dell’acceleratore è in genere di circa un metro). Quando la distanza aumenta da 1 cm a 2 cm o 3 cm, la dose per la BT diminuisce rispettivamente del 75% o del 90%, mentre si riduce solo di qualche punto percentuale per la terapia percutanea. Naturalmente, nel caso dell’irradiazione percutanea, per poter spiegare l’effettiva distribuzione della dose, si devono prendere in considerazione molti altri fattori, come l’attenuazione della radiazione da parte del tessuto. Nella BT, invece, la legge della distanza al quadrato rappresenta il contributo maggiore alla dose, soprattutto in prossimità della sorgente. La dose diminuisce quindi molto rapidamente con la BT, il cosiddetto gradiente di dose è ripido, che da un lato porta a picchi di dose molto elevati nelle immediate vicinanze della sorgente o del tumore e dall’altro espone solo leggermente gli organi a rischio circostanti.
Procedura pratica di brachiterapia HDR
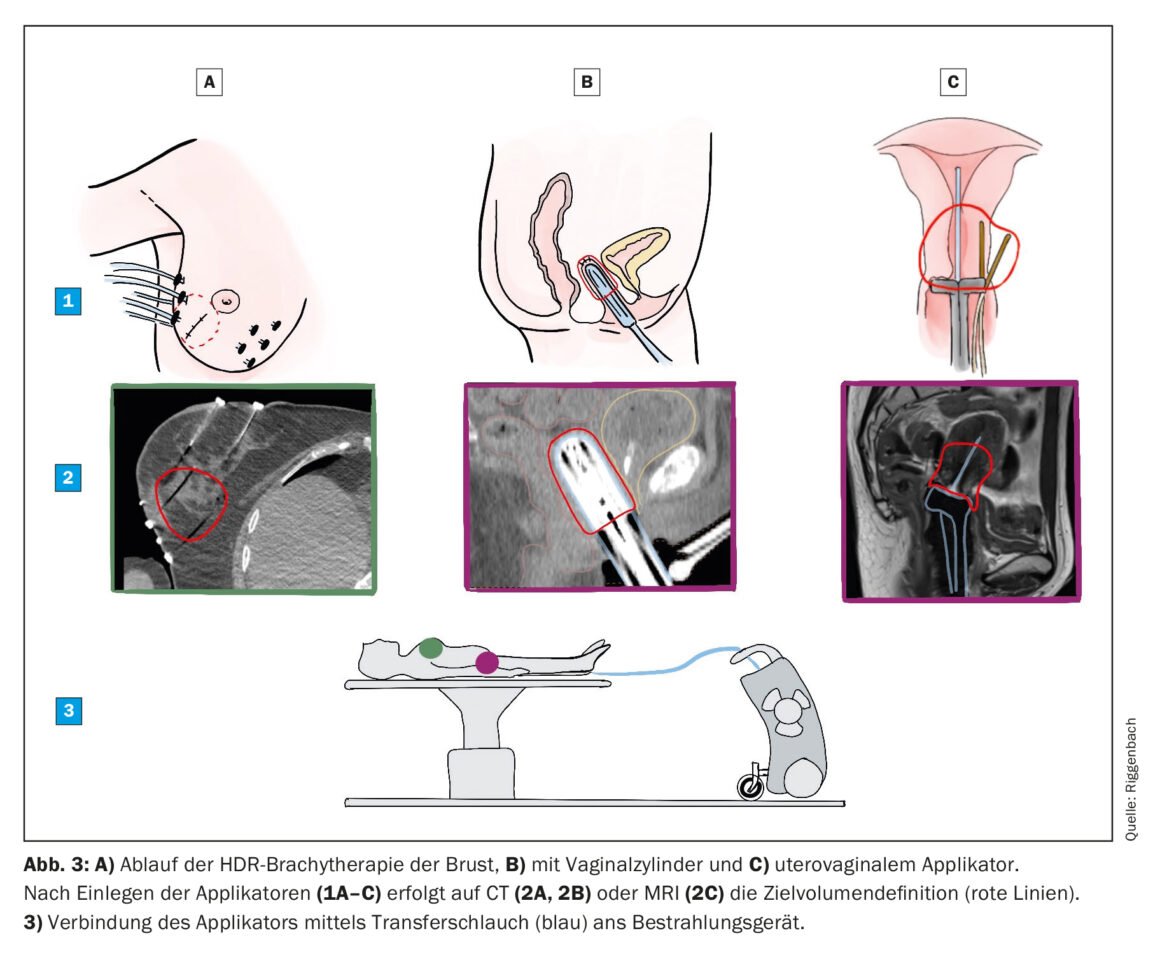
La maggior parte dei trattamenti BT oggi viene eseguita con il metodo della ricarica per motivi logistici e di radioprotezione. A questo scopo, un applicatore inattivo viene prima inserito senza radiazioni. Ogni applicatore ha una cavità attraverso la quale viene fatta passare la sorgente di radiazioni in una fase successiva. La sorgente Iridum-192 ha le dimensioni di un chicco di riso ed è collegata all’estremità di un filo sottile conservato in una cassaforte mobile. Dopo l’inserimento dell’applicatore, si esegue una TAC e/o una risonanza magnetica, sulla quale vengono marcati il volume bersaglio e gli organi a rischio. Il fisico medico è responsabile della stesura del piano di irradiazione. La posizione della sorgente (all’interno della lunghezza dell’applicatore) e il tempo di irradiazione nella rispettiva posizione possono essere selezionati liberamente e vengono ottimizzati dal software di pianificazione. Una volta raggiunti i target, il piano di irradiazione viene inviato alla console di irradiazione, il paziente viene accompagnato nella sala di trattamento e l’applicatore inserito viene collegato alla cassaforte (Fig. 3). Il trattamento viene avviato e controllato in remoto dalla sala adiacente. Sono necessari solo pochi minuti, dopodiché la sorgente di radiazioni viene ritratta automaticamente nella cassaforte e l’applicatore viene rimosso.
Sfide e prospettive
La complessità della brachiterapia non si basa sulla tecnica, ma sulla manualità dell’inserimento e sull’interazione del personale specializzato all’interno della radio-oncologia e interdisciplinare. È un’attività ad alta intensità di manodopera, ma rimane efficiente dal punto di vista dei costi grazie alla sua tecnologia semplice, che è uno dei motivi per cui è così importante nei Paesi poveri di risorse. Con oltre 100 anni di esperienza, è una delle opzioni terapeutiche più antiche dell’oncologia e quindi a volte viene considerata storica o superata. La brachiterapia di oggi, con applicatori moderni, inserimento guidato dalle immagini e ottimizzazione della dose basata su software, ha implementato il progresso medico e si inserisce perfettamente negli approcci della “medicina personalizzata”. Come tutte le modalità di radioterapia, è conservativa per gli organi, ma a causa del suo approccio minimamente invasivo, della moderna implementazione delle immagini e dell’ampio utilizzo, richiede un team dedicato e interdisciplinare di esperti.
Messaggi da portare a casa
- La brachiterapia è una forma di trattamento altamente precisa, in cui
il volume di irradiazione è limitato alla regione di rischio effettiva. - Il forte gradiente di dose porta a una dose elevata nella regione bersaglio, risparmiando il più possibile il tessuto circostante.
- Può essere applicato sulla superficie (BT a contatto), in una cavità del corpo (BT intracavitaria) o nel tessuto (BT interstiziale).
- L’uso più comune è la HDR-BT temporanea, in cui un’alta dose di
viene applicato in poche sessioni, utilizzando il metodo di ricarica. - L’ampio uso della brachiterapia la rende un’attività interdisciplinare.
Forma di trattamento.
Letteratura:
- Chargari C, Deutsch E, Blanchard P, et al: Brachiterapia: una panoramica per i medici. CA Cancer J Clin 2019; 69(5): 386-401.
- Verellen D, Ridder M De, Linthout N, et al: Innovazioni nella radioterapia guidata dalle immagini. Nat Rev Cancer 2007;7(12): 949-960.
- Guinot JL, Rembielak A, Perez-Calatayud J, et al: Raccomandazioni GEC-ESTRO ACROP nella brachiterapia cutanea. Radiother Oncol 2018; 126(3): 377-385.
- Roeder F, Krempien R: Radioterapia intraoperatoria (IORT) nel sarcoma dei tessuti molli. Radiat Oncol 2017.
- Tom MC, Joshi N, Vicini F, et al: Dichiarazione di consenso della Società Americana di Brachiterapia sulla radioterapia intraoperatoria. Brachiterapia 2019;18(3): 242-257.
- Harkenrider MM, Block AM, Alektiar KM, et al: American Brachytherapy Task Group Report: Adjuvant vaginal brachytherapy for early-stage endometrial cancer: A comprehensive review. Brachiterapia 2017; 16(1): 95-108.
- Schmid MP, Fokdal L, Westerveld H, et al: Raccomandazioni del gruppo di lavoro ginecologico (GYN) GEC-ESTRO – ACROP: Concetto di obiettivo per la brachiterapia adattiva guidata da immagini nel tumore vaginale primario. Radiother Oncol 2020;145: 36-44.
- Rovirosa Á, Tagliaferri L, Chicheł A, et al.: Perché una tecnica molto facile, utile e antica è sottoutilizzata? Una panoramica sulla brachiterapia esofagea – radioterapia interventistica. J Contemp Brachytherapy 2022;14(3): 299-309.
InFo ONCOLOGIA & EMATOLOGIA 2023; 11(2): 6-9