Carcinoma endometriale, sarcoma uterino, carcinoma cervicale – i tumori dell’utero sono diversi come le diverse cellule che si trovano nell’utero. Di conseguenza, anche la gestione differisce in modo significativo. Un’attenta diagnostica per classificare e classificare il rischio è fondamentale per garantire la migliore assistenza possibile per ogni individuo.
I tumori dell’utero colpiscono donne di età diverse e in fasi diverse della vita. L’origine dei tumori è varia, così come le diverse cellule presenti nell’utero. I processi maligni spesso si presentano con il sintomo comune del sanguinamento vaginale.
In questo articolo di revisione, vorremmo discutere i diversi tumori dell’utero e fornire una panoramica con una prospettiva sulle opzioni di trattamento.
Carcinoma endometriale
Il carcinoma endometriale è uno dei tumori ginecologici più comuni dopo il carcinoma mammario, con 4634 casi registrati nel registro nazionale dei tumori della Svizzera nel periodo 2013-2017. In un buon 75% dei casi, il carcinoma endometriale viene diagnosticato in postmenopausa, dopo che si sono verificati frequenti sanguinamenti postmenopausali. Il fattore di rischio per il carcinoma endometriale ormono-dipendente (tipo I) è l’eccesso di estrogeni. Ciò è dimostrato dall’aumento del rischio con la sola terapia estrogenica nella postmenopausa (tibolone, tamoxifene, a seconda della durata di utilizzo, anche terapia combinata con progestinico, terapie di stimolazione ovarica) [1]. Anche il menarca precoce e la menopausa tardiva possono favorire il cancro dell’endometrio, così come l’obesità, l’alterazione del metabolismo del glucosio e la presenza della sindrome dell’ovaio policistico (PCOS). Se c’è un’anamnesi familiare positiva di cancro dell’endometrio in parenti di primo grado, il rischio di sviluppare la malattia all’età di 70 anni aumenta al 3,5% rispetto alla popolazione normale del 3,1% [2]. Fortunatamente, il tumore dell’endometrio è spesso sintomatico nelle fasi iniziali in termini di sanguinamento postmenopausale, il che spiega in parte la buona prognosi con una probabilità di sopravvivenza a 5 anni dell’80%. Nelle pazienti in premenopausa con sanguinamento uterino anomalo, il rischio di iperplasia con atipia o carcinoma è inferiore all’1,5%. Dopo un tentativo infruttuoso di terapia conservativa, tuttavia, una biopsia con pipetta o un’isteroscopia e curettage per l’esame istologico dovrebbe essere generosamente eseguita anche in questo caso.
Il gold standard diagnostico resta l’isteroscopia con curettage, che deve essere eseguita nei casi di sanguinamento in postmenopausa con un endometrio ≥3 mm. Le condizioni locali dell’utero devono essere esaminate con un’ecografia transvaginale. Se i risultati non sono chiari, una risonanza magnetica del bacino può fare chiarezza. Un’ulteriore diagnostica per immagini mediante tomografia computerizzata è indicata negli stadi avanzati o nell’istologia aggressiva, per valutare le condizioni extrauterine.
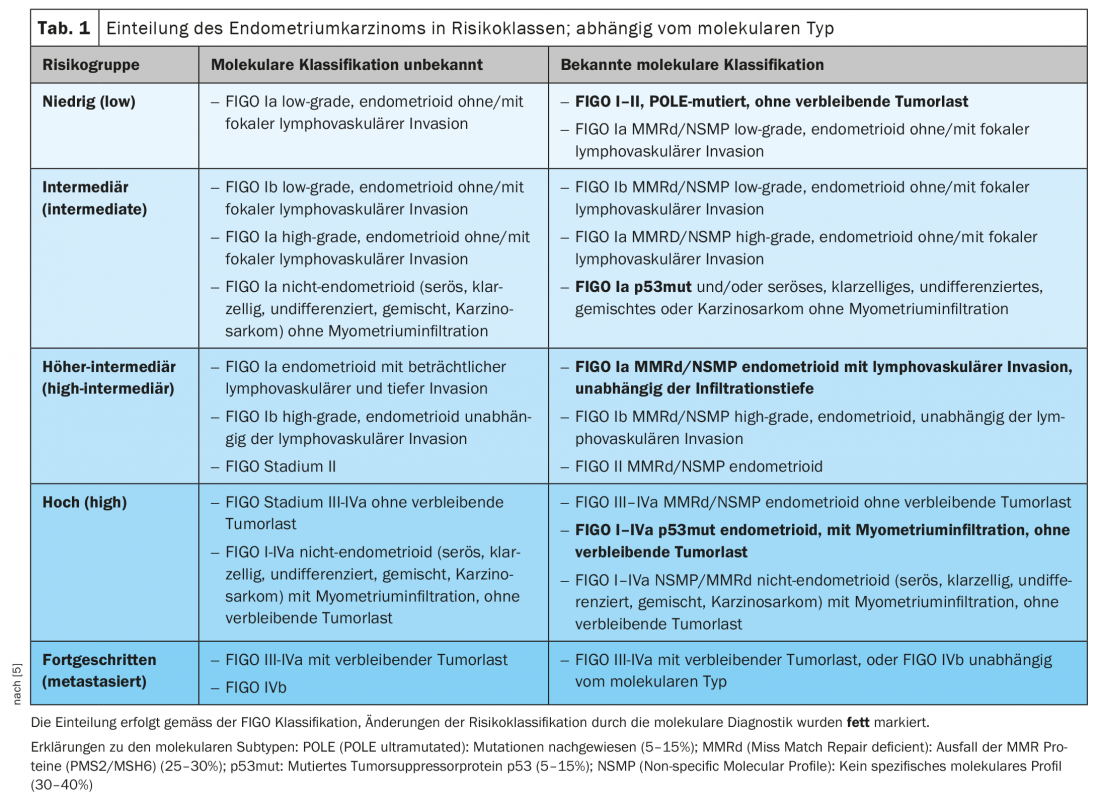
Il carcinoma endometriale è classicamente diviso in due tipi. Il tipo I, adenocarcinoma endometrioide, è sensibile agli ormoni, mentre il carcinoma di tipo II è ormono-dipendente. Il gruppo di carcinomi di tipo II è composto da carcinomi sierosi o a cellule chiare più aggressivi e da carcinosarcomi e colpisce una popolazione più anziana. Attraverso l’analisi molecolare del gruppo TCGA (The Cancer Genome Atlas-Project), è stato possibile dividere il carcinoma endometriale in quattro gruppi molecolari, che possono prevedere meglio la prognosi e fornire una terapia adeguata in futuro. Nell’edizione WHO Pathology 2020, i tumori dell’endometrio sono ora classificati come POLE, MMRd (mismatch repair deficient), p53mut e NSMP (profilo molecolare non specifico). La prognosi è molto favorevole per il mutante POLE, seguito dal tipo microsatellite instabile MMRd; i carcinomi p53mut hanno una prognosi significativamente peggiore e si comportano in modo simile al carcinoma ovarico sieroso [3,4].
La classificazione del rischio ESMO-ESGO-ESTRO ha integrato i marcatori molecolari nella sua ultima edizione 2021, per cui questi marcatori sono ora inclusi nella clinica (Tabella 1) [5]. Nei tumori avanzati, i marcatori molecolari, in particolare MMRd, consentono nuove opzioni di trattamento con gli inibitori del checkpoint.
Oggi, la terapia chirurgica deve essere eseguita mediante isterectomia laparoscopica con annessiectomia bilaterale. Nelle pazienti in premenopausa, l’annesso può essere lasciato in sede nelle fasi iniziali, dopo l’educazione al rischio e se non c’è una mutazione BRCA e non c’è la sindrome di Lynch. La stadiazione viene eseguita chirurgicamente. Questo può includere una sezione congelata per valutare lo spessore dell’infiltrazione. La decisione se eseguire una linfonodectomia pelvica e para-aortica e un’omentectomia dipende dal gruppo di rischio (rischio intermedio-alto e alto) e dallo stadio (pT1b, G3, tipo II, L1). La linfonodectomia deve sempre includere la linfonodectomia pelvica e para-aortica, in base al drenaggio linfatico dell’utero. Anche i linfonodi macroscopicamente cospicui dovrebbero essere rimossi nelle fasi iniziali dei carcinomi di tipo I.
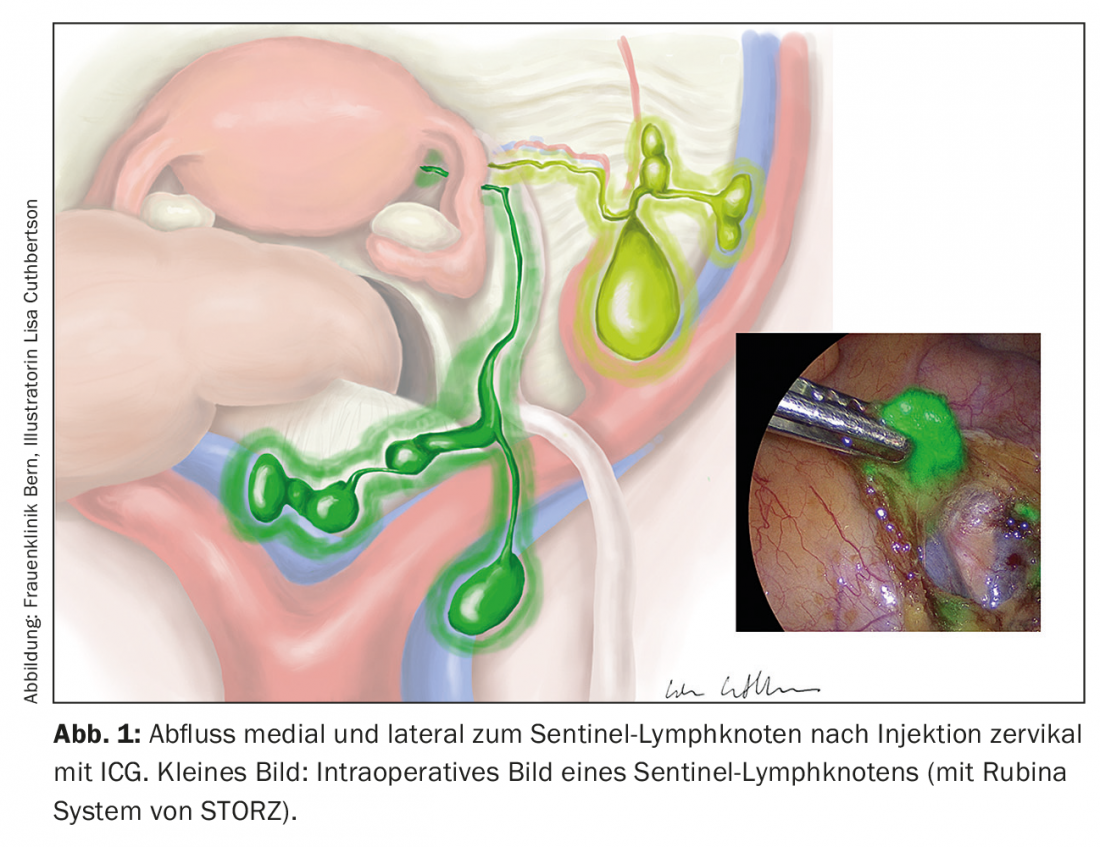
Il concetto di escissione del linfonodo sentinella è stato analizzato in molti studi. Il verde indocianina viene applicato a livello cervicale o peritumorale e può essere visualizzato intraoperatoriamente con una tecnica di imaging nel vicino infrarosso (Fig. 1). La tecnica non aumenta la morbilità e il tasso di rilevamento è superiore al 90%, con un tasso di falsi positivi del 5%. L’ecografia mediante esame immunoistochimico dei linfonodi sentinella negativi può avere un ulteriore vantaggio, visualizzando le micrometastasi [6–8]. Nelle situazioni ad alto rischio, tuttavia, l’escissione del linfonodo sentinella è ancora indicata solo nel contesto degli studi.
La terapia di conservazione della fertilità viene presa in considerazione solo nello stadio IA, dopo aver escluso l’infiltrazione miometriale. Dopo un’esplicita informazione, viene somministrata una terapia progestinica (minipillola o IUD progestinico) per sei mesi, seguita dal desiderio di avere un figlio. Una volta raggiunto questo obiettivo, si dovrebbe procedere alla stadiazione chirurgica.
Sarcomi uterini
Con un’incidenza di 1,5-3/100 000, i sarcomi si riscontrano molto meno frequentemente dei carcinomi endometriali, con una mortalità significativamente maggiore. Il tasso di sopravvivenza a 5 anni è inferiore al 50%. I sarcomi possono avere origine nel miometrio, nel tessuto connettivo uterino o nello stroma endometriale. L’OMS distingue tra leiomiosarcoma (60-70%), sarcoma stromale endometriale di basso o alto grado (10% ciascuno), sarcoma uterino indifferenziato (10%), adenosarcoma e la variante maligna del PEComa (tumore a cellule epitelioidi perivascolari ) (entrambi significativamente meno comuni). I fattori di rischio includono la discendenza africana, l’assunzione di tamoxifene e una mutazione germinale nel gene TP53, chiamata anche sindrome di Li-Fraumeni.
Clinicamente, i sarcomi si presentano spesso con un’emorragia vaginale, ma anche un utero in rapida crescita può essere un segno della presenza di un sarcoma. L’isteroscopia, così come ulteriori procedure di imaging come un esame di risonanza magnetica, possono dare indicazioni su un sarcoma, ma non possono escluderlo. I sarcomi vengono spesso riscontrati come reperto incidentale durante le miomectomie o le isterectomie, che comportano il rischio di distribuzione di cellule maligne e quindi peggiorano la prognosi. Informare il paziente prima di ogni operazione è uno standard al giorno d’oggi. Se si sospetta clinicamente, la tecnica chirurgica deve essere adattata di conseguenza.
La terapia del leiomiosarcoma prevede un’isterectomia totale. L’annessiectomia e la linfonodectomia pelvica e para-aortica sistematica non sono indicate principalmente nel caso di una bassa incidenza di metastasi in quest’area, a meno che non vi siano anomalie intraoperatorie [9]. Non ci sono ancora prove sufficienti per la terapia adiuvante dopo la resezione R0. La chemioterapia adiuvante con doxorubicina o una combinazione di gemcitabina e docetaxel sono opzioni individuali senza raccomandazioni chiare. La radioterapia adiuvante deve essere discussa in caso di resezione chirurgica incompleta. Nelle situazioni metastatiche primarie, si utilizza la doxorubicina. La somministrazione di inibitori dell’aromatasi può prolungare la sopravvivenza libera da progressione dopo la conferma dell’espressione del recettore ormonale.
Nel sarcoma stromale endometriale di basso grado, la prognosi è buona con un tasso di sopravvivenza a 5 anni dell’80-90%. Se lo stato dei recettori ormonali è positivo, può essere migliorato con l’annessiectomia bilaterale o la terapia endocrina adiuvante a partire dallo stadio III.
Il sarcoma stromale endometriale di alto grado e i sarcomi uterini indifferenziati hanno una prognosi inadeguata, con una sopravvivenza globale mediana di 1-3 anni. Esiste una chiara raccomandazione terapeutica per l’isterectomia totale con annessiectomia bilaterale. La radioterapia percutanea è consigliata per lo stadio I e II. Non sono disponibili dati sufficienti sulla chemioterapia o sulla terapia endocrina.
Carcinoma cervicale
In Svizzera, ci sono circa 250 nuovi casi di carcinoma cervicale ogni anno. Grazie allo screening e, in futuro, anche alla vaccinazione HPV, prevediamo un’ulteriore diminuzione di questi numeri. Purtroppo, il cancro al collo dell’utero rappresenta ancora circa l’1% di tutti i decessi per cancro. Lo stadio del tumore secondo FIGO al momento della diagnosi ha un’influenza importante sulla sopravvivenza globale a 5 anni. Questo è il 21% nello stadio IV e il 95% nello stadio I. I fattori di rischio includono la persistenza di un’infezione da HPV ad alto rischio con possibile displasia cervicale, nonché l’immunosoppressione, l’abuso di nicotina, la scarsa igiene sessuale, il cambio di partner sessuali e l’uso a lungo termine di contraccettivi orali. Clinicamente, questa neoplasia si manifesta spesso anche attraverso il tipico sanguinamento (post-coitale) o l’alterazione della fluorimetria vaginale.
Il carcinoma a cellule squamose HPV-dipendente rappresenta fino all’80% dei casi di carcinoma cervicale. Il restante 20% è composto in gran parte da carcinomi adenosquamosi e adenocarcinomi. Sottotipi istologici meno comuni sono i carcinomi misti, neuroendocrini, sierosi, papillari e a cellule chiare.
La diagnosi viene fatta dopo un Pap test anormale, con una conferma istologica sotto forma di biopsia della portio o di curettage endocervicale. Le condizioni locali possono essere valutate con l’ecografia transvaginale, l’ecografia renale per escludere l’idronefrosi e la risonanza magnetica o l’esame anestetico mediante cistoscopia e/o rettoscopia. La PET-CT viene utilizzata nel sospetto primario di metastasi a distanza o nelle situazioni di recidiva. La stadiazione clinica primaria nel carcinoma della cervice è stata integrata nel 2018 da una combinazione di imaging e coinvolgimento linfonodale nella classificazione FIGO aggiornata [10]. L’interessamento dei linfonodi paraaortici non può essere diagnosticato con una sensibilità sufficiente utilizzando la PET-CT, motivo per cui lo stato linfonodale deve essere determinato principalmente chirurgicamente nel corso della linfonodectomia sentinella, che ha una sensibilità del 91,4% con una specificità del 100%. In caso di tumore in stadio T1a1 senza invasione linfovascolare, rimozione completa mediante conizzazione e carcinoma microinvasivo, la linfonodectomia sentinella non è necessaria. In questi casi, può essere sufficiente una semplice conizzazione o isterectomia.
La chirurgia o la radiochemioterapia possono essere considerate come terapia primaria. Fino allo stadio tumorale FIGO IIA, si raccomanda la resezione chirurgica primaria mediante isterectomia radicale aperta. L’indicazione per l’ovariectomia dipende dal tipo istologico e dallo stato di menopausa.
Lo studio prospettico e randomizzato LACC, pubblicato nel 2018, ha confrontato l’esito dell’isterectomia radicale mininvasiva con quello della laparotomia. Le dimensioni del tumore ≥2 cm hanno mostrato un esito peggiore in termini di intervallo libero da recidiva, un tasso più elevato di recidiva locoregionale e anche una sopravvivenza globale significativamente inferiore rispetto all’isterectomia radicale aperta. Lo studio [11] non ha chiarito se le cellule tumorali vengano disperse dal manipolatore uterino utilizzato durante la laparoscopia o dall’inflazione di CO2.
La radiochemioterapia è lo standard di cura dallo stadio IIB in poi o se c’è evidenza di prolasso linfonodale dopo la linfonodectomia paraaortica. La radioterapia percutanea con somministrazione simultanea di chemioterapia contenente cisplatino come radiosensibilizzante viene eseguita prima della brachiterapia intravaginale. Gli studi sull’isterectomia secondaria dopo la chemioterapia neoadiuvante non hanno mostrato alcun vantaggio.
In casi selezionati, si raccomanda la radioterapia adiuvante con chemioterapia dopo il trattamento chirurgico primario. Questo vale per le resezioni R1, le infiltrazioni parametriche, le metastasi linfonodali e i fattori di rischio (L1, V1, G3, dimensioni del tumore >4 cm). L’indicazione alla brachiterapia vaginale deve essere discussa nei casi di infiltrazione vaginale, di tumori di grandi dimensioni e di situazioni estese di L1. La terapia palliativa prevede principalmente la chemioterapia con carboplatino e taxolo, in combinazione con bevacizumab. Anche gli inibitori del checkpoint possono essere utilizzati in questo caso.
Conclusione
In sintesi, i tumori dell’utero comprendono entità molto diverse e vengono trattati di conseguenza. Una diagnostica accurata per la classificazione è fondamentale. I marcatori molecolari sono sempre più importanti, sia per la classificazione del rischio che per la regolazione delle terapie adiuvanti.
Messaggi da portare a casa
- I tumori dell’utero comprendono entità diverse, la cui gestione varia in modo significativo. Un’attenta diagnostica per classificare e classificare il rischio è fondamentale per garantire la migliore assistenza possibile per ogni individuo.
- L’importanza clinica dei marcatori molecolari è in aumento; da quest’anno, questi fanno parte della classificazione di rischio ESMO-ESGO-ESTRO del carcinoma endometriale. I marcatori molecolari consentono non solo una valutazione più precisa della prognosi, ma anche l’uso mirato di opzioni terapeutiche innovative come gli inibitori del checkpoint, soprattutto per i tumori avanzati.
- Il carcinoma endometriale è uno dei tumori maligni ginecologici più comuni e viene diagnosticato nel 75% dei casi in postmenopausa. Di solito si manifesta con un sanguinamento vaginale ed è favorito da un eccesso di estrogeni, tra l’altro con la terapia con tamoxifene. In caso di emorragia postmenopausale e di un endometrio ≥3 mm, è necessario eseguire in ogni caso una pipetta o un’isteroscopia con curettage per la conferma istologica.
- I sarcomi uterini sono meno comuni dei carcinomi endometriali, ma hanno una prognosi peggiore. Anche l’uso del tamoxifene è uno dei fattori di rischio. Le miomectomie e le isterectomie comportano il rischio di distribuzione di cellule maligne, per cui la tecnica chirurgica deve essere adattata di conseguenza in caso di sospetto clinico.
- La prognosi del carcinoma cervicale varia molto a seconda dello stadio del tumore.
- Negli stadi iniziali fino a FIGO IIA, l’isterectomia radicale aperta con o senza ovariectomia è il trattamento di prima scelta. A partire dallo stadio IIB o se c’è evidenza di prolasso linfonodale, si ricorre principalmente alla radiochemioterapia. L’isterectomia secondaria non comporta alcun vantaggio.
Letteratura:
- Allen NE, et al: Terapia ormonale in menopausa e rischio di carcinoma endometriale tra le donne in postmenopausa nello European Prospective Investigation Into Cancer and Nutrition. Am J Epidemiol. 2010; 172(12): 1394-1403.
- Win AK, Reece JC, Ryan S: Storia familiare e rischio di cancro endometriale: una revisione sistematica e una meta-analisi. Ostetricia e Ginecologia. 2015; 125(1): 89-98.
- Kandoth C, et al.: Paesaggio mutazionale e significato in 12 tipi di cancro principali. Natura, 2013; 502(7471): 333-339.
- Morice P, et al: Cancro dell’endometrio. Lancet. 2016 ; 387(10023): 1094-1108.
- Concin N, et al: Linee guida ESGO / ESTRO / ESP per la gestione delle pazienti con carcinoma endometriale. Virchows Arch. 2021; 478(2): 153-190.
- Rossi EC, et al: Confronto tra la biopsia del linfonodo sentinella e la linfoadenectomia per la stadiazione del tumore dell’endometrio (studio FIRES): uno studio multicentrico, prospettico, di coorte. Lancet Oncol. 2017; 18(3): 384-92.
- Papadia A, et al: Mappatura laparoscopica del linfonodo sentinella al verde indocianina nel cancro dell’endometrio. Ann Surg Oncol. 2016; 23(7): 2206-2211.
- Imboden S, et al: Sicurezza oncologica e morbilità perioperatoria nel cancro endometriale a basso rischio con dissezione del linfonodo sentinella. Eur J Surg Oncol. 2019; 45(9): 1638-1643.
- Kapp DS, Shin JY, Chan JK: Fattori prognostici e sopravvivenza in 1396 pazienti con leiomiosarcomi uterini: enfasi sull’impatto della linfoadenectomia e dell’ooforectomia. Cancro. 2008; 112(4): 820-830.
- Bhatla N, et al: Stadiazione FIGO rivista per il carcinoma della cervice uterina. Int J Gynecol Obstet. 2019; 145(1): 129-135.
- Ramirez PT, et al: Isterectomia minimamente invasiva rispetto all’isterectomia radicale addominale per il cancro cervicale. N Engl J Med 2018; 379(20): 1895-1904.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(3): 10-13