I pazienti affetti da CML hanno un’aspettativa di vita normale se trattati con gli inibitori della chinasi Abl-specifici (TKI) in fase cronica. Imatinib, dasatinib e nilotinib sono approvati per il trattamento di prima linea della CML. In caso di resistenza o intolleranza, bosutinib e ponatinib sono disponibili come alternative TKI. L’obiettivo della terapia è quello di ottenere una profonda remissione molecolare (MR). Questo è un prerequisito per i concetti di interruzione del TKI e per il raggiungimento della remissione libera da terapia (TFR). I meccanismi biologici alla base della TFR non sono noti con precisione, ma probabilmente sono mediati immunologicamente. È possibile che la terapia temporanea con interferone alfa (IFN) o con inibitori del checkpoint immunitario possa aumentare il tasso di TFR. Queste domande sono attualmente oggetto di studi clinici.
Ogni paziente con CML dovrebbe essere trattato con un TKI specifico per Abl approvato nella terapia di prima linea. Una risposta tempestiva alla terapia molecolare è rilevante per la prognosi. Per poterlo valutare, è essenziale registrare regolarmente il carico di mRNA BCR-ABL (ogni tre mesi fino al raggiungimento di una MMR stabile, poi almeno ogni sei mesi) durante la terapia con TKI [1]. Il numero di copie di BCR-ABL viene misurato in laboratori standardizzati e standardizzato nell’unità internazionale “IS” [2]. Il carico di BCR-ABL dopo l’IS fa una dichiarazione sulla profondità della remissione ottenuta. La diminuzione del numero di copie di BCR-ABL nel sangue periferico è espressa in passi logaritmici rispetto al basale al momento della diagnosi. Semplificando, un MR3 (MMR) corrisponde a una diminuzione del carico BCR-ABL di tre livelli log, un MR4 a una diminuzione di quattro livelli log, ecc.
La misurazione del carico di BCR-ABL in funzione del tempo della terapia consente di valutare la risposta e, se necessario, di cambiare la terapia in caso di resistenza alla terapia [1]. In caso di resistenza, comorbidità o intolleranza, gli inibitori di Abl, come bosutinib o ponatinib, sono disponibili come alternative di trattamento in aggiunta alle terapie di prima linea.
Il trapianto allogenico di cellule staminali (allo-SCT) è un’opzione di trattamento che di solito è indicata solo nei pazienti con CML avanzata o refrattaria a più TKI.
Interferone alfa (IFN)
La monoterapia con IFN non è molto efficace nei pazienti con CML.
Al contrario, la terapia di combinazione di imatinib o di un TKI di seconda generazione (nilotinib, dasatinib) con interferone alfa pegilato (IFN) è altamente efficace. La risonanza magnetica profonda si ottiene più rapidamente e in un numero significativamente maggiore di pazienti con la combinazione rispetto ai soli TKI [3–5]. In studi non controllati, anche la terapia di mantenimento con IFN dopo una precedente terapia di combinazione ha indotto un alto tasso di TFR [6,7].
Obiettivi della terapia nella fase cronica
L’obiettivo primario della terapia con TKI nella CML è quello di ottenere una remissione molecolare il più rapidamente possibile, che dovrebbe essere almeno nell’intervallo di una MMR (MR3). Questo è importante perché la remissione molecolare profonda protegge dalla progressione della malattia e normalizza la sopravvivenza globale con la CML [8–10].
L’obiettivo terapeutico secondario è il rapido raggiungimento di un MR profondo (ad esempio, nel senso di un MR4, MR4.5 o MR5), perché questo consente l’inclusione nei concetti di interruzione dei TKI.
Remissione senza trattamento (“TFR”)
In origine, la terapia con TKI per la CML era stata progettata per essere continua, poiché è diventato presto chiaro che gli inibitori di BCR-ABL (imatinib, dasatinib, nilotinib) non potevano sradicare le cellule staminali della CML [11,12].
Sorprendentemente, successive casistiche cliniche e studi (STIM, STIM-2, EURO-SKI) hanno dimostrato che circa il 50% dei pazienti che sono stati trattati con imatinib per molti anni e che hanno quindi raggiunto un MR4,5 stabile possono sospendere imatinib senza subire una ricaduta molecolare (rimbalzo del carico di BCR-ABL o perdita di un MMR) [13–17].
Finora, i meccanismi alla base del TFR sono poco conosciuti. Pertanto, attualmente non sono state stabilite strategie terapeutiche comprovate per aumentare il tasso di TFR. Tuttavia, si presume un controllo immunologico delle cellule CML residue da parte delle cellule T e delle cellule NK. I fattori associati a un tasso di TFR significativamente più alto sono la durata della pre-terapia con imatinib (più di 5,8 anni) e la durata di un MR4 (più di 3,1 anni). Il numero di cellule dendritiche plasmacitoidi mature (CD86+pDC) e di cellule NK mature è un potenziale marcatore biologico associato a un tasso più elevato di TFR [18,19].
Concetti per migliorare il tasso di TFR
Raggiungere la remissione senza trattamento nel maggior numero possibile di pazienti è l’obiettivo ambizioso degli attuali concetti di terapia di prima linea della CML (CML-V, Tiger) e degli studi di interruzione (NAUT, ENDURE, INCEPTION).
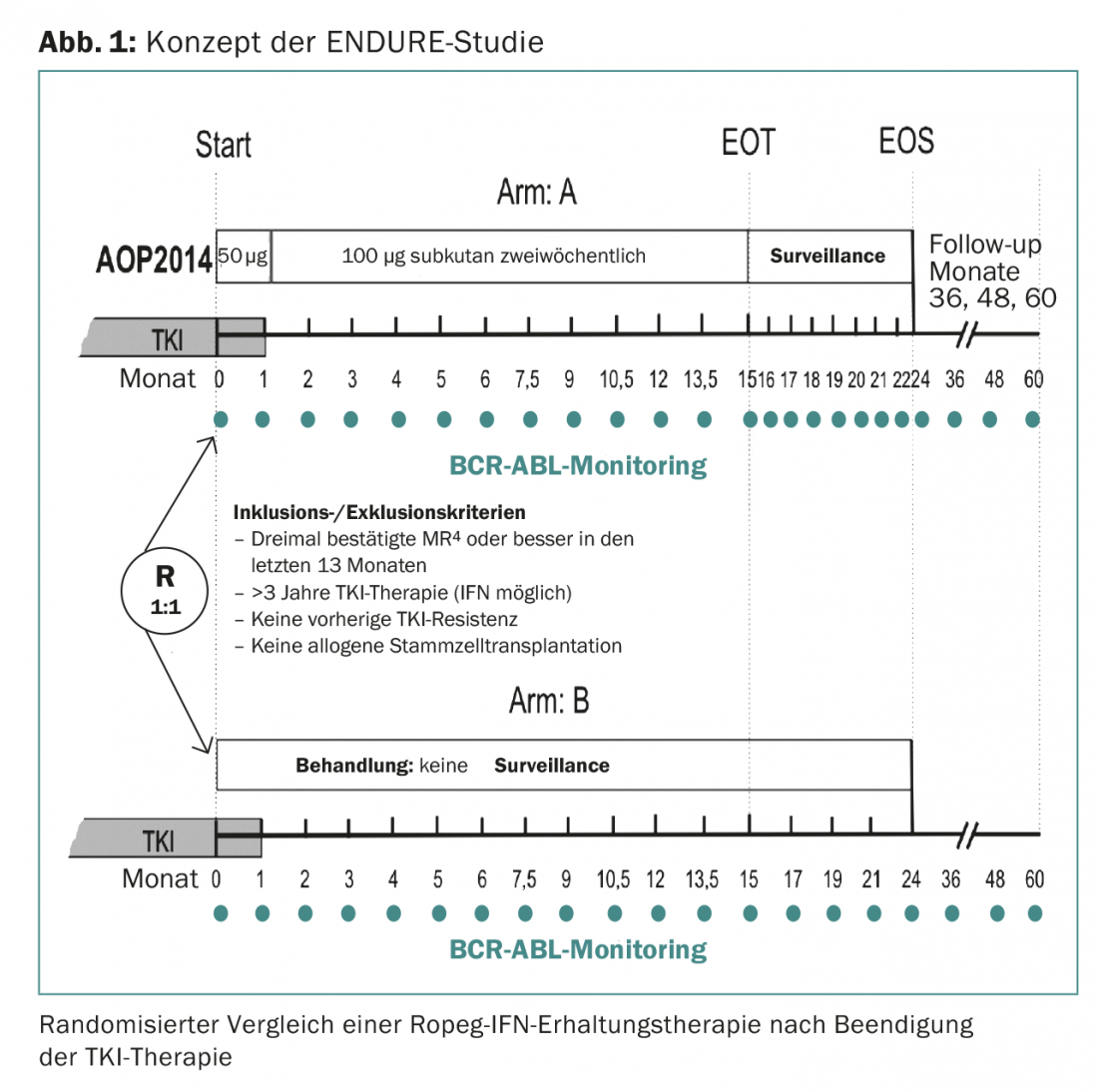
Lo studio ENDURE, che inizierà a breve in 15 centri in Germania, sta verificando se una terapia di mantenimento con IFN di 15 mesi possa ridurre il tasso di recidive molecolari in 214 pazienti sottoposti a MR profonda (almeno MR4) (Fig. 1). L’IFN utilizzato è Ropeg-IFN (AOP2014). Ropeg-IFN è un nuovo IFN con un’emivita più lunga e quindi meglio tollerato rispetto agli IFN pegilati disponibili in precedenza. Il preparato deve essere iniettato solo ogni 14 giorni.
Un altro concetto terapeutico innovativo sarà presto testato nello studio INCEPTION. Qui, i pazienti dopo la sospensione del TKI – stratificati in base al fenotipo delle cellule T in esaurimento e all’immunofenotipo pDC – sono trattati in modo casuale con gli inibitori del checkpoint nivolumab e ipilimumab.
Prospettiva
Con l’introduzione dei TKI come terapia standard per la CML, la sopravvivenza con la CML si è normalizzata. L’obiettivo della futura terapia della CML è quello di ottenere una risonanza magnetica profonda e una libertà dal trattamento sicura e a lungo termine nel maggior numero possibile di pazienti.
Letteratura:
- Baccarani M, et al: Raccomandazioni di European LeukemiaNet per la gestione della leucemia mieloide cronica: 2013. Blood 2013; 122: 872-884.
- Cross NCP, et al: Raccomandazioni di laboratorio per il punteggio delle risposte molecolari profonde dopo il trattamento della leucemia mieloide cronica. Leucemia 2015; 29: 999-1003.
- Simonsson B, et al: La combinazione di IFN-α2b pegilato con imatinib aumenta i tassi di risposta molecolare nei pazienti con leucemia mieloide cronica a rischio basso o intermedio. Sangue 2011; 118: 3228-3235.
- Preudhomme C, et al: Imatinib più peginterferone alfa-2a nella leucemia mieloide cronica. N Engl J Med 2010; 363: 2511-2521.
- Nicolini FE, et al: Nilotinib e peginterferone alfa-2a per la leucemia mieloide cronica di nuova diagnosi (NiloPeg): uno studio di fase 2 multicentrico, non randomizzato, in aperto. Lancet Haematology 2015; 2: e37-e46.
- Burchert A, et al.: Risposta molecolare sostenuta con interferone alfa di mantenimento dopo la terapia di induzione con imatinib più interferone alfa nei pazienti con leucemia mieloide cronica. J Clin Oncol 2010; 28: 1429-1435.
- Burchert A, et al: La terapia di mantenimento con interferone alfa 2 (IFN) può consentire alti tassi di interruzione del trattamento nella leucemia mieloide cronica (CML). Leucemia 2015; 29: 1331-1335.
- Hehlmann R, et al: La risposta molecolare profonda viene raggiunta dalla maggior parte dei pazienti trattati con Imatinib, predice la sopravvivenza e viene raggiunta più rapidamente con l’Imatinib ottimizzato ad alto dosaggio: risultati dello studio randomizzato CML-Study IV. J Clin Oncol 2014 Feb 10; 32(5): 415-423.
- Hehlmann R, et al: Tollerabilità adattata di imatinib 800 mg/d rispetto a 400 mg/d rispetto a 400 mg/d più interferone-α nella leucemia mieloide cronica di nuova diagnosi. J Clin Oncol 2011; 29: 1634-1642.
- Bower H, et al: L’aspettativa di vita dei pazienti con leucemia mieloide cronica si avvicina all’aspettativa di vita della popolazione generale. J Clin Oncol 2016; 34: 2851-2857.
- Graham SM, et al: Le cellule staminali primitive, quiescenti, Philadelphia-positive di pazienti con leucemia mieloide cronica sono insensibili allo STI571 in vitro. Sangue 2002; 99: 319-325.
- Jørgensen HG, et al: Il nilotinib esercita effetti antiproliferativi equivalenti a quelli dell’imatinib e non induce apoptosi nelle cellule CD34+ CML. Sangue 2007; 109: 4016-4019.
- Mahon FX, et al: Interruzione di imatinib nei pazienti con leucemia mieloide cronica che hanno mantenuto una remissione molecolare completa per almeno 2 anni: lo studio prospettico, multicentrico Stop Imatinib (STIM). Lancet Oncol 2010; 11: 1029-1035.
- Rousselot P, et al: Interruzione di Imatinib mesilato nei pazienti con leucemia mieloide cronica in remissione molecolare completa da più di 2 anni. Sangue 2007; 109: 58-60.
- Rousselot P, et al: La perdita della risposta molecolare principale come fattore scatenante per la ripresa della terapia con inibitori della tirosin-chinasi nei pazienti con leucemia mieloide cronica in fase cronica che hanno interrotto l’imatinib dopo una malattia durevole non rilevabile. J Clin Oncol 2013; 32: 424-430.
- Ross DM, et al: Sicurezza ed efficacia della cessazione di imatinib per i pazienti con CML con malattia minima residua stabile non rilevabile: risultati dello studio TWISTER. Sangue 2013; 122: 515-522.
- Mahon FX, et al: Analisi intermedia di uno studio pan-europeo sugli inibitori della tirosin-chinasi nella leucemia mieloide cronica: lo studio EURO-SKI. Sangue 2014; 124: 151.
- Ilander M, et al: L’aumento della proporzione di cellule NK mature è associato al successo dell’interruzione di imatinib nella leucemia mieloide cronica. Leucemia 2016. DOI: 10.1038/leu.2016.360 [Epub ahead of print].
- Schütz C, et al.: L’espressione del ligando CTLA-4 CD86 sulle cellule dendritiche plasmacitoidi (pDC) predice il rischio di recidiva della malattia dopo l’interruzione del trattamento nella CML. Leucemia 2017. DOI: 10.1038/leu.2017.9 [Epub ahead of print].
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(1): 17-19