La chirurgia stereotassica nel trattamento della sindrome di Parkinson idiopatica è un’opzione terapeutica promettente. Stato della ricerca, uso e principi di base dei metodi di stimolazione cerebrale profonda (DBS) e ultrasuoni focalizzati guidati da MR (MRgFUS).
L’anno scorso abbiamo celebrato il 200° anniversario della prima descrizione della malattia di Parkinson da parte di James Parkinson nel 1817. È impressionante quanto la sindrome di Parkinson possa essere diagnosticata ancora oggi sulla base dei sei casi da lui descritti con i rispettivi sintomi motori e non motori. Tuttavia, sebbene negli ultimi decenni siano stati fatti grandi progressi nella ricerca della fisiopatologia della sindrome di Parkinson idiopatica, la causa della malattia è ancora sconosciuta e la malattia è di conseguenza incurabile.
Categorizzazione e clinica
Tra i disturbi del movimento, distinguiamo disturbi del movimento ipercinetici (tremore, distonia, mioclono, corea e tic) e ipocinetici; il principale rappresentante di quest’ultima categoria è la sindrome di Parkinson. La sindrome di Parkinson motorio richiede la presenza di rigore, tremore (tipicamente un tremore a riposo che aumenta con l’attività cognitiva e scompare quando si inizia il movimento) e rallentamento generale nel senso di bradicinesia. Negli ultimi decenni, tuttavia, siamo diventati consapevoli che sia i pazienti che i familiari soffrono anche di sintomi non motori. Questi includono disturbi dell’olfatto, disturbi del comportamento nel sonno REM, disturbi autonomici (disfunzioni sessuali, disturbi della vescica, fluttuazioni della pressione sanguigna, disturbi gastrointestinali come costipazione e ritardo nello svuotamento gastrico) e disturbi psichiatrici (depressione, allucinazioni, stanchezza, ecc.) [1].
L’1% di tutte le persone di età superiore ai 60 anni soffre di sindrome di Parkinson idiopatica; in Svizzera, più di 15.000 persone sono affette da questa malattia [2]. Tuttavia, non sono solo le persone anziane a sviluppare la malattia, anche se l’età avanzata rimane il fattore di rischio maggiore per la sindrome di Parkinson idiopatica. Nelle nostre consultazioni per i disturbi del movimento, ci rendiamo conto che circa il 10% dei pazienti si ammala prima dei quarant’anni.
Diagnosi
Per ragioni che non sono ancora state spiegate, si verifica una perdita di neuroni dopaminergici in particolare, che può anche essere oggettivata dalla medicina nucleare utilizzando DaTSCAN-SPECT nel senso di un deficit dopaminergico presinaptico. Di norma, tuttavia, la diagnosi deve essere fatta esclusivamente sulla base della neurologia clinica e dell’anamnesi, e dopo aver escluso altre cause. Al momento della manifestazione della sindrome di Parkinson motorio, più del 50% delle cellule dopaminergiche sono già morte.
Importanti diagnosi differenziali della sindrome di Parkinson idiopatica sono le sindromi di Parkinson atipiche, come l’atrofia multisistemica (in questo caso c’è un’ulteriore evidenza di coinvolgimento di altri sistemi neurologici, ad esempio sotto forma di sindrome del tratto piramidale, sindrome cerebellare e disturbi autonomici precoci) e la paralisi progressiva dello sguardo sopranucleare (PSP) con i suoi vari sottotipi. Anche la degenerazione corticobasale deve essere considerata come diagnosi differenziale. Se la sindrome di Parkinson idiopatica e l’atrofia multisistemica sono alfa-sinucleinopatie, la PSP o la degenerazione corticobasale sono neuropatologicamente basate sulla tauopatia. La diagnosi differenziale importante è anche la parkinsonoide indotta da farmaci, causata dalla terapia neurolettica o dall’idrocefalo a pressione normale. Le sindromi di Parkinson come conseguenza dell’avvelenamento da manganese, come descritto in precedenza in tutti i casi di politossicomania, non si sono ancora verificate in Svizzera. Nei pazienti più giovani, la malattia di Wilson deve essere esclusa in quanto condizione trattabile.
Terapia farmacologica
Il gold standard della terapia continua ad essere la terapia farmacologica, soprattutto attraverso la somministrazione di L-dopa nelle sue varianti farmacologiche e sempre in combinazione con un inibitore della decarbossilasi per prevenire la degradazione precoce in periferia. Anche gli agonisti della dopamina, come il pramipexolo, la rotigotina o il ropinirolo, sono utilizzati con successo, ma non sono efficaci come la stessa L-dopa. Vengono utilizzati anche gli inibitori della COMT (entacapone, tolcapone) e gli inibitori della MAO-B (rasagilina o safinamide). Raramente vengono utilizzati gli anticolinergici, che tendono a provocare il delirio al piano della malattia neurodegenerativa. In situazioni di crisi, può essere somministrata l’amantadina per via endovenosa. Come regola generale, i pazienti prima dei settant’anni vengono avviati principalmente alla terapia con agonisti della dopamina, mentre i pazienti di età superiore ai settant’anni vengono avviati principalmente alla L-dopa. In linea di principio, tuttavia, la qualità di vita del paziente dovrebbe essere in primo piano. Se non è possibile ottenere un miglioramento clinico sufficiente con la somministrazione di un agonista della dopamina, passiamo generosamente alla terapia più efficace sotto forma di L-dopa. Gli effetti collaterali più importanti sono inizialmente la nausea, i disturbi circolatori, l’edema alle gambe (soprattutto a causa degli agonisti della dopamina), la stanchezza e gli effetti collaterali psichiatrici come le allucinazioni. Il pericolo dei disturbi del controllo degli impulsi deve essere sottolineato. A volte possono verificarsi dipendenza dal gioco d’azzardo, ipersessualità, aumento dello shopping e attività ripetitive compulsive. Questo grave effetto collaterale può distruggere le famiglie ed è quindi dovere di ogni medico che prescrive questi farmaci informarsi anche su questa forma di effetto collaterale. All’inizio, i pazienti con sindrome di Parkinson idiopatica rispondono molto bene alla terapia, tanto che si può parlare di una fase di “luna di miele”, che però può trasformarsi in un “paradiso perduto” nel corso del tempo. L’effetto buono iniziale cambia. Si verificano fluttuazioni dell’effetto nel corso della giornata, un “on” ritardato o assente, discinesie indotte dalla L-dopa, distonia come sindrome da carenza di L-dopa (tipicamente al mattino) o anche effetti collaterali psichiatrici. Al più tardi in questa situazione, si deve considerare la possibilità di intervenire con terapie. Da un lato, c’è la possibilità di una pompa di apomorfina. Qui, l’apomorfina viene applicata in modo continuo per via sottocutanea attraverso un sistema di pompe. L’apomorfina è l’agonista della dopamina più potente, ma può essere somministrata solo per via parenterale. Un’altra alternativa è l’infusione continua intra-giunale di L-dopa. Grazie alla stimolazione dopaminergica continua, si osserva una diminuzione delle fluttuazioni degli effetti e un miglioramento delle discinesie indotte dalla L-dopa con entrambe le terapie [2].
Stimolazione cerebrale profonda (DBS)
Altre possibili terapie invasive a nostra disposizione includono la chirurgia stereotassica, come la stimolazione cerebrale profonda (DBS) e, più recentemente, gli ultrasuoni focalizzati guidati dalla risonanza magnetica (MFgFUS). Negli anni ’80, neurologi e neurochirurghi francesi, ma anche svizzeri, hanno cercato di stabilire questo nuovo metodo. È giusto dire che si tratta del più grande passo terapeutico nel trattamento della malattia di Parkinson dall’introduzione della L-dopa negli anni Sessanta.
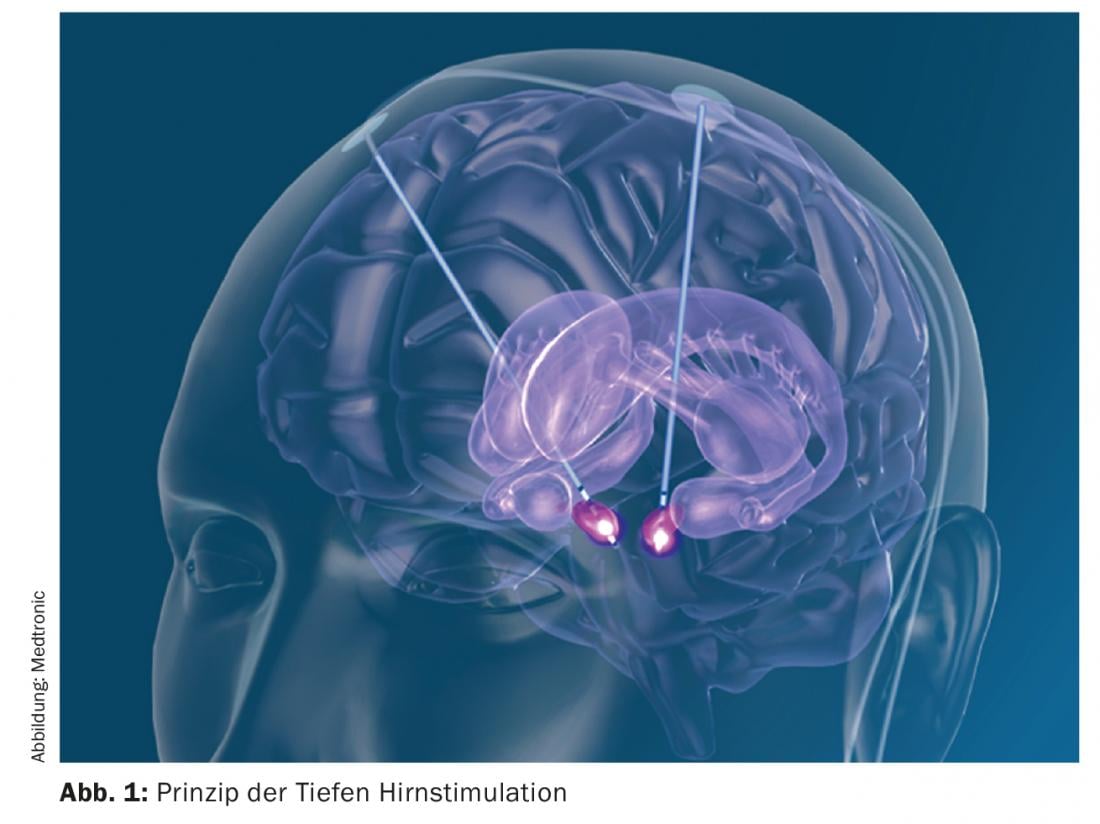
La stimolazione cerebrale profonda è un metodo non lezionale in cui gli elettrodi vengono impiantati in un punto specifico come parte di un’operazione stereotassica. Successivamente, i cavi vengono posati sotto la pelle e un neurostimolatore viene impiantato a livello sottoclavicolare o addominale. I parametri che consentono di effettuare la neurostimolazione possono essere impostati esternamente (Fig. 1) . Va sottolineato che la neurostimolazione non distrugge alcun tessuto, ma lo inattiva solo funzionalmente. I bersagli tipici nel trattamento della malattia di Parkinson sono il nucleo subtalamico (STN), il globus pallidus internus (Gpi) o alcune aree nucleari del talamo. Sia il STN che il Gpi provocano un miglioramento di tutti i sintomi cardinali del Parkinson (rigore, bradicinesia e tremore). Nel caso della neurostimolazione del STN, è possibile ridurre la terapia dopaminergica di circa la metà e quindi migliorare le discinesie indotte dalla L-dopa. La neurostimolazione nel nucleo ventralis intermedius Thalami (Vim) porta a una riduzione del tremore senza influenzare gli altri sintomi cardinali. Durante la chirurgia stereotassica, il paziente, che di solito è sveglio, viene fissato in un sistema di telaio stereotassico per consentire l’impianto degli elettrodi con precisione millimetrica. Con un’attenta preparazione e selezione del paziente, si tratta di una procedura chirurgica con effetti collaterali relativamente ridotti [3]. I possibili effetti collaterali legati all’intervento sono emorragie intracraniche, infezioni ed erosioni cutanee, l’innesco di crisi epilettiche, lo sviluppo di una fistola di liquido cerebrospinale o, nel peggiore dei casi, un danno diretto al tessuto cerebrale. Tuttavia, poiché l’operazione può essere pianificata in modo specifico con un software, questi effetti collaterali sono inferiori al 3%, a seconda dello studio. Inoltre, ci sono possibili disfunzioni del sistema neurostimolatore, come la migrazione degli elettrodi, la rottura o il malfunzionamento, ma anche questo è estremamente raro grazie ai sistemi molto affidabili. Nella profondità del cervello, importanti sistemi di neuroni corrono molto vicini l’uno all’altro, anche nei punti di destinazione della stimolazione cerebrale profonda. Di conseguenza, possono verificarsi anche effetti collaterali indotti dalla stimolazione. L’arte del neurologo curante consiste nel trovare l’impostazione giusta nella moltitudine di impostazioni possibili, in modo che si verifichi l’effetto desiderato e si evitino gli effetti collaterali legati alla stimolazione, come i disturbi del linguaggio, i crampi della mano controlaterale, le insensazioni, eccetera. Come la terapia farmacologica, anche la neurostimolazione può causare effetti collaterali psichiatrici. Anche questi sono molto rari e reversibili. Come per qualsiasi intervento chirurgico al cervello, soprattutto nelle persone affette da una malattia neurodegenerativa, sono temporaneamente possibili sindromi deliranti post-operatorie. Tuttavia, la stimolazione diretta può anche portare a un certo aumento della pulsione e del comportamento ipomaniacale, nonché all’ipersessualità, attraverso la co-irritazione delle fibre limbiche. Anche per riconoscere questi effetti collaterali, è importante coinvolgere i familiari nel processo terapeutico fin dall’inizio.
Recentemente sono diventati disponibili anche sistemi di elettrodi direzionali. Questi permettono di stimolare in direzioni specifiche e quindi di evitare o correggere gli effetti collaterali indotti dalla stimolazione.
La selezione accurata dei pazienti è un prerequisito.
Il metodo si basa su un’attenta selezione dei pazienti, per la quale le persone coinvolte devono dedicare il tempo necessario. I pazienti con sindrome di Parkinson idiopatica sono particolarmente adatti. Le sindromi di Parkinson atipiche precedentemente menzionate come diagnosi differenziali non rispondono in modo comparabile alla DBS. Solo i pazienti che beneficiano del trattamento con L-dopa sperimenteranno anche un miglioramento con la stimolazione cerebrale profonda. In questo modo è possibile prevedere l’effetto terapeutico. Solo il sintomo cardinale tremore non migliora necessariamente con il trattamento con L-dopa, ma è un sintomo target eccellente per la DBS. Oggi possiamo parlare della DBS come di una terapia consolidata per la sindrome di Parkinson idiopatica, che porta a un miglioramento dell’attività quotidiana attraverso la regolazione delle funzioni motorie, a una riduzione delle discinesie indotte dalla L-dopa attraverso la riduzione della terapia dopaminergica quotidiana e quindi a un miglioramento complessivo della qualità di vita. Sono disponibili studi controllati che mostrano un vantaggio della DBS rispetto a una popolazione di pazienti comparabile che riceve “solo” un trattamento farmacologico [3]. Di conseguenza, le possibilità della DBS dovrebbero essere prese in considerazione nelle prime fasi del decorso della malattia, poiché questa terapia è già indicata quando è presente l’indicazione corrispondente (fluttuazioni dell’effetto, discinesie) [4].
Ultrasuoni focalizzati guidati da MR (MRgFUS)
Oltre alla DBS come procedura di terapia stereotassica non lesionale, esistono anche procedure stereotassiche lesionali. Tuttavia, a causa della loro irreversibilità, negli ultimi decenni sono diventati meno importanti della DBS. Sono disponibili l’ablazione con radiofrequenza, la radiochirurgia con gamma knife e, più recentemente, gli ultrasuoni focalizzati guidati da MR (MRgFUS) [5].
Grazie ad un’elaborazione tecnica dell’energia sonora, la tecnica ad ultrasuoni, altrimenti utilizzata a livello diagnostico, può essere impiegata per lesioni di precisione millimetrica senza dover aprire la calotta cranica. Il sistema contiene oltre 1000 sorgenti di ultrasuoni e può essere integrato in una risonanza magnetica 3T (Fig. 2). Solo il sistema Exablate Neuro dell’azienda israeliana InSightec è approvato per uso clinico. Prima della procedura, la testa del paziente viene completamente rasata per garantire una trasmissione adeguata dell’energia degli ultrasuoni. Nel centro di risonanza magnetica, il telaio stereotassico viene posizionato in anestesia locale e il paziente viene fissato sul lettino di trattamento utilizzando il telaio stereotassico, allo stesso modo della DBS. Il sistema di trattamento neurologico Exablate è montato su questo, che è integrato in un sistema MRI 3T. L’intera procedura viene eseguita sul paziente sveglio ed è accompagnata da un team anestesiologico. Secondo la nostra esperienza, la terapia del dolore nei pazienti svegli durante le operazioni di DBS viene effettuata, se possibile, solo con remifentanil, per non influenzare i sintomi target.

Lo spazio tra il trasduttore emisferico e il cuoio capelluto del paziente è riempito con acqua degassata a 16°C, che viene fatta circolare per trasmettere il suono e raffreddare localmente il cuoio capelluto; per sigillare il trasduttore al cuoio capelluto del paziente viene utilizzata una membrana di silicone. Di seguito, le attuali sequenze di risonanza magnetica vengono fuse con le sequenze di pianificazione preparate in precedenza. Il punto di destinazione viene determinato neurochirurgicamente e neuroradiologicamente con l’inclusione di atlanti stereotassici e con il puntamento diretto basato sull’anatomia individuale del paziente. All’inizio dell’intervento vero e proprio, vengono eseguite sonicazioni (sonicazioni) con bassa energia di sonicazione per dieci secondi alla volta. Tra una sonicazione e l’altra, il neurologo esegue un test clinico del sintomo target e dei possibili effetti collaterali. Durante ogni sonicazione, lo sviluppo della temperatura nel voxel target e la sua localizzazione secondo il piano vengono monitorati sulla console di controllo utilizzando le sequenze MRI corrispondenti. Insieme al feedback clinico del neurologo, è importante controllare l’energia sonora e la durata prima di aumentarla gradualmente. 30’000 J oltre il massimo. 30 secondi) e quindi l’aumento della temperatura, è possibile una correzione dell’energia sonora e della posizione del punto di destinazione. In questo modo, la temperatura target di 56-60°C, che provoca la coagulazione irreversibile del tessuto, viene raggiunta gradualmente e in modo controllato. Questa procedura consente di testare in modo sicuro l’effetto clinico e i possibili effetti collaterali, nonché di regolare il punto di destinazione prima che avvenga l’ablazione definitiva e irreversibile.
Subito dopo il raggiungimento di una soglia di temperatura tra 48-55°C, si evidenzia un effetto anatomico e clinico, in base al quale si può pianificare la procedura successiva. In base alla risposta clinica al sintomo target, all’immagine morfologica dell’estensione di una lesione nel sito target e alla documentazione della temperatura target raggiunta, viene presa una decisione interdisciplinare su quando interrompere la terapia [6].
Un vantaggio della MRgFUS è che il punto di destinazione può essere pianificato durante l’intervento nella risonanza magnetica e anche controllare direttamente gli effetti collaterali o monitorare l’effetto della terapia. L’apertura del cranio non è necessaria e il rischio di infezione è quindi insignificante. La lesione posizionata con MRgFUS raggiunge le dimensioni massime dopo circa 72 ore e poi, secondo la nostra esperienza, regredisce in un arco di tempo compreso tra sei mesi e un anno, in modo tale che la lesione non è quasi più rilevabile alla risonanza magnetica. Si tratta di un vantaggio rispetto ad altre lesioni, alcune delle quali sono state descritte come se aumentassero di dimensioni nel tempo.
Ci sono diversi bersagli anatomici definiti nella regione subtalamica posteriore che sono candidati al trattamento stereotassico, sia con la DBS che con una procedura lesionale. Quale punto bersaglio scegliere dipende dalla malattia di base. Nella nostra esperienza, non solo la sindrome di Parkinson idiopatica, ma anche il tremore essenziale o distonico può essere un’indicazione per il trattamento con MRgFUS. Nel 2016 è stato condotto uno studio randomizzato e controllato con sham, che ha mostrato un chiaro vantaggio del gruppo di pazienti trattati rispetto a quelli trattati con sham per quanto riguarda la riduzione del tremore [7]. In generale, il tremore sembra essere un sintomo target particolarmente buono per il trattamento con MRgFUS. L’effetto di riduzione del tremore si è dimostrato stabile anche nello studio di follow-up dopo due anni. Noi stessi abbiamo avuto una buona esperienza con i pazienti affetti dalla sindrome del tremore essenziale. Abbiamo utilizzato il tratto cerebello-talamico (Fasciculus cerebello thalamicus, FCT) come punto di riferimento, che ha portato a un miglioramento di oltre l’80% dei sintomi [8]. Finora l’intervento è stato eseguito solo unilateralmente nel nostro centro, per evitare possibili effetti collaterali bilaterali. Dopo l’intervento, alcuni dei pazienti hanno manifestato una leggera instabilità transitoria dell’andatura come effetti collaterali e mal di testa e una sensazione non specifica di vertigini durante l’intervento. Tuttavia, non abbiamo potuto registrare alcun effetto collaterale a lungo termine, in particolare nessuna disartropia o disfagia.
Un’attenta selezione dei pazienti è essenziale per i pazienti più gravemente colpiti e spesso più morbosi che soffrono di sindrome di Parkinson idiopatica avanzata. A volte c’è incertezza sulla struttura target da scegliere per una lesione con MRgFUS. Se l’obiettivo è la riduzione del tremore puro, in questi pazienti si può anche lesionare unilateralmente la FCT come afferente cerebellare al talamo, ottenendo una riduzione del tremore controlaterale. Tuttavia, gli altri sintomi cardinali, come il rigore e la bradicinesia, non sono influenzati da questo e non è chiaro fino a che punto ci sia la possibilità di ridurre il farmaco dopo l’intervento, per evitare anche le discinesie indotte dalla L-dopa.
Nel nostro centro, abbiamo anche potuto acquisire esperienza nel trattamento dei pazienti con Parkinson. Nella maggior parte dei casi si trattava di pazienti che non erano idonei alla DBS con elettrodi per vari motivi. In questi pazienti, abbiamo scelto il tratto pallido-talamico (PTT) come punto di riferimento. Si tratta di fibre provenienti dal pallido che convergono sul talamo e sono quindi facilmente accessibili al trattamento lesionale. Anche in questo caso, abbiamo sperimentato che le sindromi dominanti il tremore, in particolare, hanno registrato un miglioramento significativo che è durato per diversi anni. Inoltre, alcuni pazienti hanno sperimentato un miglioramento della bradicinesia e del rigore, per cui si può sperare in un miglioramento anche di altri sintomi cardinali. Tuttavia, per poter valutare questo aspetto nel corso, sono necessarie ulteriori esperienze nell’ambito di studi clinici e osservazioni a lungo termine nell’ambito di uno studio in corso presso il nostro centro [8].
Recentemente, un gruppo di ricerca di Madrid ha utilizzato la MRgFUS in pazienti con sindrome di Parkinson idiopatica gravemente asimmetrica, mirando al nucleo subtalamico per la lesione. L’obiettivo era quindi lo stesso punto di destinazione della DBS descritta sopra. Secondo i dati disponibili finora, in questo caso si è verificato anche un miglioramento della sindrome di Parkinson controlaterale, senza alcuna ipercinesia legata alla lesione [9].
Nel complesso, si può affermare che il trattamento con MRgFUS è un’opzione terapeutica nuova e molto promettente per i disturbi del movimento in futuro. Si tratta di una procedura lesionale e quindi irreversibile. Tuttavia, l’intervento in sé non è invasivo e alcuni effetti collaterali legati alla chirurgia, che conosciamo bene nella DBS, non hanno alcun ruolo in questa procedura. Nelle malattie neurodegenerative progressive, come la sindrome di Parkinson idiopatica, non è possibile adattare l’effetto ottenuto dalla terapia alla progressione della malattia, poiché in questo caso sarebbe necessaria una nuova lesione.
Tuttavia, rispetto all’ampia esperienza sulla DBS disponibile attraverso studi controllati, non è ancora stata acquisita un’ulteriore esperienza con questa terapia.
Conclusione
La chirurgia stereotassica nel trattamento della malattia di Parkinson idiopatica e di altri disturbi del movimento è un’opzione di trattamento invasiva ma promettente. Questa offerta dovrebbe essere messa a disposizione dei nostri pazienti in una fase avanzata e dopo aver esaurito tutte le opzioni terapeutiche. Con un’attenta selezione del paziente e un chiarimento preliminare, le procedure hanno relativamente pochi effetti collaterali.
Messaggi da portare a casa
- Sebbene la terapia farmacologica rimanga il gold standard, la chirurgia stereotassica è un’opzione terapeutica promettente nel trattamento della malattia di Parkinson idiopatica.
- Un’attenta selezione dei pazienti è essenziale per il successo della terapia.
- La stimolazione cerebrale profonda (DBS) è un metodo di neurostimolazione non leale che utilizza elettrodi impiantati.
- Gli ultrasuoni focalizzati guidati dalla risonanza magnetica (MRgFUS) sono una procedura lesionale, irreversibile. Poiché l’intervento non richiede l’apertura del cranio o l’impianto di materiale estraneo, alcuni effetti collaterali legati alla chirurgia vengono eliminati.
- La MRgFUS sembra essere particolarmente efficace nelle sindromi dominanti il tremore.
Letteratura:
- Postuma RB, Berg D: I nuovi criteri diagnostici per la malattia di Parkinson. Int Rev Neurobiol 2017; 132: 55-78.
- Diener HC, et al: Linee guida per la diagnostica e la terapia in neurologia: pubblicate dalla Commissione per le linee guida della Società tedesca di neurologia, 5a edizione. Stoccarda 2012.
- Deuschl G, et al: Uno studio randomizzato sulla stimolazione cerebrale profonda per la malattia di Parkinson. N Engl J Med 2006; 355: 896-908.
- Schuepbach WM, et al: Neurostimolazione per la malattia di Parkinson con complicazioni motorie precoci. N Engl J Med 2013; 368(7): 610-622.
- Schreglmann SR, et al: Neurochirurgia funzionale lesionale per il tremore: ritorno al futuro? J Neurol Neurosurg Psychiatry 2017; 210: 1-9.
- Schreglmann SR, et al: Ablazione a ultrasuoni focalizzati come trattamento del tremore. Nervenarzt 2018 [Epub ahead of print].
- Elias WJ, et al: Uno studio randomizzato sulla talamotomia a ultrasuoni focalizzati per il tremore essenziale. N Engl J Med 2016; 375(8): 730-739.
- Schreglmann SR, et al: Ablazione unilaterale del tratto cerebellotalamico nel tremore essenziale mediante ultrasuoni focalizzati guidati dalla risonanza magnetica. Neurologia 2017; 88: 1329-1333.
- Martínez-Fernández R, et al: Subtalamotomia a ultrasuoni focalizzati in pazienti con malattia di Parkinson asimmetrica: uno studio pilota. Lancet Neurol 2018; 17(1): 54-63.
InFo NEUROLOGIA & PSICHIATRIA 2018; 16(4): 6-10.











