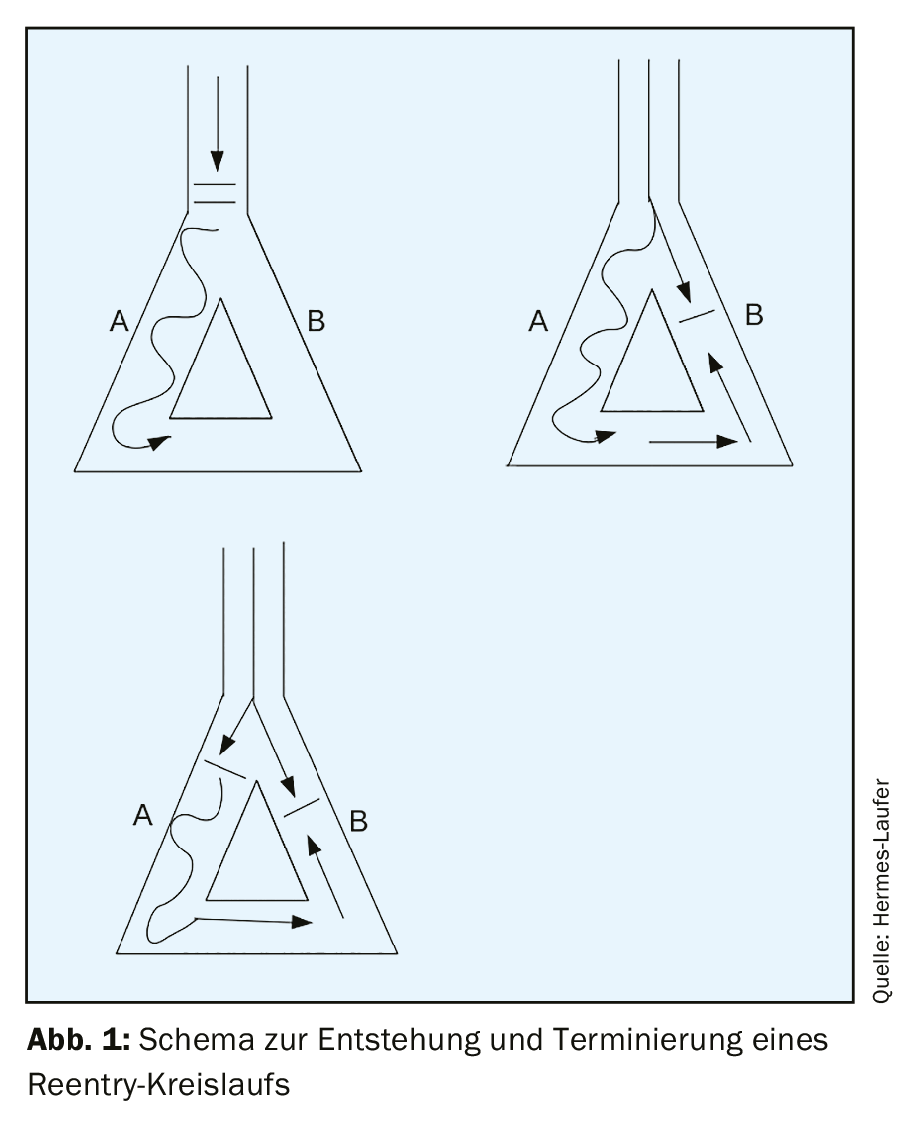
La tachicardia a complesso stretto è una presentazione clinica comune. Il rientro, in particolare, causa una tachicardia persistente. Il prerequisito per lo sviluppo di una tachicardia da rientro è un substrato con due diverse vie di conduzione, che hanno velocità di conduzione e periodi refrattari diversi. Nella maggior parte dei casi, la tachicardia sopraventricolare non è associata a una cardiopatia strutturale.
La tachicardia regolare a complessi stretti è una presentazione clinica comune con una prevalenza di 2,25/1000 pazienti [1]. I tre meccanismi alla base della tachicardia in generale sono l’automaticità, il rientro e l’attività innescata. Di gran lunga il più comune di questi tre meccanismi nella tachicardia sostenuta è il rientro. L’automaticità si verifica in modo focale ed è piuttosto rara (meno del 10% di tutte le tachicardie). L’attività innescata è un disturbo della ripolarizzazione – per cui durante la fase III o IV del potenziale d’azione, si verificano delle post-depolarizzazioni e, non appena viene raggiunto il valore soglia, si verifica un nuovo potenziale d’azione e quindi una tachicardia. Le tachicardie da rientro sopraventricolare si dividono in tachicardie da rientro del nodo AV, tachicardie da rientro AV e tachicardie da rientro atriale focale con una distribuzione di frequenza del 60%, 30% e 10% [2]. Il prerequisito per lo sviluppo di una tachicardia da rientro è un substrato con due diverse vie di conduzione, che hanno velocità di conduzione e periodi refrattari diversi. Se un trigger, come un’extrasistole, si verifica nello stesso momento in cui la via di conduzione con il periodo refrattario più lungo è ancora refrattaria, ma la via con il periodo refrattario più breve si è già ripresa, si verifica inizialmente un blocco unidirezionale e può poi portare a un’eccitazione circolare se l’eccitazione arriva nel momento in cui la seconda via di conduzione è in grado di condurre nuovamente (gap eccitabile). (Fig. 1). Nella maggior parte dei casi, la tachicardia sopraventricolare non è associata a una cardiopatia strutturale.
Diagnosi differenziale
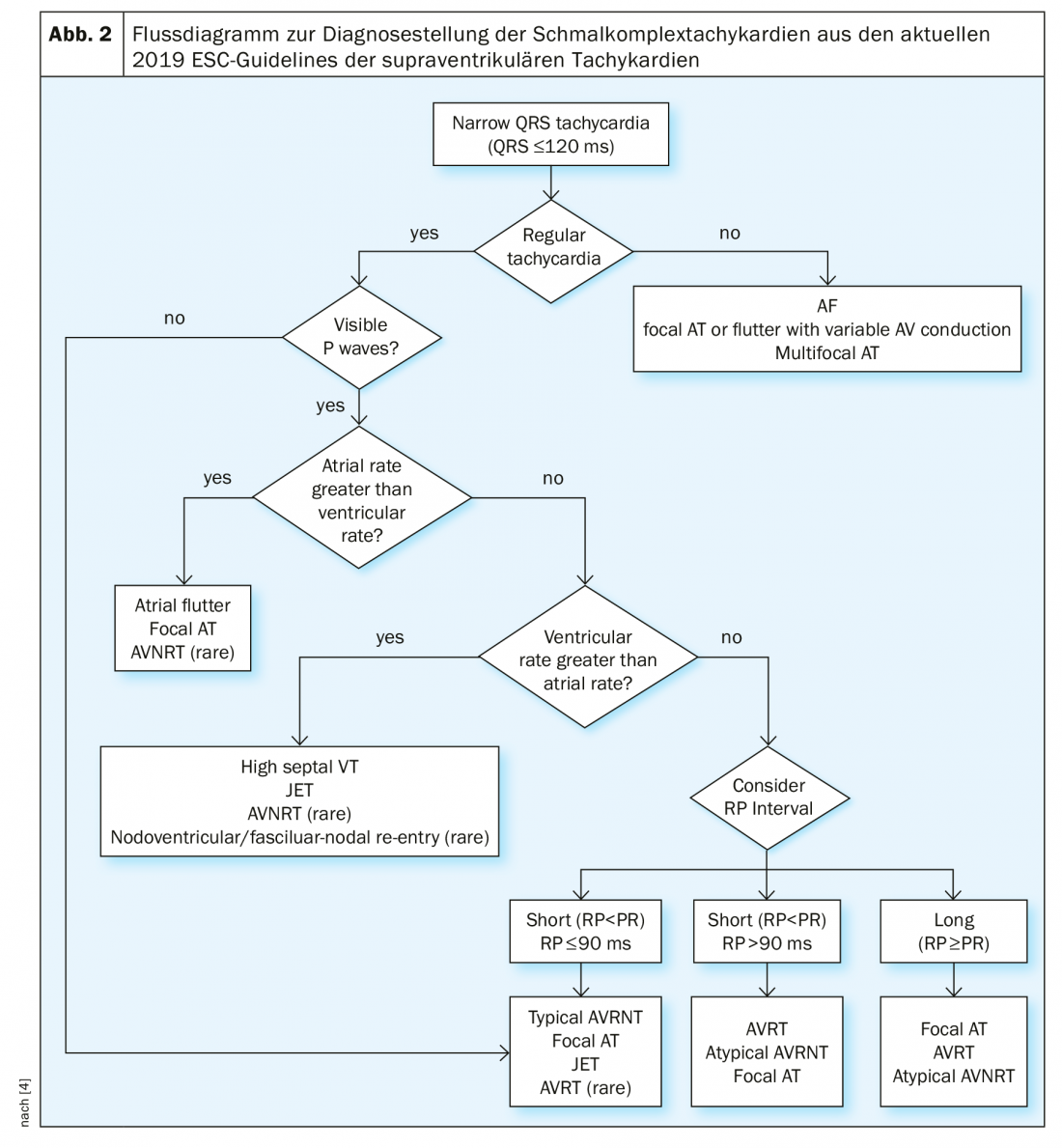
Se la tachicardia a complessi stretti con una durata del QRS <120 ms non è chiara, il paziente deve prima essere controllato per la stabilità emodinamica e, quando possibile, deve essere ottenuto un ECG a 12 derivazioni. Si consiglia di monitorare la sorveglianza e di effettuare analisi di laboratorio, tra cui l’emocromo, gli elettroliti, la funzionalità renale e la funzionalità tiroidea. Nelle 12 derivazioni, la tachicardia deve essere controllata per la sua regolarità e la presenza di onde P. La frequenza ventricolare irregolare è di solito fibrillazione atriale, flutter atriale con conduzione variabile o tachicardia atriale focale. In particolare, l’inizio e la fine della tachicardia sono di grande importanza, ad esempio con la questione dell’insorgenza e della fine improvvisa o progressiva. Se sono presenti onde P, verificare che ogni complesso QRS abbia un’onda P associata, che la distanza PR sia maggiore della distanza RP (PR>RP o RP>PR) e che la frequenza atriale sia maggiore, minore o uguale alla frequenza ventricolare. Una panoramica della diagnosi differenziale della tachicardia a complessi stretti è riportata nel diagramma di flusso delle attuali linee guida ESC (Fig. 2) . Nei casi poco chiari e con stabilità emodinamica, si deve prendere in considerazione una manovra vagale diagnostica e/o la somministrazione di adenosina per via endovenosa. Quindi, nel flutter atriale, le onde di flutter si manifestano e l’AVNRT o AVRT viene terminata nella maggior parte dei casi con una somministrazione adeguata di adenosina. Se l’adenosina non ha effetto sulla tachicardia a complesso stretto, o è stata iniettata con un dosaggio e/o una modalità di somministrazione inadeguati (iniettata troppo lentamente o senza lavaggio con NaCl) o, in rari casi, si tratta di una tachicardia ventricolare settale alta.
AVNRT
La forma più comune di tachicardia parossistica sopraventricolare – la tachicardia da rientro del nodo AV (AVNRT) è caratterizzata da un esordio improvviso e da una cessazione altrettanto improvvisa. Circa il 95% dei casi è una tipica AVNRT di tipo lento-veloce, dove la conduzione anterograda avviene attraverso la via di conduzione lenta e la conduzione retrograda attraverso la via di conduzione veloce. Nell’anamnesi si deve chiedere se c’è un aumento della diuresi durante/dopo la tachicardia e una sensazione di “bussare alla gola” (segno della rana), che sono sintomi tipici dell’AVNRT dovuti alla contrazione simultanea dell’atrio e del ventricolo con valvole chiuse e al rilascio di ANP associato. L’ECG di superficie mostra una tachicardia regolare a complessi stretti (tranne in caso di blocco di branca preesistente) senza onde P visibili o con onde P retrograde con un intervallo RP molto breve, inferiore a 70 ms (Fig. 3) [4]. Nelle AVNRT atipiche (circa il 5% delle AVNRT) di tipo veloce-lento o lento-lento, le onde P retrograde sono spesso visibili prima del complesso QRS successivo, perché l’eccitazione retrograda corre sulla via lenta.

L’AVNRT può manifestarsi nell’infanzia o nella prima età adulta, così come nella quarta o quinta decade di vita o addirittura più tardi [3,4]. La fisiologia della doppia conduzione è innata, ma la probabilità di insorgenza di AVNRT modula con l’età, in parte a causa di extrasistoli variabilmente frequenti e in parte a causa di modifiche strutturali legate all’età delle proprietà delle due vie di conduzione, che possono anche portare a una manifestazione tardiva di AVNRT [3]. Altri fattori che possono influenzare la probabilità di manifestare l’AVNRT attraverso i fattori scatenanti raggruppati sono i fattori ormonali, come nell’ipertiroidismo, e il consumo eccessivo di caffeina e alcol.
AVRT
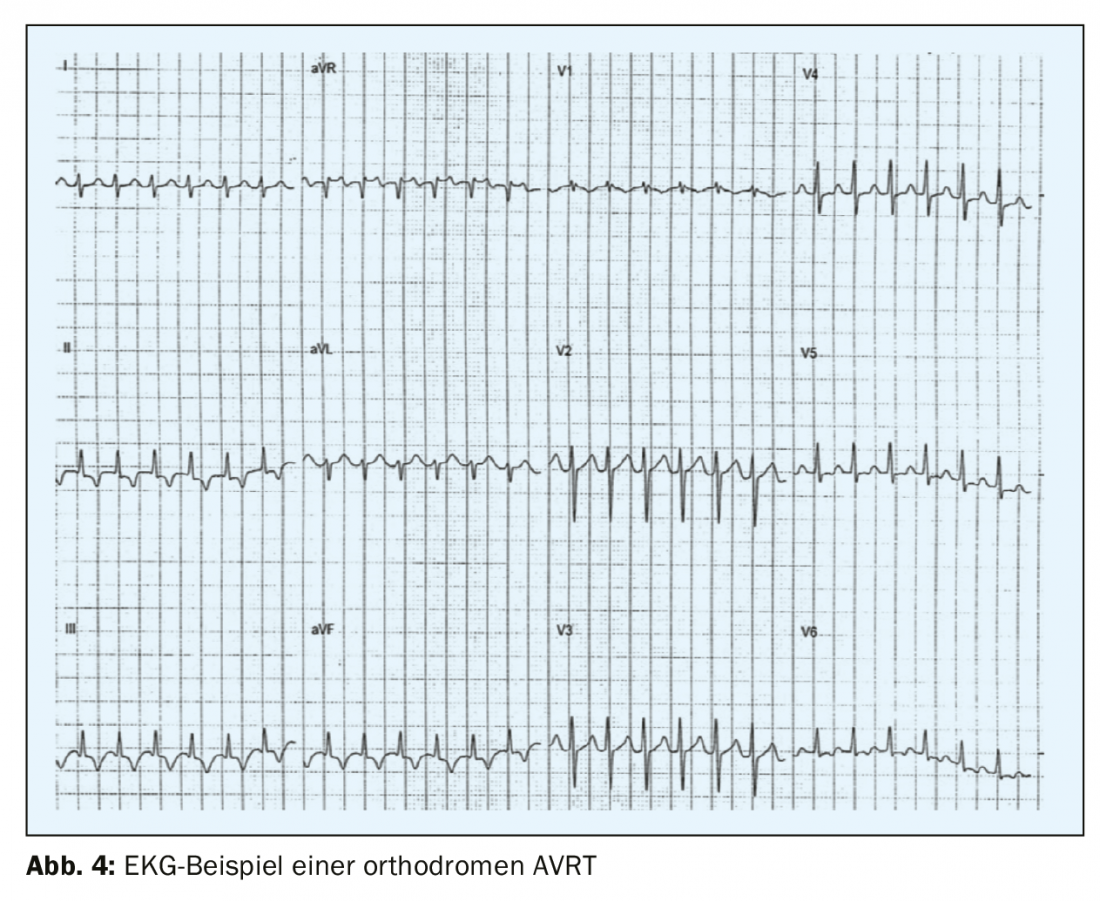
La seconda forma più comune di tachicardia parossistica sopraventricolare – AVRT – è causata da una via accessoria tra l’atrio e il ventricolo, che si trova al di fuori del sistema di conduzione specifico. La sindrome da preeccitazione – o sindrome di Wolff-Parkinson-White è stata descritta per la prima volta nei primi anni ’30 dai tre cardiologi che le hanno dato il nome, Louis Wolff, John Parkinson e Paul Dudley White, e quasi contemporaneamente da Max Holzmann a Zurigo. Più comunemente, la via accessoria si trova lungo la valvola mitrale sulla parete libera sinistra (circa il 60-70% delle vie accessorie), seguita da vie situate a livello settale sull’anulus mitralico o tricuspidale (circa il 25%) e solo il 15% si trova sulla parete libera della RV [5]. Alcuni pazienti (<12%) presentano vie accessorie multiple, che dovrebbero essere considerate, ad esempio, nei pazienti con anomalia di Ebstein [6]. Nella sindrome da preeccitazione, c’è una via accessoria manifesta, aritmie frequenti e un quadro tipico di preeccitazione sull’ECG con la tipica onda delta, una corsa verso l’alto o verso il basso appiattita del complesso QRS e un complesso QRS ampliato di oltre 120 ms. Nella maggior parte dei casi, i pazienti con la sindrome di WPW hanno un cuore strutturalmente normale e sono nell’infanzia o nell’adolescenza al momento della prima manifestazione. Gli uomini sono colpiti più spesso delle donne. Nella AVRT ortodromica (>90% delle AVRT e il 20-30% di tutte le tachicardie sopraventricolari sostenute), il circuito passa prima dall’atrio al ventricolo attraverso il normale sistema di conduzione e torna dal ventricolo all’atrio attraverso la via accessoria. L’ECG della crisi mostra una tachicardia regolare a complessi stretti con una frequenza per lo più di 160-220/min con onde P retrograde con un intervallo RP di >70 ms (RP<PR) (Fig. 4) .
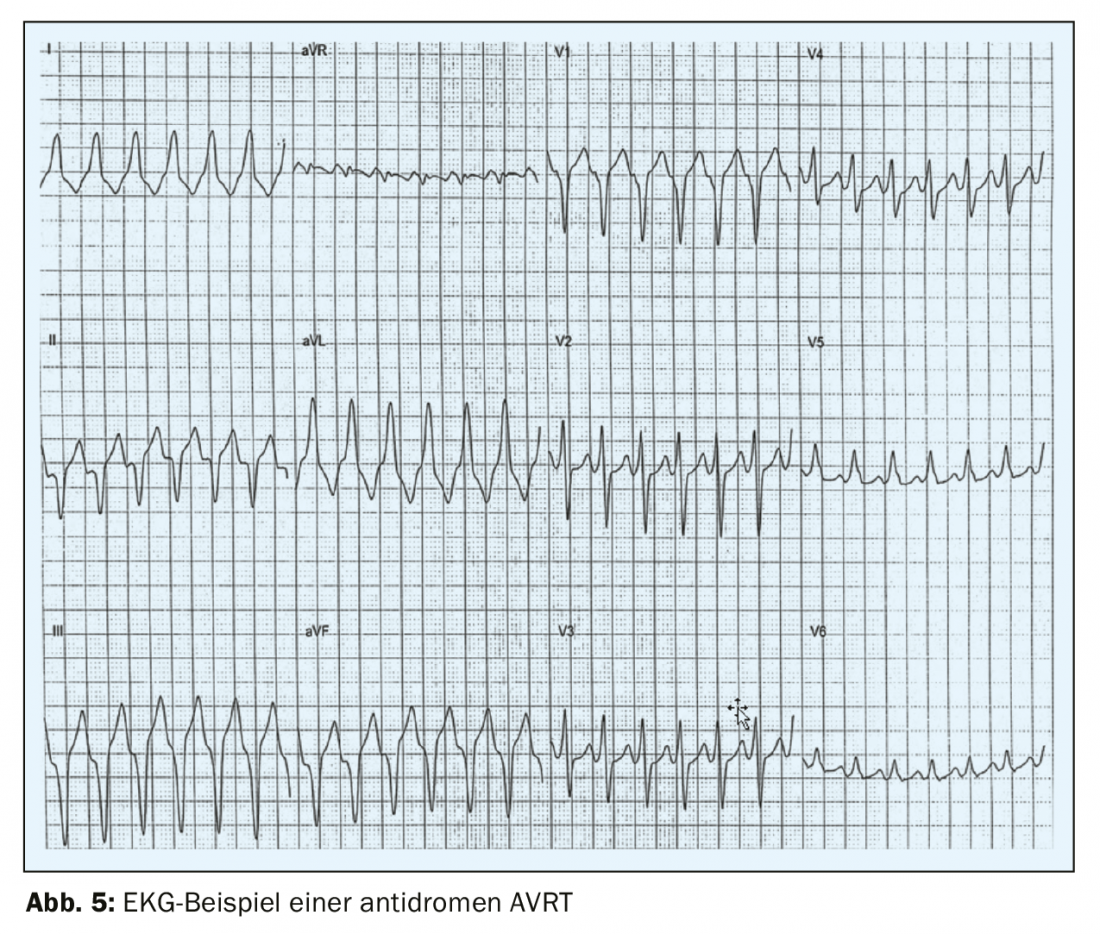
L’AVRT antidromica, molto più rara, si verifica solo nel 3-8% dei pazienti con WPW [7], con l’eccitazione che inizialmente passa dall’atrio al ventricolo attraverso la via accessoria e di nuovo attraverso il nodo AV. L’ECG di superficie mostra un complesso QRS ampio, che rende difficile distinguere l’AVRT antidromica dalla tachicardia ventricolare (Fig. 5). La fibrillazione atriale parossistica si verifica nel 50% dei pazienti con sindrome di WPW. [8,4]che può essere pericolosa per la vita e degenerare in fibrillazione ventricolare se condotta attraverso la via accessoria e con una frequenza ventricolare elevata. Sull’ECG di superficie, questa aritmia si riconosce per una frequenza veloce e irregolare e un complesso QRS ampio con pre-eccitazione [9] (FBI – veloce, ampio, irregolare). Per questo motivo, è fondamentale che anche i risultati incidentali di un ECG di pre-eccitazione in pazienti asintomatici siano sempre chiariti ritmologicamente e trattati nella maggior parte dei casi. Nella cosiddetta “WPW nascosta”, esiste solo una via accessoria conduttrice retrograda – di solito sulla parete LV libera, ma la preeccitazione non è visibile sull’ECG di superficie e la manifestazione iniziale è una AVRT ortodromica. Poiché in questo caso la via accessoria non può condurre per via anterograda, i pazienti con una WPW nascosta non sono ad alto rischio di morte cardiaca improvvisa.
Tachicardia atriale
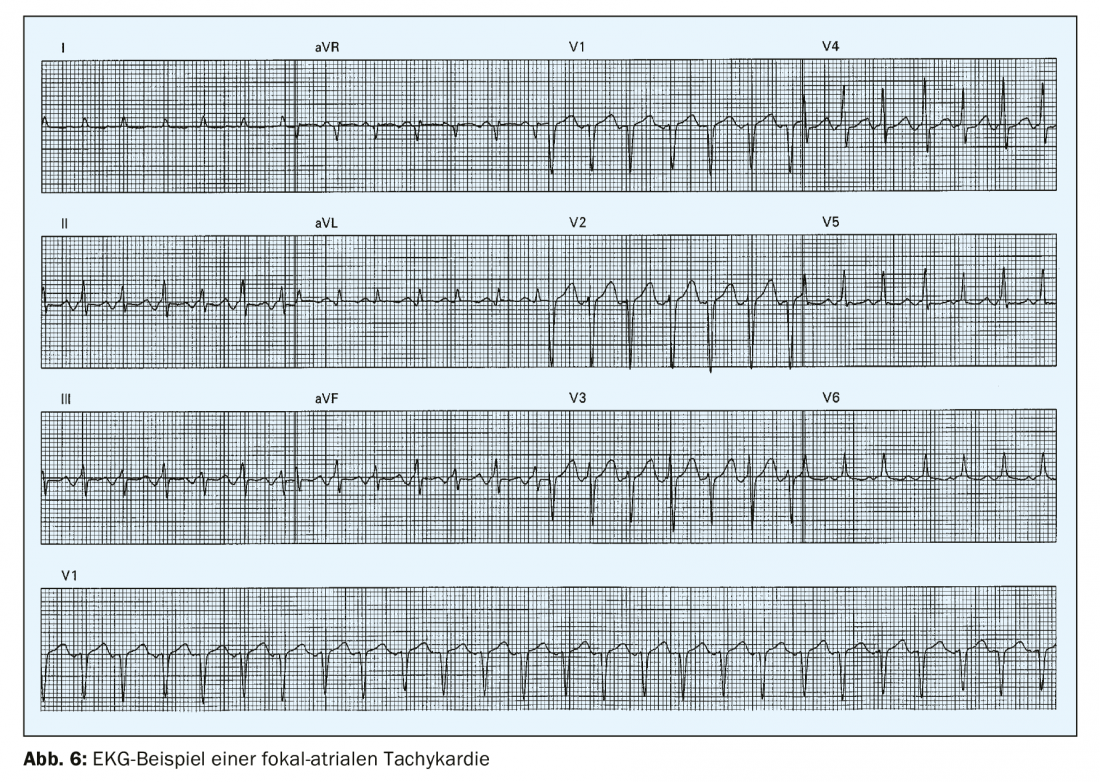
La tachicardia atriale focale è un ritmo atriale organizzato >100/min che ha origine al di fuori del nodo del seno (Fig. 6). È rara, con una prevalenza dello 0,34% nei giovani adulti [4] e rappresenta meno del 10% di tutte le SVT. Nell’ECG di superficie, si trovano onde P monomorfiche con una lunghezza del ciclo stabile. Il meccanismo di innesco può essere un micro-ritorno o un’automaticità. La tachicardia atriale focale spesso ha origine nell’area delle giunzioni veno-atriali, ad esempio nel seno coronarico, nell’area della crista terminalis o dell’anulus mitrale o tricuspide. La configurazione dell’onda P nell’ECG a 12 derivazioni può fornire informazioni sull’origine della tachicardia atriale focale.
Flutter atriale
Il flutter atriale deve essere distinto tra il tipico flutter atriale istmo-dipendente (90%) con macroritorno in senso antiorario o orario intorno all’istmo cavotricuspidale (anulus tricuspidale) e il flutter atipico. Nel flutter atriale tipico, si distingue tra il tipo I con un macroritorno in senso antiorario intorno all’istmo cavotriscupidale e il tipo II con un macroritorno in senso orario. I rispettivi ECG per il flutter atriale tipico di tipo I e di tipo II possono essere molto diversi – ad esempio, le tipiche “onde a dente di sega” si verificano nel flutter di tipo I e possono essere completamente assenti nel flutter di tipo II, in quanto sono spesso nascoste nel complesso QRS e nelle onde T qui. Il flutter atriale atipico può avere origine nell’atrio destro o sinistro ed è comunemente osservato nei pazienti pre-operati, nei pazienti con difetti cardiaci congeniti o a seguito di interventi come l’ablazione della fibrillazione atriale, dove esiste un substrato appropriato attorno al quale ruota il circuito del flutter. Nell’ECG di superficie, il flutter tipico è visibile nelle onde di flutter a dente di sega nell’ECG, che di solito hanno una frequenza di circa 300/min e si presentano negativamente nelle derivazioni inferiori e positivamente in V1 nel caso del tipico flutter atriale ismo-dipendente in senso antiorario. La transizione AV è spesso 2:1, ma può essere 3-4:1, 1:1 o variabile. Pertanto, in caso di SVT regolare con una frequenza di circa 150/min, il flutter atriale deve essere sempre considerato come diagnosi differenziale, indipendentemente dal fatto che le onde di flutter siano visibili o meno sull’ECG di superficie. Il nodo AV entra fisiologicamente in un blocco 2:1 o superiore durante il flutter atriale, a causa del suo periodo refrattario e della proprietà di conduzione decrementale. Clinicamente, il flutter atriale è spesso associato alla fibrillazione atriale e i pazienti dovrebbero essere sottoposti a screening per questo.
Una discussione sulla fibrillazione atriale esula dallo scopo di questo articolo, salvo ricordare che una tachicardia irregolare con aritmia assoluta senza onde P chiare è una fibrillazione atriale e la documentazione dell’ECG deve essere ricercata per un’ulteriore gestione.
Gestione
Gestione dell’AVNRT: nella terapia acuta, la cardioversione sincronizzata dovrebbe essere eseguita nei pazienti emodinamicamente instabili, il che è estremamente raro nella pratica (indicazione di classe IB). Le manovre vagali come la manovra di Valsalva con la pressione addominale, il massaggio unilaterale del seno carotideo o l’assunzione rapida di acqua fredda possono spesso interrompere la tachicardia da rientro (indicazione di classe IB). Il massaggio del seno carotideo deve essere sempre preceduto dall’auscultazione per identificare la stenosi carotidea e in genere deve essere eseguito con cautela nei pazienti anziani con aterosclerosi. Se le manovre vagali falliscono, il paziente è stabile e non ci sono controindicazioni, 6-18 mg di adenosina devono essere somministrati rapidamente e con NaCl-flush i.v. (indicazione di classe IB). L’applicazione di farmaci antiaritmici come i beta-bloccanti iv o il verapamil o il diltiazem è inclusa come opzione terapeutica nelle attuali linee guida (indicazione di classe IIa), ma può portare all’ipotensione e al blocco AV transitorio ed è solo estremamente raramente necessaria nella pratica attuale. Il gold standard per il trattamento a lungo termine dell’AVNRT tipica e atipica è l’ablazione con catetere, che porta alla guarigione nel 97% dei casi e a complicazioni gravi [10] come il blocco AV e la dipendenza da pacemaker solo nello 0,3%. Il tasso di complicanze dipende dall’esperienza degli elettrofisiologi. Non c’è un limite di età per l’ablazione con catetere, anche gli anziani in età avanzata con comorbidità dovrebbero essere sottoposti ad ablazione con catetere.
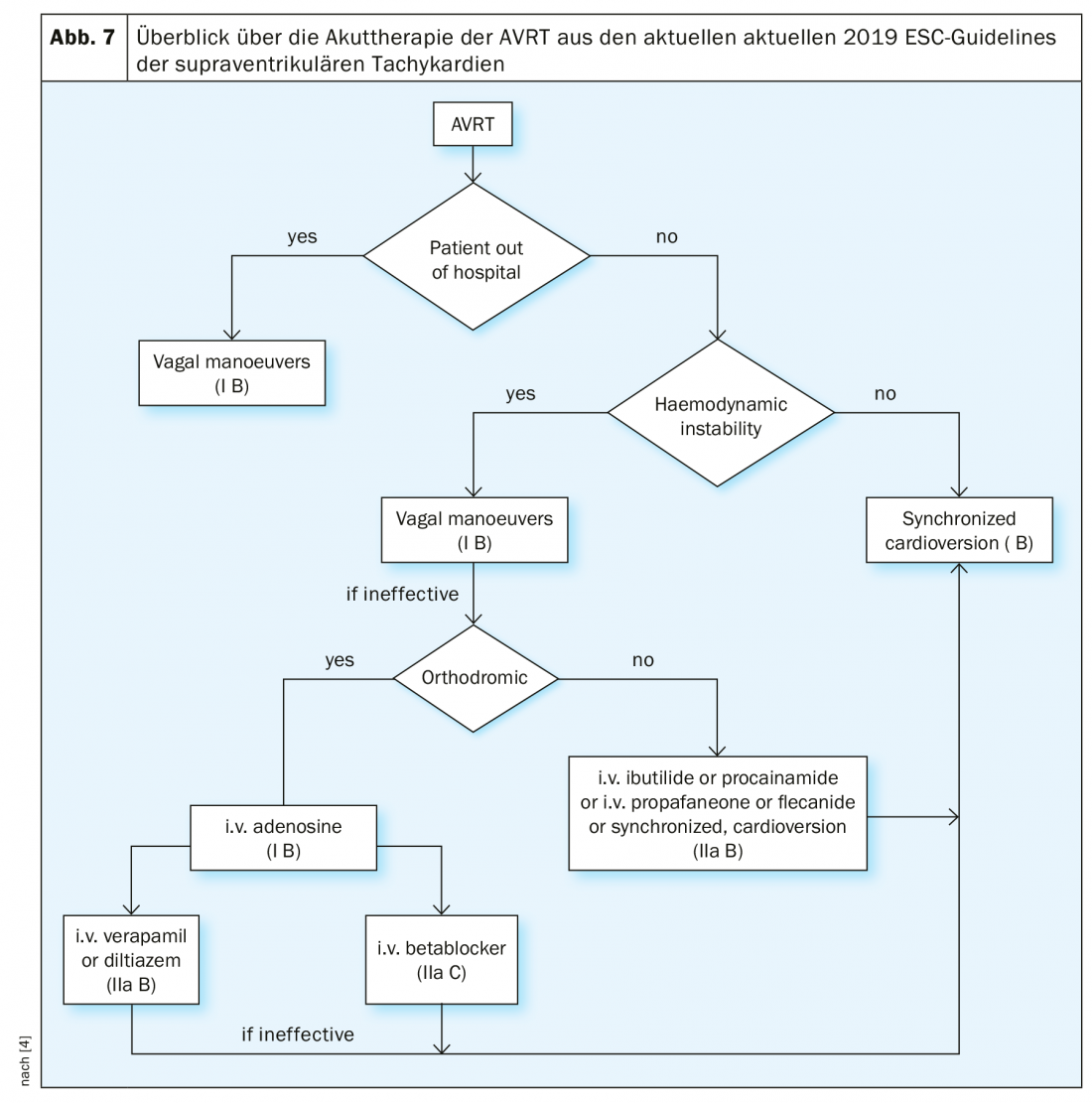
Gestione della AVRT: nella terapia acuta, la cardioversione sincronizzata deve essere eseguita nei pazienti emodinamicamente instabili (indicazione di classe IB). Anche le manovre vagali, come la AVNRT, sono indicate e possono terminare la tachicardia (indicazione di classe IB). Nella terapia farmacologica, occorre distinguere tra AVRT ortodromica e antidromica.
Nella AVRT ortodromica, l’adenosina 6-18 mg deve essere somministrata per via endovenosa (indicazione di classe IB), che è ancora più efficace nella AVRT che nella AVNRT. I farmaci cronotropi negativi devono essere evitati nella AVRT antidromica. Le opzioni terapeutiche, oltre alla cardioversione sincronizzata, sono flecainide, procainamide o propafenone – come nella fibrillazione atriale con preeccitazione. Il diagramma di flusso delle attuali linee guida SVT offre una panoramica della terapia acuta della AVRT (Fig. 7).
Dopo il trattamento acuto, il gold standard, come per l’AVNRT, è l’ablazione della via accessoria. Il tasso di complicanze dell’ablazione dipende dalla posizione della via accessoria; le complicanze principali includono il blocco AV completo (0,17-2,7%) e il tamponamento pericardico (0,1-1,1%) [4]. Le vie accessorie sinistre possono essere ablate con un approccio aortico transettale o retrogrado. Se il paziente non desidera l’ablazione con catetere, si possono usare betabloccanti, diltiazem o verapamil per la WPW nascosta e antiaritmici di classe IC per la WPW manifesta, “palese”. Nella WPW manifesta, i calcio antagonisti di tipo verapamil (e i farmaci digitalici) sono controindicati perché rallentano la conduzione attraverso il nodo AV, favorendo una conduzione rapida attraverso la via accessoria e quindi una frequenza ventricolare minacciosamente rapida.
Gestione del flutter atriale: il controllo farmacologico non è sempre facile da ottenere nel flutter atriale, le combinazioni di farmaci cronotropi negativi (betabloccanti, calcio antagonisti, digossina) possono essere utilizzate con cautela. L’anticoagulazione deve essere iniziata secondo gli stessi criteri della fibrillazione atriale (punteggio CHA2DS2-VASc ≥1 punto). Non di rado, la cardioversione sincronizzata è necessaria nella terapia acuta perché il controllo della frequenza indotto dai farmaci è insufficiente. L’amiodarone può essere utilizzato anche per il controllo della frequenza, ma può ottenere il controllo del ritmo solo nel 29% dei casi [11], quindi la strategia principale per il controllo del ritmo nel flutter atriale è la cardioversione sincronizzata. La cardioversione del flutter atriale richiede meno energia rispetto alla cardioversione della fibrillazione atriale ed è più efficiente. Nei pazienti con un pacemaker e un elettrocatetere atriale presente, la sovrastimolazione atriale può portare all’interruzione del flutter. L’adenosina deve essere utilizzata solo per confermare la diagnosi e smascherare le onde di flutter quando l’ECG non è chiaro e può provocare una fibrillazione atriale. Il gold standard della terapia a lungo termine è l’ablazione con catetere, che porta al 90% di libertà da recidive nel flutter atriale istmo-dipendente. L’ablazione del flutter atriale atipico è più difficile, poiché spesso è necessario mappare e ablare circuiti elettrici multipli attorno a substrati individuali. Nella fibrillazione atriale, l’obiettivo deve essere quello di ottenere un controllo del ritmo adeguato alla situazione generale del paziente. È indispensabile seguire le linee guida sull’anticoagulazione per tutte le misure di controllo del ritmo e della frequenza per il flutter atriale e la fibrillazione atriale.
Gestione della tachicardia atriale focale: Nella terapia acuta, si possono usare beta-bloccanti o calcio antagonisti per rallentare la frequenza ventricolare [4]. L’adenosina può portare alla cessazione o addirittura alla bradicardia in circa il 50% dei casi e quindi non sempre aiuta nella diagnosi e nel trattamento [12]. Nei pazienti sintomatici con tachicardia atriale focale ricorrente, deve essere eseguita l’ablazione con catetere.
Messaggi da portare a casa
- La cardioversione sincronizzata deve essere eseguita nei pazienti emodinamicamente instabili, indipendentemente dalla forma di SVT.
- La documentazione della tachicardia mediante ECG a 12 derivazioni è di grande importanza per la gestione successiva e deve essere sempre ricercata.
- Le manovre vagali e l’adenosina (6-18 mg come bolo i.v.) sono indicate nella stabilità emodinamica sia per confermare la diagnosi che per
- Terapia acuta se non ci sono controindicazioni.
- L’ablazione con catetere è una terapia a lungo termine sicura ed efficace per l’AVNRT, l’AVRT e il flutter atriale tipico, con alti tassi di assenza di recidive e bassi tassi di complicanze nei centri specializzati.
- Nella tachicardia atriale, la terapia iniziale è la terapia farmacologica, ma nei pazienti sintomatici con recidive, si deve considerare anche l’indicazione all’ablazione con catetere.
Letteratura:
- Delacretaz E: Tachicardia sopraventricolare. New England Journal of Medicine, 2006; 354(10): 1039-1051.
- Wellens HJ: Elettrofisiologia, 25 anni di intuizioni sui meccanismi delle aritmie sopraventricolari: NASPE HISTORY SERIES. 2003; 26(9): 1916-1922.
- Pentinga ML, et al: Tachicardia nodale atrioventricolare ad esordio tardivo. 1993; 38(3): 293-298.
- Brugada J, et al: Linee guida ESC 2019 per la gestione dei pazienti con tachicardia sopraventricolareLa Task Force per la gestione dei pazienti con tachicardia sopraventricolare della Società Europea di Cardiologia (ESC). 2019.
- Jackman WM, et al: Ablazione con catetere delle vie atrioventricolari accessorie (sindrome di Wolff-Parkinson-White) mediante corrente di radiofrequenza. 1991; 324(23): 1605-1611.
- Cappato R, et al: Ablazione con catetere a radiofrequenza delle vie atrioventricolari accessorie nell’anomalia di Ebstein. 1996; 94(3): 376-383.
- Brembilla-Perrot B, et al: Incidenza e significato prognostico della tachicardia antidromica spontanea e inducibile. 2013; 15(6): 871-876.
- Gemma LW, et al: Sviluppo di una rapida risposta ventricolare preeccitata alla fibrillazione atriale in un paziente con preeccitazione intermittente. 2013; 24(3): 347-350.
- Etheridge SP, et al: Rischio di eventi pericolosi per la vita nei bambini con sindrome di Wolff-Parkinson-White: uno studio internazionale multicentrico. 2018; 4(4): 433-444.
- Spector P, et al: Meta-analisi dell’ablazione del flutter atriale e della tachicardia sopraventricolare. 2009; 104(5): 671-677.
- Kafkas NV, et al: Efficacia di conversione dell’ibutilide per via endovenosa rispetto all’amiodarone per via endovenosa nei pazienti con fibrillazione atriale e flutter atriale di recente insorgenza. 2007; 118(3): 321-325.
- Eidher U, et al: Efficacia e sicurezza dell’ibutilide per la conversione della tachicardia atriale monomorfa. 2006; 29(4): 358-362.
CARDIOVASC 2020; 19(2): 6-11