L’incidenza annuale del melanoma maligno è aumentata costantemente negli ultimi 40 anni. Mentre la prognosi è buona nelle fasi iniziali, si deteriora con l’aumentare dello stadio del tumore. La terapia adiuvante con inibitori del checkpoint o di BRAF/MEK ha avuto un impatto duraturo sulla gestione dei casi avanzati e continua ad essere in evoluzione.
L’incidenza annuale del melanoma maligno è aumentata costantemente negli ultimi 40 anni, variando in Europa da 3-5/100.000 nei Paesi mediterranei a 12-35/100.000 nei Paesi nordici. In questo contesto, l’80% dei melanomi maligni viene diagnosticato in uno stadio localizzato. Per il melanoma in fase iniziale, la resezione chirurgica è il trattamento standard ed è associata ad una buona prognosi a lungo termine. Il tasso di sopravvivenza globale (OS) a cinque anni è del 65-100% per la malattia negli stadi I-II e diminuisce per i pazienti con metastasi locali (stadio III) al 41-71% e nei pazienti con metastasi a distanza (stadio IV) al 9-28% [1].
Classificazione del melanoma e alterazioni genetiche molecolari
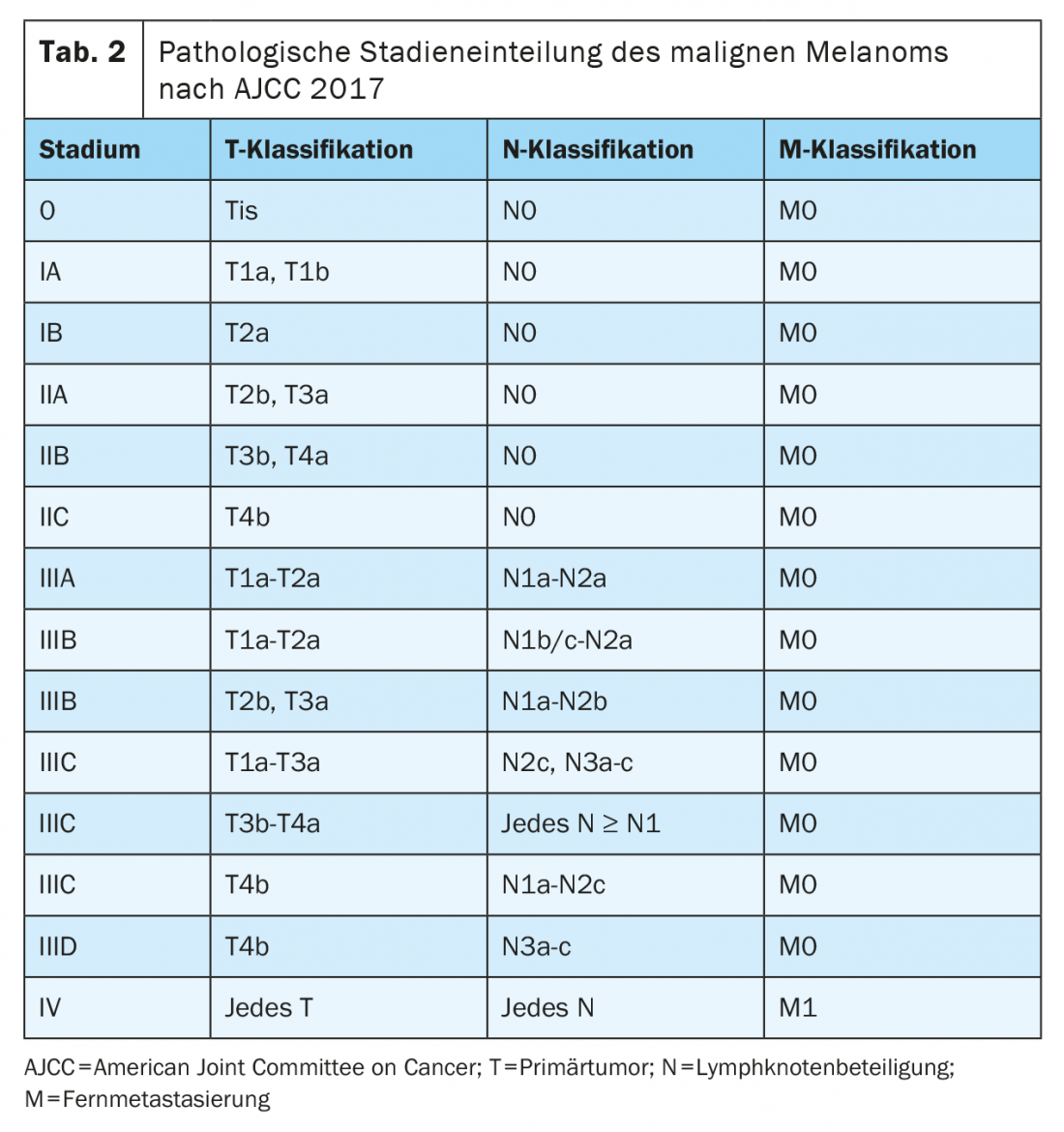
Da gennaio 2018, il melanoma è stato classificato secondo l’ottava edizione del Manuale di Stadiazione AJCC (Tabelle 1 e 2) . Lo spessore verticale del tumore secondo Breslow è il fattore prognostico più importante e viene preso in considerazione per determinare il trattamento successivo, compresi i margini di sicurezza richiesti e la necessità di una biopsia del linfonodo sentinella. La presenza di ulcerazione è un altro marcatore istopatologico rilevante, che è associato a una prognosi peggiore e viene registrato nello stadio T della classificazione TNM.
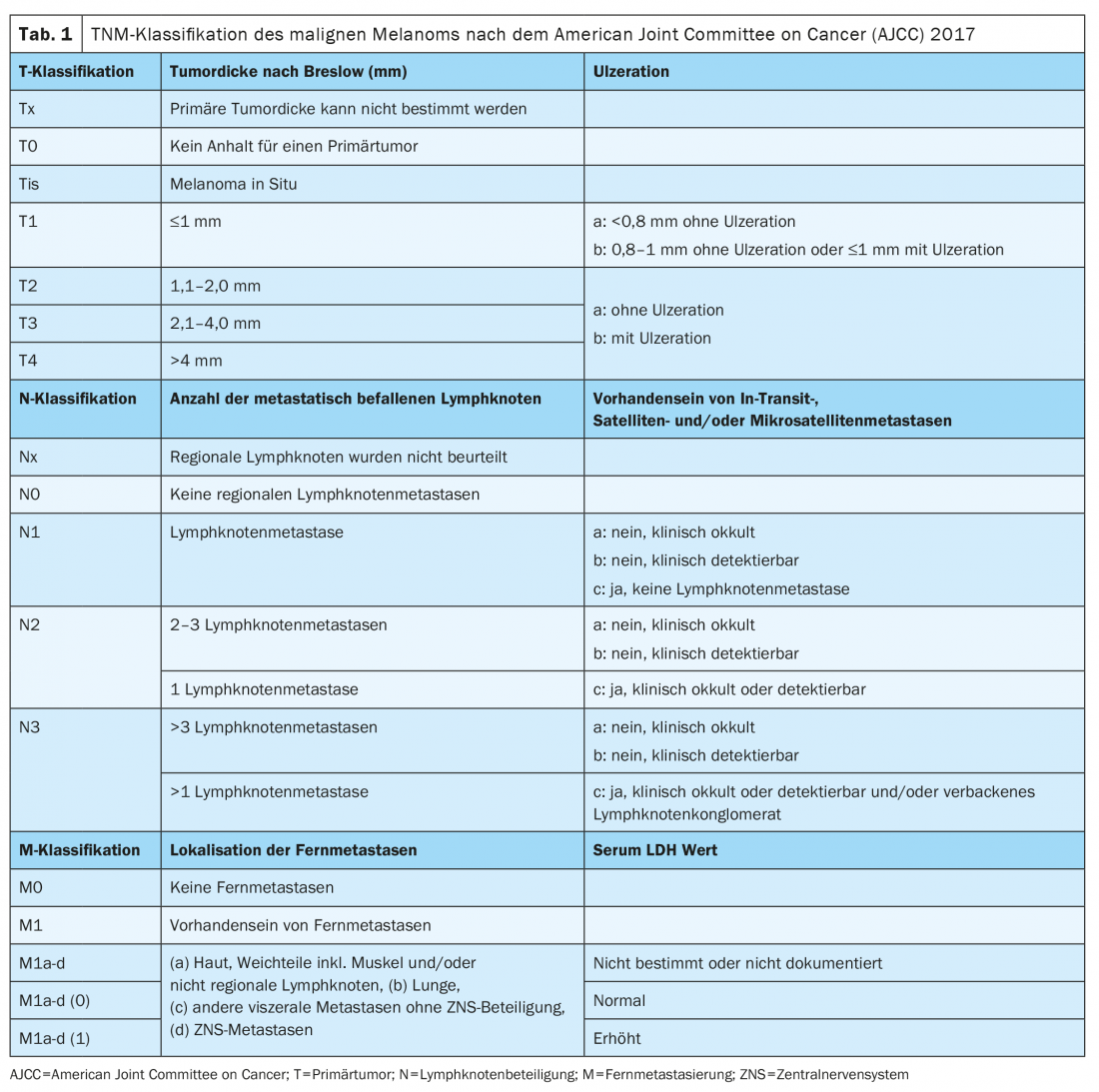
La diagnostica molecolare patologica che utilizza il sequenziamento di nuova generazione (NGS) per determinare lo stato di BRAF dovrebbe essere eseguita nel melanoma localmente avanzato o metastatico di stadio III e IV. L’esame immunoistochimico permette di rilevare solo una mutazione V600E, mentre V600K e altre mutazioni atipiche non possono essere rilevate. La classificazione genomica del melanoma cutaneo prevede una divisione in quattro sottotipi: Melanoma con mutazione BRAF (50%); mutazione N-Ras, K-Ras o H-Ras (25%); mutazione NF1 (15%) e melanoma triplo wild-type (10%) [2].
Nonostante i progressi significativi nella comprensione della base genetica del melanoma, l’uso delle alterazioni genetiche a fini diagnostici, prognostici o terapeutici rimane limitato. Lo stato di mutazione BRAFV600E/K è predittivo del trattamento con inibitori BRAF. Sebbene attualmente non esistano terapie mirate consolidate per le altre alterazioni genetiche, queste forniscono informazioni importanti per l’inclusione nello studio, nonché potenziali approcci terapeutici futuri.
Terapia chirurgica del tumore primario e dei linfonodi regionali
Se si sospetta clinicamente un melanoma maligno, si deve eseguire un’escissione in toto. Dopo la conferma istopatologica di un melanoma maligno, il trattamento primario è l’escissione locale con un margine di sicurezza sufficiente, a seconda dello spessore del tumore secondo Breslow (0,5 cm per i melanomi in situ, 1 cm per i melanomi con uno spessore del tumore fino a 2 mm, 2 cm da uno spessore del tumore di 2 mm). Un margine di sicurezza sufficiente è associato a una riduzione del tasso di recidiva locale, senza migliorare la sopravvivenza globale [3]. Per le localizzazioni nell’area facciale o genitale, la distanza di sicurezza raccomandata può essere adattata se si deve presumere una morbilità significativa nonostante la chirurgia ricostruttiva. Bisogna sottolineare che le distanze di sicurezza non devono essere ridotte per motivi estetici.
La biopsia del linfonodo sentinella (SLNB) è raccomandata nelle linee guida ESMO per uno stadio pT1b (ossia uno spessore del tumore secondo Breslow di >0,8 mm o <0,8 mm con ulcerazione) secondo l’AJCC 8a edizione. Lo studio prospettico MSLT-I ha convalidato il valore prognostico e il contributo del linfonodo sentinella (SLK) alla stadiazione, senza dimostrare un beneficio in termini di sopravvivenza per questa procedura [4]. Fino al 2017, la dissezione linfonodale completa per un linfonodo sentinella positivo era considerata il trattamento standard. Sia lo studio tedesco DeCOG-SLT che lo studio internazionale MSLT-2 hanno confrontato il controllo ecografico regolare dell’area di drenaggio linfatico con la dissezione linfonodale completa (LND) per la SLK positiva [5,6]. Entrambi gli studi hanno riscontrato un aumento della morbilità (linfedema), ma nessun miglioramento significativo della sopravvivenza specifica del melanoma. A partire dal 2019, la LND per un linfonodo sentinella positivo non è più raccomandata nelle linee guida ESMO [7]. Tuttavia, la LND è ancora raccomandata per il coinvolgimento linfonodale macroscopico. Va notato che entrambi gli studi sono stati condotti prima dell’introduzione delle terapie sistemiche adiuvanti e che la dissezione linfonodale è stata eseguita nelle popolazioni di studio delle terapie adiuvanti [8–10].
Terapia sistemica adiuvante
Dopo una resezione completa con un margine di sicurezza sufficiente e la libertà dal tumore, i pazienti con melanoma negli stadi IIB, IIC, III e IV presentano un rischio significativo di recidiva. In questi stadi tumorali, si dovrebbe prendere in considerazione la terapia sistemica adiuvante per ridurre il rischio di recidiva locale e di metastasi a distanza e per migliorare la sopravvivenza globale. Gli inibitori del checkpoint immunitario e le terapie mirate sono attualmente approvati negli Stati Uniti e in Europa per il trattamento adiuvante del melanoma completamente resecato negli stadi III e IV e riducono il rischio di recidiva di circa il 50%. Le indicazioni e le approvazioni variano a seconda dei criteri di inclusione dello studio. Va notato che la stadiazione di queste popolazioni di studio si basa sull’AJCC 7° Edizione 2009.
Terapia mirata adiuvante con inibitori BRAF e MEK
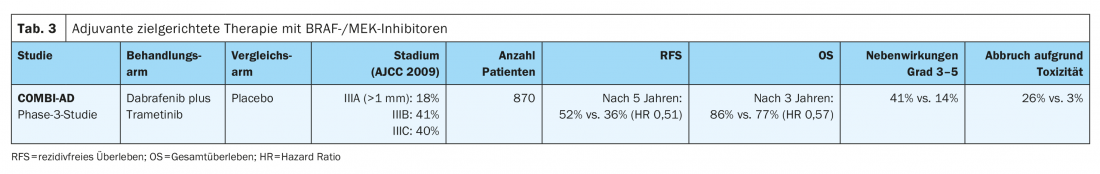
Nello studio COMBI-AD di fase III (Tab. 3) , i pazienti con melanoma completamente resecato con una mutazione BRAFV600E/K negli stadi IIIA (metastasi SLK >1 mm), IIIB e IIIC sono stati trattati per 12 mesi con una terapia perorale mirata con gli inibitori BRAF e MEK dabrafenib e trametinib o placebo. A un follow-up mediano di cinque anni, è stato dimostrato un miglioramento significativo della sopravvivenza libera da recidiva (RFS) (hazard ratio HR 0,51) e anche della sopravvivenza libera da metastasi (HR 0,55) per questa terapia adiuvante rispetto al placebo. La combinazione ha anche migliorato la sopravvivenza globale (OS) dopo tre anni (HR 0,57). Il beneficio è stato documentato in tutti i sottogruppi [8,11]. Successivamente, la terapia mirata con dabrafenib e trametinib ha ricevuto l’approvazione in tutta l’Unione Europea nell’agosto 2018 per il trattamento adiuvante del melanoma maligno metastatico linfogenico con mutazione BRAFV600E/K.
Lo studio BRIM8 ha confrontato la monoterapia adiuvante con l’inibitore BRAF vemurafenib con il placebo nel melanoma resecato di stadio IIC-III. L’endpoint primario di prolungare la sopravvivenza libera da malattia non è stato raggiunto nello studio, quindi la monoterapia con un BRAF inibitore nel contesto adiuvante non è un’opzione di trattamento.
Immunoterapia adiuvante
Nello studio CheckMate-238 (Tab. 4) La terapia adiuvante per via endovenosa con l’anticorpo monoclonale anti-PD-1 nivolumab (3 mg/kg) ha mostrato un miglioramento significativo della sopravvivenza libera da recidiva (HR 0,71) e da metastasi (HR 0,79) dopo quattro anni per i melanomi di stadio IIIB/C e IV completamente resecati, rispetto all’anticorpo anti-CTLA4 ad alto dosaggio ipilimumab (10 mg/kg). La sopravvivenza globale dopo quattro anni era paragonabile nei due bracci di trattamento (HR 0,87). Inoltre, rispetto a ipilimumab ad alto dosaggio, con nivolumab si è verificato un numero significativamente inferiore di eventi avversi gravi (grado 3-5) con interruzione consecutiva del trattamento (9,7% contro 42,6%). I risultati in termini di tossicità tardive sono stati simili nei due bracci di trattamento (1% vs. 2%) [10,12]. Nivolumab è stato approvato in tutta l’UE nel 2018 per la terapia adiuvante del melanoma maligno negli stadi III e IV dopo metastasectomia completa.
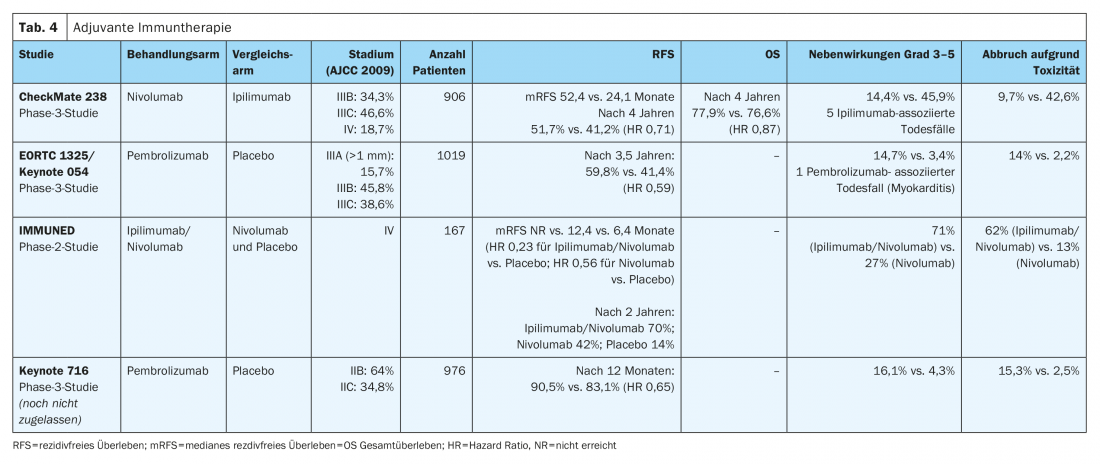
L’efficacia dell’anticorpo anti-PD-1 pembrolizumab è stata dimostrata nello studio di fase III EORTC1325/Keynote-54 nei pazienti con melanoma in stadio IIIA completamente resecato (metastasi al linfonodo sentinella). >1 mm), IIIB o IIIC (senza metastasi in transito) (Tabella 4). A un follow-up mediano di tre anni, pembrolizumab è stato associato a una sopravvivenza libera da recidiva significativamente più lunga rispetto al placebo nella popolazione complessiva (HR 0,56). Gli eventi avversi gravi (grado 3-5) sono stati osservati più frequentemente con pembrolizumab rispetto al placebo (14% vs. 3%) [9]. Pembrolizumab ha ricevuto l’approvazione a livello europeo per questa indicazione nel gennaio 2019.
L’effetto positivo in termini di miglioramento della sopravvivenza libera da recidiva è stato osservato in tutti i sottogruppi predefiniti sia nello studio EORTC1325/Keynote-054 che nello studio CheckMate-238. In entrambi gli studi, l’inibitore del checkpoint immunitario è stato somministrato per una durata totale della terapia di un anno.
I risultati preliminari dello studio randomizzato di fase III CheckMate 915 (Tab. 4) non mostrano alcun miglioramento nella sopravvivenza libera da recidiva dei pazienti con melanoma avanzato, resecato in stadio IIIB-D o IV, che ricevono la terapia adiuvante con nivolumab (240 mg ogni 2 settimane) in combinazione con ipilimumab (1 mg/kg ogni 6 settimane) per una durata totale del trattamento di 12 mesi, rispetto alla monoterapia con nivolumab (480 mg ogni 4 settimane). Questi risultati differiscono in modo significativo dai risultati dello studio adiuvante di fase II IMMUNED (Tab. 4). Questo studio ha dimostrato una chiara superiorità della terapia combinata adiuvante con nivolumab (1 mg/kg) e ipilumab (3 mg/kg) per 4 cicli ogni 3 settimane rispetto alla monoterapia con nivolumab (3 mg/kg) ogni 2 settimane o placebo nei pazienti con melanoma maligno in stadio IV senza evidenza di malattia dopo la chirurgia. L’hazard ratio per la recidiva era di 0,23 nel gruppo nivolumab/ipilimumab rispetto al gruppo placebo e di 0,56 nel gruppo nivolumab rispetto al gruppo placebo. Gli eventi avversi associati alla terapia di qualsiasi grado hanno portato all’interruzione del trattamento nel 62% dei pazienti del gruppo nivolumab/ipilimumab e nel 13% dei partecipanti allo studio che hanno ricevuto il trattamento con nivolumab [13].
Sulla base di questi risultati, i pazienti con melanoma maligno in stadio IV senza evidenza di malattia dovrebbero ricevere l’immunoterapia combinata adiuvante dopo la chirurgia o la radioterapia, indipendentemente dallo stato di mutazione BRAFV600. Per i pazienti con controindicazioni all’immunoterapia combinata con nivolumab e ipilumab, in questa situazione dovrebbe essere somministrato un anno di terapia adiuvante con nivolumab come monoterapia, in analogia allo studio CheckMate 238. Questa terapia ha un profilo di tossicità più controllabile ed è approvata per il trattamento dei pazienti con malattia in stadio IV completamente resecata [10].
Immunoterapia adiuvante negli stadi IIB e IIC
I pazienti con un melanoma resecato e uno spessore del tumore secondo Breslow di >4 mm o >2 mm in presenza di ulcerazione senza coinvolgimento linfonodale (stadio IIB o IIC secondo l’AJCC 8a edizione) hanno un rischio maggiore di recidiva. Il rischio di recidiva e di mortalità è paragonabile a quello dei pazienti con melanoma in stadio IIIA o IIIB. I dati dello studio randomizzato di fase III Keynote-716 sono stati presentati al Congresso ESMO 2021. Questi mostrano un miglioramento significativo della sopravvivenza libera da recidiva nei pazienti con melanoma in stadio IIB o IIC completamente resecato con 12 mesi di trattamento adiuvante con l’anticorpo anti-PD1 pembrolizumab rispetto al placebo (HR 0,65). Pembrolizumab non è ancora approvato per questa indicazione.
Valore della terapia sistemica adiuvante nello stadio IIIA
La prognosi nello stadio tumorale IIIA (secondo l’AJCC 8a edizione) è molto buona, con un tasso di sopravvivenza dell’88% dopo 10 anni. Questo fatto ha portato al dibattito se la terapia sistemica adiuvante sia un sovratrattamento per questo gruppo di pazienti. La ponderazione del rischio di tossicità grave e forse irreversibile rispetto al beneficio potenziale è particolarmente importante nei pazienti con melanoma in stadio IIIA.
Lo studio CheckMate-238 non ha incluso pazienti con melanoma in stadio AJCC IIIA (7a edizione) [12]. Al contrario, lo studio EORTC1325/Keynote-54 ha incluso pazienti con melanoma in stadio AJCC IIIA (7a edizione) con metastasi linfonodali superiori a 1 mm. Nel sottogruppo di pazienti con malattia di stadio AJCC IIIA (7° edizione), la sopravvivenza libera da recidiva a un anno è stata dell’89,8% con la terapia con pembrolizumab rispetto al 76,8% con placebo (HR 0,32, intervallo di confidenza al 99% 0,09 -1,23; p=0,0217). Dopo la riclassificazione dei pazienti secondo il melanoma AJCC 8a edizione, l’8% dei pazienti aveva un melanoma in stadio tumorale IIIA. Per quanto riguarda la sopravvivenza libera da recidiva, è stato osservato un effetto positivo comparabile in tutti i sottogruppi. Va notato che il tempo di follow-up era molto limitato e che l’intervallo di confidenza per i pazienti con tumori di stadio IIIA secondo l’AJCC 8a edizione era molto ampio [14]. Lo studio COMBI-AD ha incluso anche pazienti con stadio tumorale IIIA (AJCC 8a edizione) con metastasi al linfonodo sentinella di >1 mm. Anche in questo studio è stato documentato un effetto positivo per quanto riguarda la sopravvivenza libera da recidiva in tutti i sottogruppi, ma anche con un risultato meno chiaro per questo stadio [8].
Profilo degli effetti collaterali
Per la terapia adiuvante del melanoma BRAFV600-mutato in stadio III, sono disponibili sia gli inibitori del checkpoint immunitario nivolumab e pembrolizumab che il trattamento mirato con gli inibitori BRAF/MEK dabrafenib e trametinib. I profili degli effetti collaterali delle terapie mirate e degli inibitori del checkpoint immunitario differiscono in modo significativo. Mentre gli effetti collaterali reversibili sono più comuni con le terapie mirate, i rari effetti collaterali immuno-mediati possono essere di lunga durata e irreversibili con gli inibitori del checkpoint immunitario [15]. Questi effetti collaterali immuno-mediati possono interessare qualsiasi organo. Le endocrinopatie sono tra gli effetti collaterali immuno-mediati più comuni e, a differenza delle altre tossicità, sono solitamente irreversibili. Di conseguenza, richiedono una terapia sostitutiva a vita. Le complicanze endocrine più comuni sono la distireosi (30%), l’ipofisitide (5,6-11%), il diabete mellito di tipo 1 (0,2-2%) e l’insufficienza surrenalica (0,7%), sebbene siano stati descritti anche rari casi di ipoparatiroidismo. Inoltre, i limitati dati disponibili suggeriscono che l’ipogonadismo primario immuno-mediato dovuto all’orchite, o l’ipogonadismo secondario nel contesto dell’ipofisite, rappresentano un rischio potenziale per la successiva infertilità [16]. La metà di tutti i pazienti affetti da melanoma di una coorte nazionale danese, sottoposti a terapia adiuvante con nivolumab, ha interrotto prematuramente il trattamento previsto di un anno a causa di tossicità o recidiva. Inoltre, è stato documentato un deterioramento temporaneo della qualità di vita [17].
Le tossicità di grado 3 – 4 associate alla terapia si sono verificate nel 41% dei pazienti nel braccio di trattamento (dabrafenib in combinazione con trametinib) nello studio COMBI-AD, mentre ciò si è verificato solo nel 14% dei pazienti nel gruppo placebo. La piressia è il motivo più comune per la modifica della dose e l’interruzione del trattamento mirato.
Inoltre, i pazienti spesso manifestano sintomi generali non specifici, come la stanchezza o gli effetti collaterali gastrointestinali nel senso di nausea. Gli effetti collaterali cardiaci (disfunzione ventricolare sinistra, prolungamento dell’intervallo QT) si verificano raramente, anche se è indicato un regolare follow-up cardiologico. In generale, va notato che quando si verificano reazioni avverse ai farmaci, spesso è sufficiente ridurre la dose di uno o di entrambi i farmaci. Gli effetti collaterali sono di solito completamente reversibili dopo l’interruzione della terapia combinata.
Selezione della terapia sistemica adiuvante nella vita di tutti i giorni
Ci sono pochissimi dati sulla tossicità e sui tassi di interruzione del trattamento nella pratica quotidiana. In uno studio olandese, è stato dimostrato che un totale del 93% dei pazienti qualificati per la terapia adiuvante ha ricevuto il trattamento adiuvante anti-PD-1. Questi dati hanno mostrato un tasso di tossicità più elevato, con interruzioni premature del trattamento consecutive più frequenti. La sopravvivenza libera da recidiva è stata paragonabile a quella degli studi pivotal [18].
Per i pazienti con melanoma BRAF wild-type, il blocco di PD-1 è la terapia adiuvante di scelta. Per i pazienti con melanoma BRAFV600E/K-mutato, il rischio di eventi avversi immuno-mediati persistenti con l’immunoterapia deve essere considerato al momento di scegliere il trattamento adiuvante, poiché l’hazard ratio per la sopravvivenza libera da recidiva è comparabile nei tre studi di trattamento adiuvante. La scelta della terapia deve quindi essere discussa con i pazienti e fatta insieme.
Messaggi da portare a casa
- Lo spessore verticale del tumore secondo Breslow e la presenza di ulcerazione sono i fattori prognostici più importanti.
- La diagnostica molecolare patologica che utilizza il sequenziamento di nuova generazione (NGS) per determinare lo stato di BRAF dovrebbe essere effettuata a partire dallo stadio III.
- Una biopsia del linfonodo sentinella (SLNB) è raccomandata per uno stadio pT1b (cioè uno spessore del tumore secondo Breslow di >0,8 mm o <0,8 mm con ulcerazione) secondo l’AJCC 8a edizione. La dissezione linfonodale è indicata in caso di coinvolgimento linfonodale macroscopico, ma non è raccomandata in caso di linfonodo sentinella positivo.
- La terapia sistemica adiuvante con un anticorpo monoclonale anti-PD-1 o con inibitori BRAF/MEK è raccomandata a partire dallo stadio IIIA con metastasi al linfonodo sentinella >1 mm.
- La scelta della terapia di sistema adiuvante si basa sull’indicazione e sull’approvazione, tenendo conto dello stato di mutazione BRAF e del profilo degli effetti collaterali.
Letteratura:
- Siegel RL, Miller KD, Jemal A: Statistiche sul cancro, 2018. A Cancer Journal for Clinicians 2018; 68(1): 7-30.
- Akbani R, et al: Classificazione genomica del melanoma cutaneo. Cellula 2015; 161(7): 1681-1696.
- Hayes AJ, et al: Margini di escissione ampi rispetto a quelli stretti per i melanomi cutanei primari ad alto rischio: follow-up a lungo termine della sopravvivenza in uno studio randomizzato. The Lancet Oncology 2016; 17(2): 184-192.
- Morton DL, et al: Rapporto finale dello studio sulla biopsia del linfonodo sentinella rispetto all’osservazione nodale nel melanoma. New England Journal of Medicine 2014; 370(7): 599-609.
- Leiter U, et al: Analisi finale dello studio DeCOG-SLT: nessun beneficio di sopravvivenza per la dissezione linfonodale completa nei pazienti con melanoma con linfonodo sentinella positivo. J Clin Oncol 2019; 37(32): 3000-3008.
- Faries MB, et al: Dissezione completa o osservazione per le metastasi del linfonodo sentinella nel melanoma. N Engl J Med 2017; 376(23): 2211-2222.
- Michielin O, et al: Melanoma cutaneo: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 2019; 30(12): 1884-1901.
- Dummer R, et al: Analisi a cinque anni di Dabrafenib adiuvante più Trametinib nel melanoma in stadio III. N Engl J Med 2020; 383(12): 1139-1148.
- Eggermont AMM, et al: Pembrolizumab adiuvante rispetto al placebo nel melanoma resecato in stadio III (EORTC 1325-MG/KEYNOTE-054): risultati di sopravvivenza libera da metastasi a distanza di uno studio di fase 3 in doppio cieco, randomizzato e controllato. The Lancet Oncology 2021; 22(5): 643-654.
- Ascierto PA, et al: nivolumab adiuvante rispetto a ipilimumab nel melanoma resecato in stadio IIIB-C e in stadio IV (CheckMate 238): risultati a 4 anni di uno studio multicentrico, in doppio cieco, randomizzato, controllato, di fase 3. The Lancet Oncology. 2020. 21(11): 1465-1477.
- Long GV, et al: Dabrafenib adiuvante più trametinib nel melanoma mutato in BRAF in stadio III. New England Journal of Medicine 2017; 377(19): 1813-1823.
- Weber J, et al: nivolumab adiuvante rispetto a ipilimumab nel melanoma resecato in stadio III o IV. New England Journal of Medicine 2017; 377(19): 1824-1835.
- Zimmer L, et al: nivolumab adiuvante più ipilimumab o monoterapia con nivolumab rispetto al placebo in pazienti con melanoma resecato in stadio IV senza evidenza di malattia (IMMUNED): uno studio di fase 2 randomizzato, in doppio cieco, controllato con placebo. The Lancet 2020; 395(10236): 1558-1568.
- Eggermont AMM, et al: Valore prognostico e predittivo della stadiazione AJCC-8 nello studio di fase III EORTC1325/KEYNOTE-054 di pembrolizumab vs placebo nel melanoma resecato ad alto rischio in stadio III. European Journal of Cancer 2019; 116: 148-157.
- Ghisoni E, et al: Eventi avversi immunocorrelati ad insorgenza tardiva e di lunga durata dovuti agli inibitori del checkpoint immunitario: un aspetto trascurato nell’immunoterapia. Eur J Cancer. 2021. 149: 153-164.
- Ozdemir BC: Ipogonadismo e infertilità correlati agli inibitori del checkpoint immunitario: un problema trascurato nell’immuno-oncologia. J Immunother Cancer 2021; 9(2).
- Ellebaek EEA: Uno studio nazionale, di vita reale, sull’esito e la qualità di vita dopo l’introduzione dell’immunoterapia adiuvante per i pazienti danesi affetti da melanoma. ESMO Abstract 1071P, 2021.
- De Meza MEA: Trattamento adiuvante per il melanoma nella pratica clinica: sperimentazione contro realtà. ESMO Abstract 1070P, 2021.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(6): 10-15