I tumori a cellule germinali sono complessivamente rari, ma allo stesso tempo sono i tumori più comuni nei giovani uomini. La gestione varia a seconda dello stadio e del gruppo di prognosi. La terapia adeguata e appropriata allo stadio dei tumori germinali metastatizzati rappresenta una sfida in questo contesto.
Il tumore a cellule germinali è un’entità rara nel complesso, ma allo stesso tempo il tumore più comune nei giovani uomini. La terapia adeguata e appropriata allo stadio dei tumori germinali metastatizzati rappresenta una sfida in questo contesto. Di seguito, la terapia di prima linea dei tumori metastatici primari e la terapia in caso di recidiva sono spiegate in modo più dettagliato.
Introduzione
I tumori delle cellule germinali rappresentano circa il 2% di tutti i tumori maligni e sono la neoplasia più comune negli uomini di età compresa tra i 15 e i 45 anni. In Svizzera, circa 400 uomini si ammalano ogni anno e circa 14 muoiono ogni anno. Grazie all’applicazione di concetti terapeutici adeguati allo stadio, è possibile raggiungere un tasso di guarigione superiore al 90% in tutti gli stadi. Istologicamente, i seminomi si distinguono dai tumori germinali non seminomatosi. Mentre il 95% dei tumori testicolari negli uomini si verifica nel testicolo, circa il 5% è localizzato principalmente a livello extragonadico. I fattori di rischio noti includono il criptorchidismo, la storia di cancro ai testicoli, l’anamnesi familiare positiva, l’infertilità e la sindrome di Klinefelter.
Il sintomo più comune è un ingrossamento o gonfiore non doloroso del testicolo. In rari casi, i pazienti notano anche segni di una malattia più avanzata, come dolore alla schiena, dispnea, perdita di peso o sintomi neurologici. Dal punto di vista diagnostico, sono obbligatori l’esame clinico con palpazione dei testicoli, l’ecografia di entrambi i testicoli e la determinazione di laboratorio supplementare dei marcatori tumorali HCG, AFP e LDH. I marcatori tumorali spesso possono già dimostrare la neoplasia e servono anche per il monitoraggio della terapia e il controllo del follow-up. Viene sempre eseguita una tomografia computerizzata di torace, addome e bacino. La diagnostica per immagini della testa e delle ossa è consigliata obbligatoriamente solo in caso di metastasi estese, soprattutto polmonari, di marcatori tumorali molto elevati, di evidenza di sintomi clinici o di recidiva. Se il paziente desidera avere figli, prima di iniziare la terapia deve sempre effettuare un’analisi dello sperma e la successiva crioconservazione.
L’orchiectomia è spesso il primo passo terapeutico, e anche già curativo, nello stadio I localizzato. Nel caso di tumori a cellule germinali con un carico tumorale elevato, una costellazione di marcatori tumorali molto alta o con metastasi sintomatiche pronunciate, invece, l’orchiectomia viene eseguita solo dopo il completamento della terapia di sistema.
La corretta classificazione degli stadi tumorali è importante per la scelta della terapia e la valutazione della prognosi e ottimizza le possibilità di guarigione. In questo contesto, l’uso della chemioterapia, della chirurgia e della radioterapia, la selezione dei farmaci necessari e il tipo e la durata della loro applicazione sono definiti con precisione da raccomandazioni e linee guida internazionali di consenso.
Nei tumori a cellule germinali gonadiche di stadio I, la malattia è limitata al testicolo. Spesso, in questo caso, l’orchiectomia è seguita dalla sola sorveglianza (“sorveglianza attiva”) per i seminomi e i non-seminomi. Tuttavia, se sono presenti alcuni fattori di rischio, può essere necessaria la chemioterapia o la radioterapia adiuvante nello stadio localizzato e, raramente, la resezione chirurgica dei linfonodi retroperitoneali (RPLND).
A partire dallo stadio II, si parla di malattia metastatizzata. Tutti i pazienti con uno stadio tumorale >IIB e III richiedono la chemioterapia primaria e sono anche assegnati a un gruppo di rischio specifico secondo la cosiddetta classificazione di rischio IGCCCG (International Germ Cell Cancer Collaborative Group) (Tabella 1) . Dopo la terapia sistemica, i non seminomi con un tumore residuo di >1 cm, è obbligatoria la cosiddetta resezione del tumore residuo (RTR).
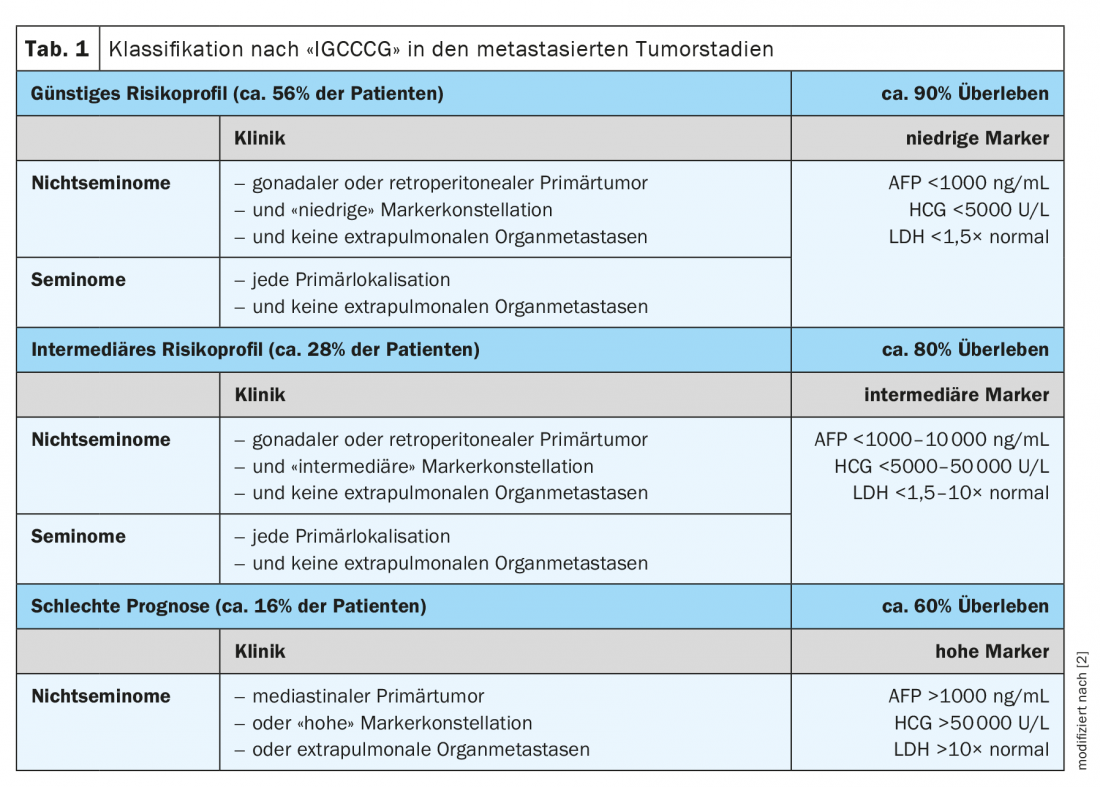
Circa il 5-10% di tutti i pazienti e il 30% dei pazienti che hanno già avuto una metastasi subiscono una recidiva nel corso della malattia. In questo contesto clinico, come nella situazione primaria, è importante un approccio adattato al rischio basato su fattori prognostici.
Trascurare gli standard terapeutici può portare a un tasso più elevato di fallimento della terapia, con la necessità di terapie di follow-up o addirittura alla morte, sia nella terapia primaria che in quella di ricaduta. Pertanto, i pazienti, soprattutto nella situazione di metastasi e recidiva o in presenza di scenari patologici rari (coinvolgimento del SNC, recidive tardive, ecc.), dovrebbero essere presentati a cliniche con un’elevata esperienza per una consulenza.
Terapia di prima linea nello stadio II
Nel raro seminoma di stadio IIA, la radioterapia ( radioterapia a campo coinvolto) rimane la prima opzione di trattamento al di fuori degli studi clinici. Tutti gli stadi del seminoma, a partire dallo stadio IIB, sono trattati principalmente con tre cicli di chemioterapia combinata con i farmaci cisplatino, etoposide e leomicina (PEB) ogni 21 giorni o, in alternativa, con quattro cicli di cisplatino/etoposide (PE) (Tab. 2) . Anche la radioterapia può essere discussa [1,2].

Attualmente, anche i pazienti in Svizzera possono essere arruolati in uno studio clinico di fase III (SAKK 01/18). I pazienti ricevono una chemio-radioterapia combinata (1 ciclo di carbo-platino AUC 7 seguito da radioterapia del linfonodo coinvolto con 24 Gy in II A o 1 ciclo di PE e successiva radioterapia del linfonodo coinvolto con 30 Gy in II B). Ulteriori studi di fase II in Germania o
negli Stati Uniti stanno attualmente studiando la sola chirurgia senza terapia adiuvante (PRIMETEST, NCT 02797626).
I pazienti con costellazione normale di marcatori tumorali e linfonodi retroperitoneali sospetti dal punto di vista dell’immagine (per lo più di 1-2 cm di diametro) rappresentano una sottopopolazione speciale. In questi pazienti, si raccomanda un follow-up di imaging a breve termine, 6-8 settimane dopo, con un attento monitoraggio concomitante dei marcatori. La RPLND può essere richiesta nei pazienti con non-seminomi i cui linfonodi (LK) sono invariati con i marcatori tumorali che rimangono normali, per escludere il teratoma. In alternativa, viene effettuato un ulteriore controllo. Tutti i pazienti con marcatori tumorali che aumentano durante il decorso della malattia e/o linfonodi in rapida crescita all’imaging richiedono l’inizio immediato della chemioterapia secondo la stratificazione del rischio per i tumori avanzati [3].
Il trattamento di tutti i seminomi metastatici dello stadio IIC consiste nella chemioterapia secondo il regime PEB (cisplatino, etoposide, bleomicina) [1,2]. La durata e l’intensità si basano sulla classificazione del rischio IGCCCG. Se il gruppo di prognosi è buono, i pazienti vengono trattati con un totale di tre cicli di PEB a intervalli di 21 giorni. Il gruppo a prognosi intermedia o scarsa viene trattato con quattro cicli allo stesso intervallo. Se esiste una controindicazione alla bleomicina, quattro cicli di PE (cisplatino, etoposide) sono equivalenti a tre cicli di PEB in un gruppo a buona prognosi. Nel gruppo a prognosi intermedia e scarsa, vengono applicati quattro cicli di PEI (cisplatino, etoposide, ifosfamide) invece di quattro cicli di PEB.
I non-seminomi in stadio II con marcatori tumorali elevati vengono trattati in base alla loro classificazione IGCCCG, secondo l’algoritmo terapeutico per gli stadi tumorali avanzati [2].
Terapia di prima linea nello stadio III
La terapia standard si basa sulla stratificazione del rischio secondo la classificazione del rischio IGCCCG, indipendentemente dall’istologia. Consiste in una chemioterapia con tre (per il gruppo a buona prognosi) o quattro cicli (per il gruppo a prognosi intermedia o scarsa) di PEB a intervalli di 21 giorni (in alternativa 4 cicli di PE per la prognosi buona o 3 – 4 cicli di PEI per la prognosi intermedia/povera) [2].
Negli ultimi anni, sono state studiate strategie di chemioterapia intensificata, soprattutto per i gruppi a prognosi intermedia e scarsa. Per la prima volta, uno studio prospettico randomizzato (GETUG13) condotto da un gruppo di ricerca francese è stato in grado di dimostrare un vantaggio nella sopravvivenza libera da progressione nei pazienti con un declino inadeguato dei marcatori nel primo ciclo, attraverso una successiva intensificazione della terapia [4].
I dati americani per il regime TIP con paclitaxel, ifosfamide e cisplatino, che finora è stato utilizzato solo nella terapia di salvataggio, hanno anche mostrato ottimi risultati a lungo termine in questa popolazione di pazienti in uno studio di fase II, ma senza vantaggi significativi rispetto alla terapia standard [5]. L’aggiunta di paclitaxel al PEB nel gruppo di pazienti a rischio intermedio in uno studio EORTC ha mostrato un miglioramento significativo del 12% nella sopravvivenza libera da progressione, ma senza un prolungamento significativo della sopravvivenza globale con aumento della tossicità [6].
Sono state condotte molte ricerche anche sul valore della chemioterapia primaria ad alte dosi (HDCT) con il supporto di cellule staminali autologhe nella terapia primaria, soprattutto nel gruppo di pazienti con caratteristiche prognostiche sfavorevoli secondo l’IGCCCG. In uno studio multicentrico di fase II del German Testicular Tumour Study Group, è stata esaminata la HDCT sequenziale con cisplatino, etoposide e ifosfamide (HD-PEI), che ha mostrato un tasso di sopravvivenza a lungo termine del 75%. Uno studio randomizzato di fase III condotto negli Stati Uniti, che ha confrontato la somministrazione di quattro cicli di PEB con due cicli di PEB seguiti da due cicli di chemioterapia ad alto dosaggio con carboplatino, etoposide e ciclofosfamide (CEC), non è riuscito a dimostrare un vantaggio generale a favore della HDCT. Solo i pazienti i cui marcatori tumorali non erano diminuiti adeguatamente nel tempo hanno beneficiato maggiormente del trattamento nel braccio ad alto dosaggio. Anche lo studio randomizzato di fase III pubblicato dall’EORTC, che ha confrontato quattro cicli di PEB con la somministrazione sequenziale di PEI ad alte dosi, non ha mostrato alcun beneficio statisticamente significativo a favore dell’HDCT [7,8]. L’uso dell’HDCT nella terapia primaria per i pazienti con fattori prognostici sfavorevoli non è quindi ancora standard al momento.
L’HDCT primaria può comunque essere utile in casi individuali, soprattutto nei pazienti con un declino inadeguato dei marcatori dopo il primo ciclo di terapia con dosaggio convenzionale, nei pazienti con un non-seminoma prevalentemente mediastinico e nei pazienti con metastasi al SNC o metastasi epatiche o ossee estese. Questa procedura deve essere decisa solo in consultazione con centri esperti e, se possibile, i dati devono essere registrati in un registro.
Resezione del tumore residuo (RTR) dopo la terapia di prima linea
Nei pazienti con seminoma e residui tumorali post-chemioterapia, la RTR non è obbligatoria. In caso di residui >3 cm, si può discutere una PET-CT non prima di otto settimane dal completamento della chemioterapia. Solo in questa costellazione il PET è un’indicazione degna di essere presa in considerazione. Nei pazienti positivi alla PET, l’esame deve essere ripetuto nell’intervallo mediante controlli TC o, se necessario, deve essere valutata una biopsia per escludere in modo affidabile possibili risultati falsi positivi con una costellazione di marcatori contemporaneamente normale [9].
In tutti i pazienti non affetti da seminoma con residui tumorali >1 cm, una RTR deve essere eseguita precocemente, da circa quattro a un massimo di otto settimane dopo il completamento della chemioterapia, con l’obiettivo di rimuovere completamente tutti i residui tumorali. Questo intervento, spesso complesso, dovrebbe avvenire solo in un centro interdisciplinare con le competenze adeguate. Se nel resecato vengono rilevate cellule tumorali vitali, la procedura successiva non è chiaramente definita. Nel caso di una percentuale di cellule tumorali vitali nel tessuto resecato pari a >10%, si può discutere sia la terapia rinnovata con due cicli di chemioterapia che la sola cura di follow-up [10].
Terapia di salvataggio
Il trattamento dei pazienti con seminoma o non seminoma e recidiva da uno stadio I è analogo agli algoritmi di trattamento dei pazienti con malattia metastatica primaria [1].
I pazienti che sviluppano una recidiva dopo la chemioterapia primaria con almeno tre cicli di terapia contenente cisplatino ricevono un nuovo trattamento chemioterapico intensivo. Questo viene integrato da una successiva RTR nei pazienti non affetti da seminoma. Le opzioni di trattamento sono, in linea di principio, la terapia di salvataggio convenzionale a base di cisplatino (CDCT) o la chemioterapia sequenziale ad alte dosi con trapianto autologo di cellule staminali (HDCT). In alcuni scenari, è indicata anche la chirurgia di salvataggio da sola (ad esempio, Teratoma Crescente) [11].
Il trattamento da prendere in considerazione per il singolo paziente dipende principalmente dal momento in cui si verifica la ricaduta della malattia, oltre che da alcuni fattori di rischio. A seconda dei fattori di rischio, si distinguono cinque categorie di prognosi. La PFS stimata a 2 anni secondo Kaplan-Meier è del 75% per i pazienti nel gruppo a rischio molto basso, del 51% nel gruppo a rischio basso, del 40% nel gruppo a rischio medio, del 26% nel gruppo a rischio alto e del 6% nel gruppo a rischio molto alto [12].
Terapia di salvataggio convenzionale con cisplatino
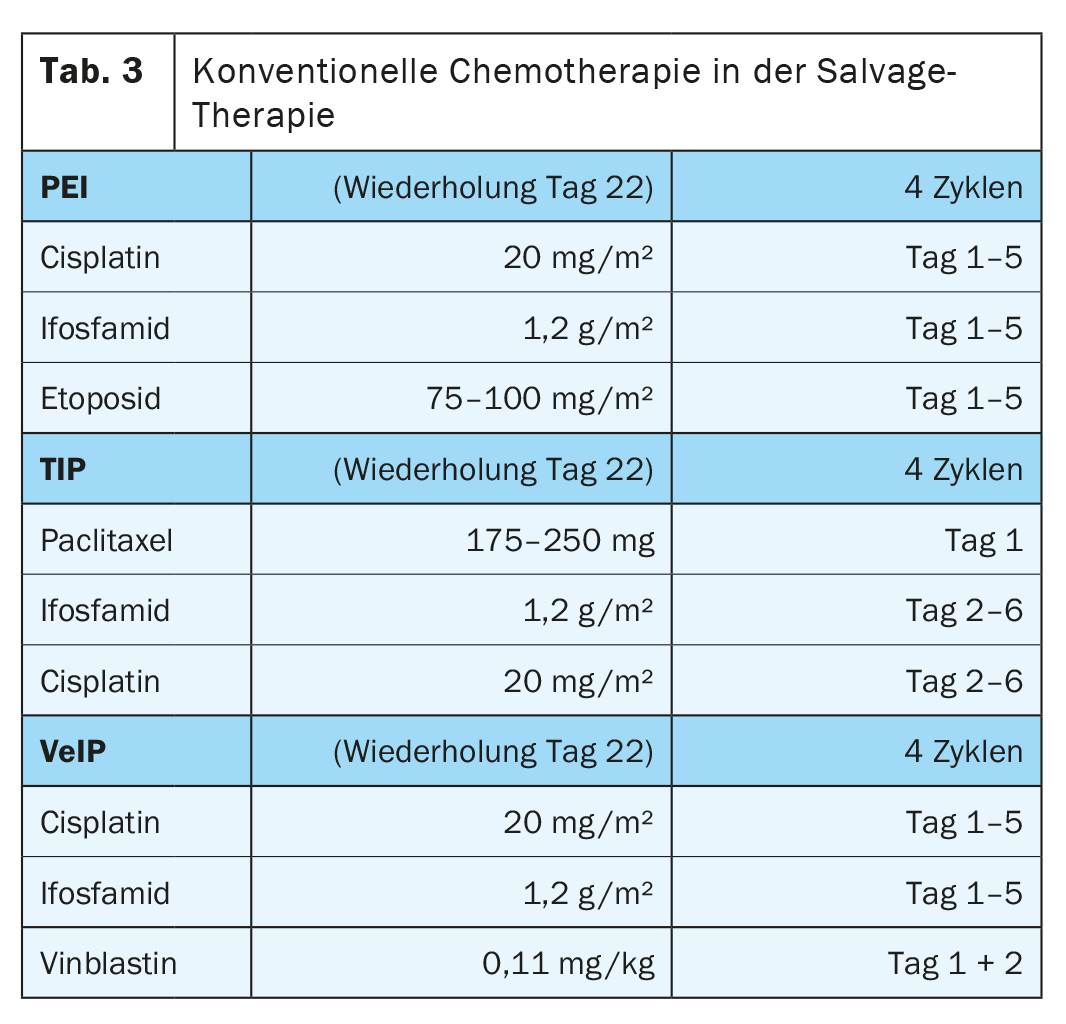
I regimi combinano il cisplatino (che non può essere sostituito dal carboplatino) e l’ifosfamide con l’etoposide (PEI), con la vinblastina (VeIP) o con il paclitaxel (TIP), senza una chiara superiorità di una particolare combinazione terapeutica (Tab. 3) . Lo standard della chemioterapia combinata prevede la somministrazione di quattro cicli a intervalli di 21 giorni [3].
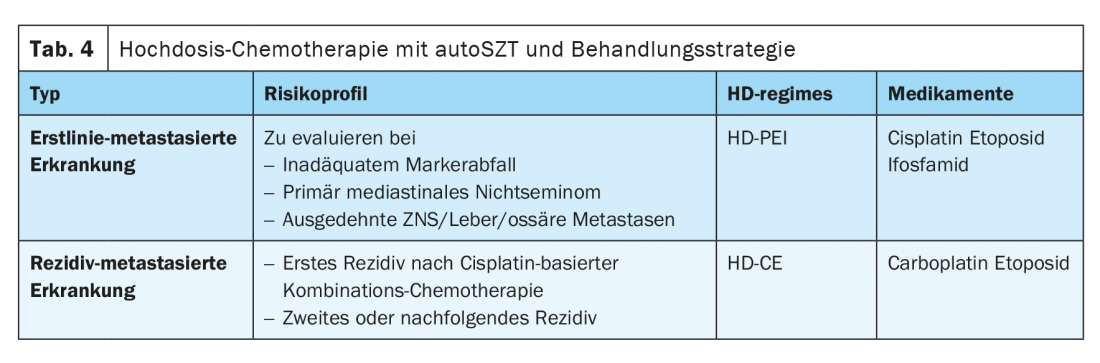
Chemioterapia sequenziale ad alto dosaggio con trasfusione autologa di cellule staminali (HDCT)
La combinazione di carboplatino ed etoposide (CE) costituisce il quadro di base della HDCT. Oggi, questo viene effettuato in quasi tutti i centri del mondo sotto forma di terapia sequenziale con due o tre cicli di CE ad alte dosi. (Tab. 4). Il miglioramento della terapia di supporto e l’uso di cellule staminali autologhe del sangue periferico (PBSC) hanno accorciato in modo significativo i tempi di ricostituzione ematopoietica, riducendo così la mortalità correlata al trattamento, inizialmente elevata, da oltre il 10% a meno del 3%.
L’importanza della HDCT come prima terapia di salvataggio è ancora controversa e oggetto di discussioni attuali. L’analisi di sottogruppo di uno studio retrospettivo di quasi 1600 cartelle di pazienti con terapia di salvataggio primaria è stata in grado di mostrare un vantaggio a favore della HDCT rispetto alla CDCT nel trattamento della prima recidiva. Questi risultati sono in contrasto con i dati di uno studio prospettico randomizzato che non ha dimostrato un chiaro beneficio dell’HDCT nella prima recidiva [13,14].
Uno studio globale randomizzato di fase III che confronta il regime convenzionale con la TIP e la chemioterapia sequenziale ad alte dosi (CE) (studio TIGER) sta attualmente convalidando in modo prospettico il beneficio della HDCT nella prima ricaduta. I pazienti possono essere inclusi anche in Svizzera.
Nella seconda o successiva ricaduta, l’HDCT può anche ottenere una remissione a lungo termine in una piccola percentuale di pazienti. Tuttavia, anche in questo caso, le dimensioni ridotte e l’eterogeneità dei gruppi di pazienti studiati rendono difficile l’interpretazione dei risultati degli studi disponibili [15].
Resezione del tumore residuo dopo la terapia di salvataggio
La percentuale di pazienti con istologia vitale e indifferenziata è complessivamente più alta dopo la chemioterapia di ricaduta. Dopo il completamento della terapia sistemica, la RTR dovrebbe quindi essere valutata in tutti i pazienti con non-seminomi e residui rilevabili. In singoli pazienti senza normalizzazione dei marcatori o recidive multiple, refrattarie alla chemioterapia, la resezione nel senso della cosiddetta “chirurgia della disperazione” può ancora portare alla remissione in casi eccezionali, soprattutto in presenza di manifestazioni tumorali singolari e facilmente resecabili e di un unico innalzamento dell’AFP [3,16].
Ricadute tardive
Le recidive che si verificano almeno due anni dopo l’ultima chemioterapia contenente cisplatino sono chiamate recidive tardive. Nella malattia resecabile, la rimozione chirurgica primaria è il trattamento di scelta. In caso di reperti non resecabili e/o di marcatori tumorali molto elevati (soprattutto l’HCG), è necessario somministrare prima una terapia sistemica (sotto forma di CDCT o HDCT) e procedere alla resezione dopo il completamento della chemioterapia. Più frequentemente, nelle recidive tardive, si trovano istologie sfavorevoli con trasformazione in sarcomi o adenocarcinomi, tra gli altri, nel resecato [16].
Infestazione del sistema nervoso centrale
Raramente si verificano metastasi al sistema nervoso centrale. Questi possono verificarsi sia in modo sincrono alla diagnosi primaria che alla recidiva. La recidiva cerebrale isolata si riscontra solo nel 2% circa dei pazienti. Oltre a identificare i fattori prognostici, uno studio retrospettivo ha confrontato le singole modalità di trattamento di chemioterapia, radioterapia e resezione e ha analizzato la sopravvivenza dei pazienti sia alla diagnosi primaria che alla recidiva. Ad esempio, è stato dimostrato che dopo la diagnosi, la radioterapia e/o la resezione non devono necessariamente essere effettuate in aggiunta alla chemioterapia. Al contrario, nella situazione di recidiva, l’utilizzo massimo di tutte le forme di terapia, compresa la HDCT, sembra migliorare significativamente la sopravvivenza dei pazienti [17].
Recidiva dopo HDCT e autoSCT
I pazienti con recidive multiple o con recidive dopo la chemioterapia ad alte dosi raramente guariscono. Tuttavia, attraverso l’uso ben coordinato della chemioterapia palliativa, della resezione palliativa del tumore, se necessario, o anche della radioterapia palliativa, è spesso possibile ottenere un sollievo dai sintomi e quindi una migliore qualità di vita.
Oltre al paclitaxel, anche le sostanze oxaliplatino e gemcitabina mostrano efficacia e vengono utilizzate come sostanze singole o in varie combinazioni. Il regime GOP, che combina l’oxaliplatino con la gemcitabina e il paclitaxel, è particolarmente efficace e può portare a remissioni a lungo termine in singoli pazienti, anche nelle ricadute dopo una precedente HDCT. L’efficacia palliativa è stata dimostrata anche per l’uso di etoposide orale. Purtroppo, finora non esiste un’alternativa efficace alla chemioterapia; in particolare, gli inibitori della tirosin-chinasi e del checkpoint non hanno dimostrato alcuna efficacia negli studi clinici [2,3,18].
Messaggi da portare a casa
- Il tumore a cellule germinali è il tumore più comune nei giovani uomini.
- Nello stadio metastatico, la classificazione viene fatta in tre gruppi di prognosi: buona, intermedia e scarsa, a seconda del livello del marcatore e del coinvolgimento viscerale.
- La chemioterapia con PEB è la terapia standard per i tumori in stadio avanzato; in alternativa si possono utilizzare PE o PEI.
- Il numero di cicli nella terapia primaria dipende dal gruppo di prognosi.
- Per i non-seminomi, la resezione del tumore residuo è obbligatoria per i residui >1 cm.
- Nella situazione di salvataggio, si esegue una chemioterapia convenzionale o ad alto dosaggio con supporto di cellule staminali autologhe.
- I pazienti con recidive tardive e del sistema nervoso centrale rappresentano una forma speciale.
Letteratura:
- Honecker F, et al: Conferenza di consenso ESMO sul tumore a cellule germinali del testicolo: diagnosi, trattamento e follow-up. Ann Oncol. 2018; 29(8): 1658-1686.
- Classificazione internazionale di consenso delle cellule germinali: un sistema di stadiazione basato su fattori prognostici per i tumori metastatici delle cellule germinali. Gruppo Collaborativo Internazionale sul Cancro delle Cellule Germinali. J Clin Oncol. 1997; 15: 594-603.
- Linee guida dell’Oncopedia Tumori delle cellule germinali del maschio. www.onkopedia.com (ultimo accesso 03/2021)
- Fizazi K, et al: Chemioterapia personalizzata basata sul declino dei marcatori tumorali nei tumori a cellule germinali a prognosi sfavorevole (GETUG 13): uno studio di fase 3, multicentrico e randomizzato. Lancet Oncol. 2014; 15: 1442-1450.
- Feldman DR, et al: Efficacia di Paclitaxel, Ifosfamide e Cisplatino per il trattamento di prima linea dei pazienti con tumori a cellule germinali a rischio intermedio o scarso. J Clin Oncol. 2016; 34(21): 2478-2483.
- de Wit R, et al: Studio randomizzato di fase III che confronta paclitaxel-bleomicina, etoposide e cisplatino (BEP) con BEP standard nel tumore a cellule germinali a prognosi intermedia: studio intergruppo EORTC 30983. J Clin Oncol. 2012; 30(8): 792-799.
- Motzer RJ, et al: Studio randomizzato di fase III sulla chemioterapia a dosi convenzionali con o senza chemioterapia ad alte dosi e salvataggio con cellule staminali ematopoietiche autologhe come trattamento di prima linea per i pazienti con tumori a cellule germinali metastatici a scarsa prognosi. J Clin Oncol. 2007; 25: 247-256.
- Daugaard G, et al.: Studio randomizzato di fase III che confronta la dose standard di BEP con la dose sequenziale di cisplatino, etoposide e ifosfamide (VIP) ad alto dosaggio più il supporto delle cellule staminali nei maschi con tumore a cellule germinali a prognosi sfavorevole. Uno studio intergruppo di EORTC, GTCSG e Grupo Germinal (EORTC 30974). Ann Oncol. 2011; 22: 1054-1061.
- Cathomas R, et al: Mettere in discussione il valore della tomografia ad emissione di positroni con fluorodesossiglucosio per le lesioni residue dopo la chemioterapia per il seminoma metastatico: risultati di un registro internazionale del Gruppo Globale sul Cancro delle Cellule Germinali. J Clin Oncol. 2018. DOI: 10.1200/JCO.18.00210.
- Heidenreich A: Resezione del tumore residuo dopo la chemioterapia induttiva nel cancro testicolare avanzato. Eur Urol. 2007; 51: 299-301.
- Lorch A, et al.: Chemioterapia sequenziale rispetto a quella singola ad alte dosi nei pazienti con tumori a cellule germinali recidivati o refrattari: risultati a lungo termine di uno studio prospettico randomizzato. J Clin Oncol. 2012; 30: 800-805.
- Lorch A, et al: Fattori prognostici nei pazienti con tumori metastatici a cellule germinali che hanno sperimentato un fallimento del trattamento con la chemioterapia di prima linea a base di cisplatino. J Clin Oncol. 2010; 28: 4906-4911.
- Lorch A, et al.: Chemioterapia a dosi convenzionali rispetto a quella ad alte dosi come primo trattamento di salvataggio nei pazienti di sesso maschile con tumori a cellule germinali metastatici: prove da un ampio database internazionale. J Clin Oncol. 2011; 29: 2178-2184.
- Pico JL, et al: Uno studio randomizzato sulla chemioterapia ad alte dosi nel trattamento di salvataggio dei pazienti che falliscono la chemioterapia di prima linea con platino per i tumori a cellule germinali avanzati. Ann Oncol. 2005; 16: 1152-1159.
- Adra N, et al: Chemioterapia ad alto dosaggio e trapianto autologo di cellule staminali del sangue periferico per tumori metastatici recidivati a cellule germinali: l’esperienza dell’Indiana University. J Clin Oncol. 2017; 35(10): 1096-1102.
- Albers P, et al: Linee guida sul cancro al testicolo: aggiornamento 2015. Eur Urol. 2015; 68(6): 1054-1068.
- Feldman DR, et al: Metastasi cerebrali nei pazienti con tumori a cellule germinali: fattori prognostici e opzioni di trattamento – un’analisi del Global Germ Cell Cancer Group. J Clin Oncol. 2016; 34: 345-351.
- Bokemeyer C, et al.: Chemioterapia combinata con gemcitabina, oxaliplatino e paclitaxel nei pazienti con tumori germinali refrattari al cisplatino o con recidiva multipla: uno studio del Gruppo tedesco di studio sul cancro testicolare. Ann Oncol. 2008; 19: 448-453.
InFo ONCOLOGIA & EMATOLOGIA 2022; 10(5): 6-10











